7 دقیقه
یک مطالعه آزمایشگاهی جدید از دانشگاه آرهوس نشان میدهد مکانیسمی که در آن اولیگومرهای آلفا‑سینوکلئین — تجمعات کوچک یک پروتئین که پیشتر در بیماری پارکینسون دخیل شناخته شدهاند — میتوانند بهصورت فیزیکی غشاهای سلولی را بشکنند و روزنههای گذرا ایجاد کنند. این بازشدگیهای میکروسکوپی اجازه عبور کنترلنشده یونها و مولکولهای کوچک را میدهند که میتواند شیمی داخل سلول را مختل کرده و به نارسایی نورونی کمک کند. این یافتهها تصویر دقیقتری از چگونگی آسیب تجمعات پروتئینی به سلولهای مغزی ارائه میکنند و اهداف جدیدی برای مداخله درمانی پیشنهاد میکنند.
پیشزمینه علمی: آلفا‑سینوکلئین، اولیگومرها و نورودژنراسیون
آلفا‑سینوکلئین یک پروتئین طبیعی نورونی است که در ترافیک گویچههای سیناپسی و آزادسازی انتقالدهندههای عصبی نقش دارد. در بیماری پارکینسون این پروتئین ممکن است دچار تاخوردگی نادرست شده و در قالب فیبریلهای بزرگتری انباشته شود که به آنها اجسام لوی گفته میشود. در کنار این فیبریلها، تجمعات کوچک و محلولتری بهنام اولیگومرها نیز معمولاً مشاهده میشوند و بسیاری از پژوهشگران این اولیگومرها را بهویژه سمی میدانند. مطالعه جدید بر این اولیگومرها و تعامل فیزیکی آنها با دولایههای لیپیدی، عنصر ساختاری پایهای غشاهای سلولی، متمرکز شده است.
قبلاً پیشنهاد شده بود که اولیگومرها میتوانند باعث اختلال غشا شوند، اما تیم آرهوس از یک مدل غشایی ساده و کنترلشده استفاده کردند تا فرایند را با جزئیاتی بیسابقه مشاهده کنند. با جداسازی این تعامل، آنها توانستند تغییرات مرحلهبهمرحلهای را ثبت کنند که از تماس اولیه تا تشکیل روزنه پیش میرود.
طراحی آزمایش و مشاهدات کلیدی
پژوهشگران با استفاده از مدلهای غشایی مصنوعی که ترکیب لیپیدی نورونی را تقلید میکنند، اولیگومرهای آلفا‑سینوکلئین را وارد کردند و همزمان یکپارچگی غشا را با تصویربرداریِ با وضوح بالا و اندازهگیریهای الکتریکی پایش نمودند. تیم یک فرایند سهمرحلهای را توصیف میکند: اتصال اولیه اولیگومرها به سطح غشا، وارد شدن جزئی به درون دولایه لیپیدی، و در نهایت بازآرایی به ساختارهای روزنهای که غشا را دربر میگیرند.
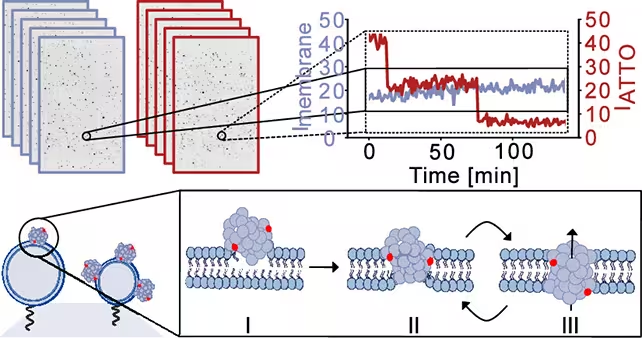
پژوهشگران از غشاهای سلولی شبیهسازیشده عکسهایی گرفتند تا نحوه نقض شدن آنها و نشت ایجادشده را دنبال کنند. (Bro̷chner et al., ACS Nano, 2025)
زمانی که روزنهها تشکیل شدند، ثابت باقی نمیماندند. در عوض رفتار پویایی نشان دادند — بهصورت مکرر در بازههای زمانی کوتاه باز و بسته میشدند. این تزلزل مهم است زیرا میتواند باعث فورانهای دورهای یون شود که بهتدریج هومئوستاز سلولی را مختل میکند، نه اینکه فوراً موجب فروپاشی کامل شود.
اولویت انحنای غشا و آسیبپذیری میتوکندریها
یکی از مشاهدات قابل توجه، تمایل اولیگومرها به غشاهای با انحنای بیشتر بود. غشاهای بسیار منحنیشده مشخصه اندامکهای درونسلولی مانند میتوکندریها هستند. میتوکندریها در تولید انرژی نورونها و بافرینگ کلسیم نقش محوری دارند؛ اگر غشاهای آنها بارها و بارها سوراخ شوند، ممکن است این امر باعث نارسایی انرژی، استرس اکسیداتیو و فعال شدن مسیرهای پسرو مرتبط با نوروژنراسیون شود.
پیامدها برای مکانیسمها و درمان پارکینسون
اگر اولیگومرهای آلفا‑سینوکلئین در شرایط زنده نیز روزنههای گذرا در غشاهای نورونی ایجاد کنند، این میتواند مکانیزم مستقیمی برای توضیح چگونگی ایجاد اختلال عملکرد پیش از مرگ سلولی فراهم کند. عدم تعادلهای یونی گذرا که بهصورت تکراری رخ میدهند میتوانند سیگنالدهی سیناپسی را تضعیف، هومئوستاز کلسیم را مختل و مقاومت نورون را بهتدریج کاهش دهند. طبیعت پویا و برگشتپذیر این روزنهها ممکن است توضیح دهد که چرا نورونها در پارکینسون اغلب برای مدت طولانی زنده میمانند با وجود اینکه عملکردشان بهتدریج کاهش مییابد.
بو ولف برُکنِر، زیستشناس مولکولی و نویسنده همکار این مطالعه، پیشنهاد میکند که باز و بسته شدن روزنهها ممکن است به پمپهای سلولی اجازه دهد موقتاً جبران کنند و از فروپاشی سریع جلوگیری کنند. آن پنجره جبرانی میتواند فرصت مناسبی برای درمانها باشد تا تعادل را بازگردانده یا تشکیل روزنه را مسدود کنند.
تیم آرهوس در حال حاضر پروبهای مولکولیای بهنام نانوبادیها — قطعات کوچک آنتیبادی — را بررسی کرده است که میتوانند آلفا‑سینوکلئین اولیگومریک را پس از شکلگیری تشخیص دهند. هرچند این نانوبادیها برای آشکارسازی مفید هستند، تاکنون در جلوگیری از تشکیل روزنه موفق نبودهاند. راهبردهای درمانی آینده ممکن است شامل موارد زیر باشد:
- پایدارسازی آلفا‑سینوکلئین در ساختارهای غیرسمی
- مسدودسازی مستقیم تشکیل روزنه با مولکولهای کوچک یا آنتیبادیها
- حفاظت یا تعمیر غشاهای میتوکندریایی
- افزایش پاکسازی سلولی اولیگومرها از طریق مسیرهای پروتئواستاز و اتوفاژی
محدودیتها و گامهای بعدی
این آزمایشها از سیستمهای مصنوعی تمیز استفاده کردند تا متغیرهای منفرد را جدا کنند. آن وضوح تجربی یک نقطه قوت است — اما یافتهها اکنون نیاز به تأیید در نورونهای زنده و مدلهای حیوانی دارند که در آنها ترکیب غشا، شرکای پروتئینی و دفاعهای سلولی پیچیدهتر است. پژوهشگران باید تأیید کنند که آیا تشکیل روزنه توسط اولیگومرها در مغزِ یکپارچه رخ میدهد، با چه فرکانسی اتفاق میافتد و کدام زیرنوعهای نورونی آسیبپذیرتر هستند.
در کارهای بعدی باید اندازه، طول عمر و گزینشپذیری یونی روزنهها کمّیسازی شود و بررسی گردد چگونه با مکانیسمهای تعمیر سلولی تعامل دارند. اگر در شرایط زنده تأیید شود، این روزنهها میتوانند به یک نشانگر قابل اندازهگیری برای استرس نورونی اولیه تبدیل شده و هدفی برای درمانهای اصلاحکننده بیماری شوند.
دیدگاه کارشناسی
تفسیر یک نوروساینتیست فعال
دکتر النا مارکز، مدرس ارشد نوروبیولوژی (شخصیت ساختگی)، اظهار میکند: "این مطالعه ارتباط مکانیکی قانعکنندهای بین آلفا‑سینوکلئین اولیگومریک و اختلال غشایی نشان میدهد. تصویربرداری مرحلهبهمرحله اتصال، ورود و تشکیل روزنه به همسویی سمّیت بیوشیمیایی با نتایج فیزیولوژیک کمک میکند — بهصورت ناهماهنگیهای دورهای یونی بهجای نکروز فوری. از منظر ترجمهای، چالش کنونی اثبات وقوع این رویدادها در نورونهای یکپارچه و طراحی مولکولهایی است که یا ازAssembly روزنه جلوگیری کنند یا درزهای گذرا را سریعاً ترمیم کنند. هدفگیری همزمان یکپارچگی غشای میتوکندری میتواند ارزشمند باشد، با توجه به تمایل اولیگومرها به انحنای غشا."
تکنولوژیهای مرتبط و چشماندازهای آینده
چند فناوری مکمل میتواند ترجمه این یافتهها به درمان یا تشخیص را تسریع کند:
- تصویربرداری زنده پیشرفته برای ضبط رویدادهای گذرای روزنه در نورونها
- بایوسنسورهای جریان یونی و پتانسیل غشای میتوکندری
- اسکرینهای با ظرفیت بالا برای مولکولهای کوچک که تشکیل روزنه را مسدود میکنند
- بهینهسازی پلتفرمهای نانوبادی برای خنثیسازی اولیگومرها پیش از درگیری با غشا
در مجموع، این رویکردها میتوانند مداخلات مرحلهاولیهای را فراهم کنند که با جلوگیری از آسیبهای زیرکشنده مکرر به غشا، پیشرفت بیماری را کند سازند.
جمعبندی
مطالعه دانشگاه آرهوس فهم ما از بیماری پارکینسون را پیش میبرد و نشان میدهد که اولیگومرهای آلفا‑سینوکلئین میتوانند از طریق توالی اتصال–وارد شدن–تشکیل روزنه، روزنههای پویایی در غشاهای مدل ایجاد کنند. این نقضهای گذرا که تمایل به غشاهای منحنی مانند سطح میتوکندری دارند، میتوانند اختلالات یونی دورهای ایجاد کنند که بهتدریج به اختلال عملکرد نورونی میانجامد. در حالی که تأیید بیشتر در سیستمهای زنده لازم است، نتایج اهداف مکانیکی جدیدی را برجسته میکنند — از خنثیسازی اولیگومرها تا حفاظت از غشا — که ممکن است راهنمای توسعه درمانها و ابزارهای تشخیصی آینده باشند. این پژوهش که در ACS Nano منتشر شده است، دریچه جدیدی برای بررسی چگونگی مشارکت تجمعات پروتئینی کوچک در نوروژنراسیون و چگونگی ممانعت از این فرایند پیش از از دست رفتن غیرقابل بازگشت عملکرد باز میکند.
منبع: sciencealert

نظرات