6 دقیقه
پژوهشگران اسپانیایی گروه کوچکی از نورونهای آمیگدالا را شناسایی کردهاند که میتوانند رفتارهای شبیه اضطراب را در موشها ایجاد کنند — و با بازتعادل همان گروه نورونی این رفتارها قابل بازگشت هستند. با هدفگیری ژن GRIK4 و محصول پروتئینی آن GluK4، تیم تحقیقاتی رفتارهای اجتماعی طبیعی را بازگرداند و نشانههای افسردگی را در نمونههایی از موشها که بهصورت تجربی مستعد اضطراب پرورش یافته بودند کاهش داد، که راهی دقیق و هدفمند برای توسعه درمانهای آینده باز میگشاید. این یافتهها در زمینههای درمانهای هدفمند اعصاب، و مطالعات مرتبط با آمیگدالا، اضطراب و ویرایش ژن اهمیت بالایی دارد.
چگونه چند سلول تعادل هیجانی را تغییر میدهند
این مطالعه که تحت هدایت شورای ملی تحقیقات اسپانیا و دانشگاه میگل هرناندز الچه (CSIC-UMH) انجام شد و در نشریه iScience در سال 2025 منتشر گردید، بر بخش بازجانبی آمیگدالا (BLA) تمرکز داشت — یک هاب عصبی کلیدی برای پردازش ترس، تصمیمگیری و حافظه هیجانی. بهجای بررسی تغییرات گسترده در کل مغز، محققان فعالیت یک جمعیت نورونی خاص در درون BLA را ردیابی کردند و دریافتند که عدم تعادل در همین جمعیت بهتنهایی کافی است تا اضطراب پاتولوژیک و اختلالات اجتماعی را ایجاد کند. این رویکرد که از دیدگاه مدارهای عصبی (neural circuits) و زیستشناسی مولکولی قابل توجه است، نشان میدهد که تغییرات موضعی در مدارهای کوچک میتواند تأثیرات گستردهای روی رفتار و پردازش شناختی داشته باشد.
هنگامی که ژن GRIK4 بیش از حد بیان شد، میزان تولید پروتئین GluK4 بالا رفت. موشهایی که سطح GluK4 در آنها افزایش یافته بود، از مناطق باز اجتناب میکردند، از تعاملات اجتماعی کنارهگیری نشان میدادند و صفات شبیه افسردگی بروز میدادند. علاوه بر این، این موشها در وظایف شناسایی اشیاء دچار مشکل شدند که نشان میدهد اثرات این اختلال محدود به BLA نیست و ممکن است مدارهای متصل دیگری را نیز درگیر کند. شواهد رفتاری و الکتروفیزیولوژیک نشان میدهد که تغییرات در بیان GRIK4 میتواند بر خواص سیناپسی و پاسخپذیری مدارهای محلی و دوردست تأثیر بگذارد.
ویرایش ژن چگونه مغزهای مضطرب موش را آرام کرد
برای اصلاح این الگوهای رفتاری، تیم از ابزارهای ویرایش ژن هدفمند برای حذف نسخههای اضافی GRIK4 در BLA استفاده کرد و سطح GluK4 را کاهش داد. نتیجه چشمگیر بود: رفتارهای شبیه اضطراب و کمبودهای اجتماعی ناپدید شدند و موشهای درمانشده به الگوهای کاوش و تعامل طبیعیتری بازگشتند. بنا بر گزارش یکی از نوروساینتیستها، آلواِرو گارسیا، «همین تعدیل ساده کافی بود تا رفتارهای مرتبط با اضطراب و نقصهای اجتماعی را معکوس کند؛ موضوعی که شگفتآور است.» این مشاهده حاکی از آن است که تنظیم دقیق یک مولفه مولکولی در یک ناحیه مشخص از مغز میتواند اثرات رفتاری قابل توجهی ایجاد کند.
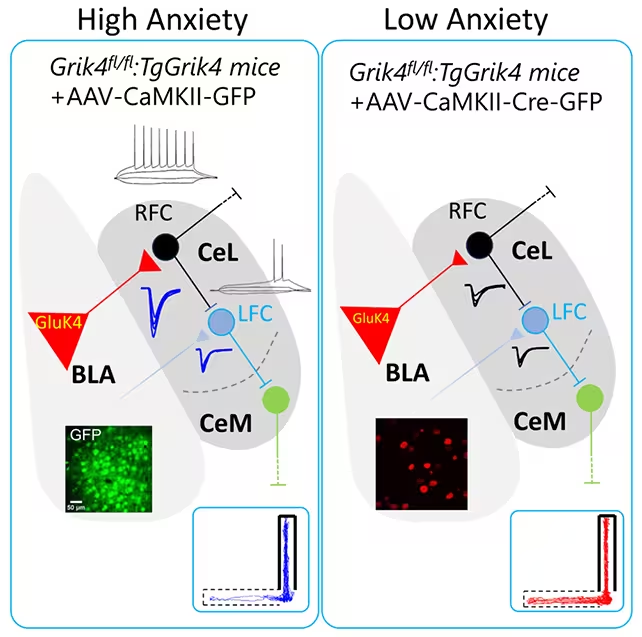
نکته مهم این است که همان مداخله در موشهایی که بهطور ژنتیکی مهندسی نشده بودند ولی بهطور طبیعی سطوح بالاتری از اضطراب داشتند نیز مؤثر بود، که نشان میدهد این رویکرد فراتر از مدلهای مهندسیشده ژنتیکی کارآمد است و میتواند در نمونههای پیشبالینی متنوعتری به کار رود. با این حال، موشهای درمانشده همچنان مشکلاتی در شناسایی اشیاء نشان دادند؛ این امر نشان میدهد که برخی از تأثیرات شناختی مرتبط با اضطراب شامل نواحی مغزی دیگری نیز میشود که تحت پوشش مداخله فعلی قرار نگرفتهاند. این اختلاف میان علائم رفتاری و شناختی اهمیت مطالعه اتصالات مدارها (circuit mapping) و مسیرهای سیناپسی وابسته به GluK4 را برجسته میکند.
چرا این یافته مهم است — و چه پرسشهایی هنوز بیپاسخ ماندهاند
شناسایی یک جمعیت نورونی مشخص که فعالیت آن بهتنهایی قادر است اضطراب پاتولوژیک ایجاد کند، دیدگاه مدیرانهای را نسبت به درمان اختلالات عاطفی (affective disorders) بازتعریف میکند. هدفگیری مدارهای مشخص این امکان را میدهد که درمانهایی موضعی با عوارض جانبی کمتر نسبت به داروهای گستردهالعمل که کل مغز را تحت تأثیر قرار میدهند، توسعه یابند. از منظر زیستپزشکی و طراحی درمان، این نوع اهداف مولکولی و مدارمحور میتواند به داروها یا استراتژیهایی منجر شود که دقیقاً گیرندههای حاوی GluK4 یا مسیرهای تنظیمکننده بیان GRIK4 را نشانهگیری کنند.
با این وجود انتقال این نتایج به انسان همچنان در مرحله فرضیهپردازی است. موشها مدلهای پیشبالینی ارزشمندی برای مطالعه مکانیسمهای پایهای هستند، اما مغز انسان پیچیدهتر است و پیکربندی مدارها و تعاملات بینناحیهای در انسان میتواند متفاوت باشد. همانطور که خوان مرما، یکی از نویسندگان مقاله اشاره کرد: «ما از قبل میدانستیم که آمیگدالا در اضطراب و ترس نقش دارد، اما اکنون جمعیت نورونی مشخصی را شناسایی کردهایم که عدم تعادل فعالیت آن بهتنهایی کافی است تا رفتارهای پاتولوژیک را بهوجود آورد.» پژوهشگر دیگری به نام لِرما نیز خاطرنشان کرد که هدفگیری این مدارها میتواند بهعنوان «استراتژیای مؤثر و محلیتر برای درمان اختلالات عاطفی» مطرح شود. با این همه، نیاز به مطالعات تطبیقی، دادههای انسانشناختی و ایمنیشناسی، و شواهد عملکردی در نمونههای بزرگتر حیوانی وجود دارد تا مسیر ترجمه به بالین هموار شود.
جهتگیریهای آینده و چشماندازهای درمانی
گامهای بعدی شامل ترسیم چگونگی تغییر مدارهای متصل به BLA در اثر ناهمخوانی GluK4 و آزمون روشهای تحویلی است که بتوانند بهطور ایمن GRIK4 را در حیوانات بزرگتر یا مدلهای نزدیکتر به انسان تنظیم کنند. تکنیکهایی مشابه با آنچه در این مطالعه بهکار رفته — یعنی تنظیم دقیق ژن در نواحی هدفمند مغزی — ممکن است در آینده برای انسان تطبیق یابد، خواه از طریق درمانهای ژنی (gene therapy)، ناقلهای ویروسی اصلاحشده، یا داروشناسی بسیار انتخابی که روی گیرندههای دارای GluK4 متمرکز است. همچنین از منظر توسعه دارو، فهم ساختار و عملکرد گیرندههای کاینات درسطح مولکولی میتواند منجر به ابداع مولکولهای کوچک یا آنتاگونیستهای اختصاصی شود که اثرات مطلوب را بدون نفوذ گسترده به سایر زیرنوعهای گیرندهها فراهم کنند.
در حال حاضر، این کار تصویر مکانیکی روشنتری ارائه میدهد: عدم تعادلهای نورونی کوچک در آمیگدالا میتواند اثری بزرگ در وضعیت هیجانی ایجاد کند، و اصلاح این عدم تعادلها میتواند بسیاری — اما نه همه — علائم را بازگرداند. این تمایز بین بازگردانی رفتارهای اجتماعی و تداوم برخی نقصهای شناختی راهنمایی خواهد بود برای تحقیقات پایهای بیشتر و طراحی درمانهای نسل بعدی برای اختلالات اضطرابی. بهعلاوه، نتایج بر لزوم تلفیق مطالعات مولکولی، مدارهای عصبی، رفتاری و روشهای تحویل ایمن تأکید میکند تا راهکارهای بالینی واقعی و مؤثر توسعه یابند.
منبع: sciencealert
نظرات
آسمانچرخ
خوبه ولی یه خورده اغراق داره. بازگشت رفتار اجتماعی قابل توجهه، اما نقایص شناختی نشون میده هنوز نصف و نیمهاس
رضا
من تو آزمایشگاه مشابهی کار کردم، تغییرات موضعی گاهی معجزه میکنه اما مراقب اثرات جانبی باشین، هنوز سوالا زیاده
بیوانیکس
این واقعاً به انسان قابل تعمیمه؟ مدلِ موش خوبه اما مدارهای انسانی پیچیدهان، شواهد بیشتری لازمه
دیتاویو
وای… چقدر عجیب و امیدوارکننده! یعنی چند تا نورون میتونن اینقدر زندگی رو عوض کنن؟! شگفتزدم، ولی ببینیم تو انسان جواب میده یا نه 😉

ارسال نظر