8 دقیقه
پژوهشگران روشی در مهندسی سلولی توسعه دادهاند که مقدار وکتور ویروسی مورد نیاز برای تولید سلولهای القاشده کشنده طبیعی مجهز به گیرنده حساسشده با آنتیژن (CAR‑iNK) را بهطرز چشمگیری کاهش میدهد. این پیشرفت نوید کاهش هزینهها و افزایش مقیاسپذیری ایمنیدرمانیهای مبتنی بر CAR را میدهد در حالی که فعالیت ضدتوموری قوی را در مدلهای پیشبالینی حفظ میکند.
چگونه تکنیک جدید نیاز به وکتور ویروسی را کاهش میدهد
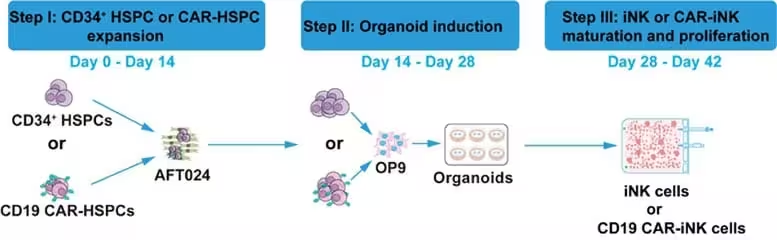
در مهندسی سنتی CAR روی سلولهای NK بالغ، معمولاً مقدار قابلتوجهی وکتور ویروسی برای وارد کردن ژن گیرنده لازم است. رویکرد جدید که در مرحله القای سلولهای iNK اعمال میشود، میزان استفاده از وکتور را نسبت به پروتکلهای استاندارد بهطور غیرقابلباوری کاهش میدهد — بهطور تقریبی تا حدود نسبت 1:140,000 در هفته ششم و حتی تا حدود 1:600,000 در هفته هفتم کشت. به بیان سادهتر، پژوهشگران توانستند سطح بیان CAR مشابه را تنها با بخش کوچکی از ماده وکتوری که بهطور معمول لازم است، بهدست آورند.
این کاهش شدید در مصرف وکتور ویروسی نه تنها بار مالی تولید را کم میکند، بلکه پیچیدگیهای فنی و محدودیتهای مربوط به تهیه مقادیر بالای وکتور، شامل نیازهای زیرساختی و مسائل ایمنی زیستی (biosafety) را نیز کاهش میدهد. بهعنوان یک نکته فنی، انجام انتقال ژن در مرحله القا (induction) که سلولها وضعیت تکاملی متفاوتی دارند، ممکن است پنجرهای مناسب برای ورود پایدار ژنتیکی فراهم آورد بدون نیاز به تیراژ بالای وکتور یا واکنشهای نامطلوب سلولی.
از منظر تولید و فرآیندهای صنعتی، چنین کاهش در نسبت وکتور به سلول (vector-to-cell ratio) میتواند هزینههای تولید درمانهای سلولی مبتنی بر CAR را بهصورت نمایی پایین آورد و مسیر تجاریسازی و برنامههای کارآزمایی بالینی را سریعتر و کمریسکتر کند. همچنین این تغییر میتواند به دسترسی بهتر به درمانهای سلولی برای مراکز با منابع محدودتر منجر شود.
آزمونهای عملکردی: کنترل تومور در مدلهای لوکمیا
کاهش مصرف وکتور در صورتی ارزشی نداشت که کارآیی درمانی حفظ نمیشد. در آزمونهای متعدد پیشبالینی، هم سلولهای iNK بدون تغییر و هم سلولهای CAR‑iNK نشاندهنده کشندگی قوی علیه سلولهای سرطانی بودند. در مدلهای موشی—شامل گزنگاشتهای مشتق از خطوط سلولی (CDX) و گزنگاشتهای مشتق از بیماران (PDX) از لوسمی حاد لنفوبلاستیک سلول B انسانی (B‑ALL)—سلولهای CAR‑iNK هدفگرفته به CD19 رشد تومور را کند کرده و طول عمر جانوری را نسبت به گروههای کنترل افزایش دادند.
این نتایج نشان میدهد که بیان CAR القا شده در مراحل اولیه تمایز iNK، به میزان کافی برای تسهیل شناسایی و نابودی سلولهای هدف عمل میکند. در بسیاری از آزمایشها، معیارهایی مانند میزان آپوپتوز سلول توموری، سیتوتوکسیسیته وابسته به زمان و دوز، و همچنین بقا و اندازه توده توموری در ارزیابیهای کمی و کیفی بررسی شدند. نتایج نشان دادند که CAR‑iNKها توانایی کنترل تومور را در شرایط in vivo دارند که این یافته برای ترجمه بالینی امیدبخش است.
علاوه بر اثبات اثربخشی، پژوهشها به بررسی ایمنی و اثرات جانبی بالقوه نیز پرداختهاند؛ از جمله سنجش پاسخ ایمنی میزبان، خطرات ترانسژنها و رفتار توزیع سلولی. در مدلهای آزمایشگاهی اولیه، نشانههای قابلتوجهی از سمیت سیستمیک یا ایجاد عوارض وابسته به سایت هدف گزارش نشد، اگرچه مطالعات جامعتر در مدلهای بزرگتر و فازهای انسانی برای تایید این نتایج لازم است.
چرا این پیشرفت برای توسعه درمانهای سلولی مهم است
وکتورهای ویروسی یکی از گرانترین عناصر تولید سلولهای CAR هستند. کاهش نیاز به وکتور بهمیزان چند مرتبه باعث دو مزیت فوری میشود: کاهش هزینه تولید و کاهش بار ایمنی زیستی در هنگام افزایش مقیاس. این ترکیب میتواند کار ترجمه از آزمایشگاه به کلینیک را تسریع کند و دسترسی به نسل بعدی درمانهای مبتنی بر سلول NK را برای کارآزماییهای بالینی افزایش دهد.
در سطح فنی و تولیدی، کاهش تیتراسیون وکتور میتواند نیاز به امکانات تولید تحت سطح ایمنی بالا (GMP) را کمینه کند یا حداقل هزینه و زمان لازم برای تولید را کاهش دهد. همچنین با کاهش مقدار وکتور ویروسی، نگرانیهای مربوط به تولید انبوه، انبارداری و حملونقل وکتورها کاهش یافته و الزامات نظارتی مرتبط سادهتر میشود. این عاملها مخصوصاً برای شرکتها و مؤسسات تحقیقاتی که به دنبال توسعه محصولات off‑the‑shelf (آماده مصرف) مبتنی بر NK هستند، حیاتی است.
از منظر بالینی، استفاده از سلولهای NK دارای چند مزیت نسبت به برخی پلتفرمهای دیگر مانند CAR‑T است: احتمال کمتر ایجاد سندرم ریزپروتئینی التهابی (CRS)، عملکرد ضدتوموری ذاتی NK در کنار CAR و امکان تولید سلولهای allogeneic یا آماده مصرف. بهینهسازی فرایند ترانسداکشن در مرحله القا iNK میتواند این مزایا را با هزینه کمتر و ریسک فنی پایینتر ترکیب کند.
پیامدها و گامهای بعدی
اگرچه نتایج کنونی پیشبالینی هستند، مسیر روشنی را به سوی مهندسی CAR کارآمدتر که توان درمانی را حفظ میکند، نشان میدهند. کارهای آینده باید پایداری بیان CAR در طول زمان، ایمنی طولانیمدت و عملکرد در مدلهای حیوانی بزرگتر و در نهایت در کارآزماییهای فاز انسانی اولیه را تأیید کنند. در صورت موفقیت این مطالعات، ممکن است بهزودی پلتفرم سلولی NK آماده و مقرونبهصرفهای برای هدفگیری CD19 و سایر آنتیژنهای توموری در دسترس کلینیسینها قرار گیرد.
گامهای قابلانتظار بعدی عبارتاند از:
- گسترش آزمایشها در مدلهای حیوانی بزرگتر و بررسی طولانیمدت پایداری و ایمنی.
- بهینهسازی فرآیند تولید تحت شرایط GMP و تحلیل هزینه-فایده برای تولید انبوه.
- مطالعات مقایسهای با سایر پلتفرمهای ایمنیدرمانی از جمله CAR‑T و NK سلولهای بالغ.
- بررسی طیف وسیعتری از آنتیژنهای هدف و ترکیب با سایر روشهای درمانی مانند ایمونومدولاتورها یا داروهای هدفمند.
نکته مهم این است که هرچند کاهش مصرف وکتور میتواند هزینهها را پایین بیاورد، اما استانداردهای کیفیت، کنترل و نظارت بالینی باید بدون کاهش حفظ شوند. تضمین یکپارچگی ژنتیکی، کنترل مدلهای آلودگی و سنجش عملکرد سلولی در هر دسته تولیدی باید جزو فرایندهای اجباری باشد.
ملاحظات فنی و تحقیقاتی برای محققان و تولیدکنندگان
برای تیمهای تحقیقاتی و شرکتهای تولیدکننده، چندین جنبه فنی قابلتوجه است که باید در مسیر توسعه و تجاریسازی در نظر گرفته شوند:
- پنجره زمانی انتقال ژن: شناسایی زمان ایدهآل در طول القای iNK که بیشترین بازده ترانسداکشن را با حداقل دوز وکتور فراهم کند.
- نوع وکتور و ایمنی ژنتیکی: انتخاب وکتور با کارایی بالا و پروفایل ایمنی مناسب (مثلاً لنتیویروسها یا وکتورهای غیرویرال در صورت امکان) و تضمین عدم فعالسازی عناصر ناخواسته ژنتیکی.
- کنترل کیفیت و نشانگرهای عملکرد: تعیین شاخصهای بیولوژیک (biomarkers) و آزمایشهای عملکردی که تضمین میکنند CAR‑iNKها کارآیی لازم را در شرایط بالینی دارند.
- مقیاسپذیری تولید: طراحی راکتورهای سلولی، شرایط کشت و فرایندهای تغذیه که بتوانند از سطح آزمایشگاهی تا تولید صنعتی گسترش یابند.
علاوه بر این، همکاری نزدیک با ناظران نظارتی و مراکز بالینی برای طراحی مطالعات ایمنیمحوری و کارآزماییهای بالینی مرحلهای ضروری است. مستندسازی کامل فرآیند تولید، معیارهای پذیرش محصول و دادههای ایمنی و اثربخشی باید از ابتدا در طرح مطالعات لحاظ شود تا انتقال به فازهای بالاتر با حداقل مانع انجام گیرد.
جمعبندی و چشمانداز آینده
کاهش چشمگیر نیاز به وکتور ویروسی در تولید CAR‑iNKها میتواند نقطه عطفی در توسعه ایمنیدرمانیهای سلولی باشد. این پیشرفت نهتنها بار مالی تولید را کاهش میدهد، بلکه میتواند زمان و پیچیدگیهای توسعه بالینی را کاهش دهد و دسترسی به درمانهای نوین علیه سرطان را افزایش دهد. با ادامه تحقیقات پیشبالینی و گذار موفق به مطالعات بالینی، پتانسیل تبدیل این روش به یک پلتفرم مقرونبهصرفه و آماده مصرف برای هدفگیری آنتیژنهایی مانند CD19 و فراتر از آن وجود دارد.
در نهایت، ترکیب نوآوریهای بیولوژیک با بهینهسازی فرایندهای تولید و رعایت استانداردهای ایمنی زیستی میتواند به ظهور نسل جدیدی از درمانهای سلولی منجر شود که مقرونبهصرفهتر، مقیاسپذیرتر و برای بیماران دسترسپذیرتر باشند.
منبع: scitechdaily
نظرات
مهران
خوبه ولی یه جور بزرگنمایی تو متن حس میشه، دادههای پیشبالینی امیدوارکنندهان اما ترجمه به فاز انسانی همیشه چالشیه
لابکور
به نظر جهشی مهمه در فرایند تولید؛ کاهش تیتراسیون وکتور میتونه موانع GMP و هزینهها رو کم کنه. اما پایداری بیان و اثرات ژنتیکی بلندمدت باید حتما بررسی بشن
توربوپارت
این واقعیه یا یکم اغراقه؟ تو موش خوب کار کرده باشه، ولی تو انسان توزیع و ایمنی چطور تضمین میشه… سوالای زیاد دارم
کوینپال
منطق داره، هزینه بیاد پایین دسترسی بهتر میشه، اگه عملکرد بمونه، بازار باز میشه. ساده و قاطع
دیتاپالس
وای… نسبت 1:140000 ؟ یعنی تولید CAR iNK حسابی ارزون میشه، ولی کاش زودتر بفهمیم تو انسان هم ایمن و پایدار میمونه. هیجانانگیزه، ولی محتاطم

ارسال نظر