10 دقیقه
یک روش نوین ایمنیدرمانی ترکیبی سلولی به طور کامل از بروز و پیشرفت دیابت نوع ۱ در موشها جلوگیری کرده و حتی بیماری را معکوس کرده است، بدون نیاز به سرکوب طولانیمدت ایمنی، بر اساس گزارش محققان دانشکده پزشکی استنفورد. با ایجاد یک سیستم ایمنی ترکیبی شامل سلولهایی از اهداکننده و گیرنده، تیم پژوهشی توانست جزایر تولیدکننده انسولین (ایزولِتها) را بازسازی کند و حمله خودایمنی که موجب از بین رفتن سلولهای بتا و نقص تولید انسولین میشود را متوقف سازد. این دستاورد نشاندهنده پیشرفت مهمی در حوزه پیوند ایزولِت، ایمنیدرمانی سلولی و درمان دیابت خودایمن است و میتواند مسیر ترجمه بالینی برای بیماران مبتلا به دیابت نوع ۱ را تغییر دهد.
چرا این رویکرد اهمیت دارد: بازنشانی سیستم ایمنی و جایگزینی ایزولِتها
دیابت نوع ۱ یک اختلال خودایمنی است که در آن سیستم ایمنی بدن، سلولهای بتای پانکراس که مسئول تولید انسولین هستند را به عنوان مهاجم شناسایی و نابود میکند. با از بین رفتن این سلولها، تولید انسولین سقوط میکند و هموستازی قندی دچار اختلال میشود. روشهای رایج پیوند ایزولِت میتوانند تولید انسولین را بازگردانند اما سلولهای پیوندی در برابر همان حملهٔ خودایمنی آسیبپذیر باقی میمانند و معمولاً بیماران برای جلوگیری از پسزدن نیازمند داروهای سرکوبکنندهٔ ایمنی مادامالعمر هستند. این داروها عوارض سیستمیک قابل توجهی دارند و ریسک عفونت و سایر پیامدهای نامطلوب را افزایش میدهند.
تیم استنفورد رویکرد متفاوتی را انتخاب کرد: به جای تنها جایگزینی ایزولِتها، گیرندگان را طوری آماده کردند که سیستم ایمنیشان قادر به پذیرش سلولهای اهداکننده شود و در تعادل با آنها عمل کند. استراتژی ترکیبی آنها، سلولهای بنیادی خونساز (hematopoietic stem cells) را همراه با ایزولِتهای اهداکننده و یک رژیم «شرایطبخشی» ملایم میآمیزد تا سیستم ایمنی میزبان به شکلی ظریف و برگشتپذیر بازتنظیم شود. نتیجه یک سیستم ایمنی کیمریک یا هیبریدی است که شامل سلولهای ایمنی هر دو طرف — گیرنده و اهداکننده — میشود و به ایزولِتهای پیوندی بدون نیاز به سرکوب مداوم ایمنی تحمل نشان میدهد. این مفهومِ القای تحمل ایمنی اختصاصی بر ضد آنتیژنهای جزایر پانکراسی، هم جنبههای درمانی و هم ایمنیزیستی مهمی دارد.
چگونه آزمایش انجام شد: شرطیسازی، پیوند و القای تحمل
در این مطالعه، موشهای پیشدیابتی و دیابتی یک دورهٔ کوتاه شرطیسازی دریافت کردند: یک دورهٔ کوتاه از مهارکنندههای انتخابی سیستم ایمنی، دوز پایین تابش، و آنتیبادیهای هدفمند که به هدف کاهش جمعیتهای ایمنی مشخص ولی بدون پاکسازی کامل سیستم طراحی شده بودند. در کنار این رژیم ملایم، سلولهای بنیادی خونساز اهداکننده تزریق شدند و ایزولِتهای سالم اهداشده نیز به صورت همزمان پیوند شدند. هدف از این ترکیب، فراهم کردن فضای میکرونیچای و ایمنی برای لنگر انداختن سلولهای بنیادی اهداکننده و تولید نسل جدیدی از سلولهای ایمنی مشتق از اهداکننده بود که بتوانند در کنار سلولهای ایمنی میزبان همزیستی کنند.
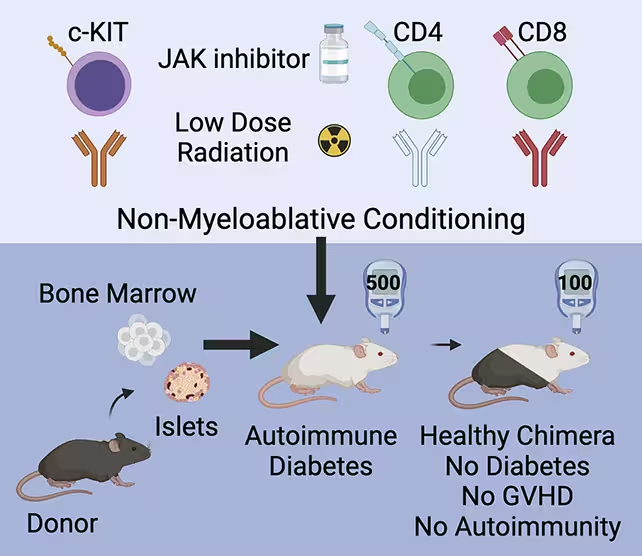
حیوانات تحت درمان شرطیسازی قرار گرفتند تا سیستم ایمنی آنها برای پیوند سلولی آماده شود.
آن شرطیسازی ملایم اجازه داد سلولهای بنیادی اهداکننده مستقر شوند (engraftment) و جمعیتی از سلولهای ایمنی مشتق از اهداکننده تولید کنند که در کنار سلولهای ایمنی میزبان وجود داشتند. در چنین وضعیت کیمریک، بهجای رخ دادن عارضهٔ شناختهشده گرافت-ورسو-هوست (GvHD) — که وقتی سلولهای فردی به سلولهای فرد دیگر حمله میکنند اتفاق میافتد — حیوانات هیبریدی تعادل ایمنی را حفظ کردند. ایزولِتهای پیوندی محافظت شدند و عملکرد سلولهای بتا بازگشت، به طوری که قند خون در موشهای مبتلا به دیابت تثبیت شد و در حیوانات پیشدیابتی از بروز بیماری جلوگیری گردید. این نشان میدهد که القای تحمل اختصاصی نسبت به بافت پیوندی ممکن است بدون سرکوب سیستمیک طولانیمدت قابل دستیابی باشد.
نتایج کلیدی و پیامدهای علمی
نتایج بسیار قابل توجه است: این درمان از بروز دیابت در موشهای پرخطر جلوگیری کرد و در مواردی بیماری کامل را معکوس نمود. نکتهٔ مهم این است که هیچیک از حیوانات تحت درمان در دورهٔ پیگیری دچار گرافت-ورسو-هوست نشدند و عملکرد ایمنی به حالت عادی برگشت مگر اینکه دربارهٔ ایزولِتهای اهداکننده تحمل اختصاصی ایجاد شده بود. بخشی کوچک از سلولهای ایزولِت نشانههایی از التهاب خفیف نشان دادند اما تخریب کامل رخ نداد — نشانهٔ امیدوارکنندهای است که مکانیسمهای تحمل ایمنی وابسته به شناسایی آنتیژنی فعال شدهاند، نه یک سرکوب عمومی و گستردهٔ ایمنی.
نویسندهٔ ارشد، یونگ-سونگ کیم (Seung Kim) از استنفورد، این رویکرد را تحولآفرین توصیف کرد و پیشنهاد داد استراتژیهای مشابه هیبرید ممکن است به بیماریهای خودایمنی دیگر و پیوند اندامهای جامد نیز تسری یابند. ایدهٔ ترکیب سلولهای ایمنی اهداکننده و گیرنده برای القای تحمل جدید نیست — مطالعات پیشین پیوند، از جمله کارهای پیشین همین گروه، نشان دادهاند که این اصل در عمل امکانپذیر است — اما بهکارگیری آن برای دیابت نوع ۱ و تلفیق با جایگزینی ایزولِت، گام مهمی به جلو است که میتواند بحثهای مربوط به درمان سلولی و ایمونوتراپی را توسعه دهد. از نظر علمی، این کار نشان میدهد که با تنظیم دقیقی از شرطیسازی و نوع سلولهای تزریقی میتوان چارچوب ایمنی را طوری تغییر داد که همگانِ ایمنی نسبت به بافت پیوندی تحمل نشان دهند، بدون اینکه مصداقی از نقص ایمنی عمومی دائمی ایجاد شود.
چالشهای پیشرو: تأمین، مقیاسپذیری و ترجمه به انسان
با وجود نتایج امیدوارکننده، موانع قابل توجهی باقی است تا این روش به بیماران انسانی برسد. ایزولِتهای انسانی اهدایی نادر هستند و معمولاً تنها پس از مرگ قابل دسترسیاند؛ پروتکلهای بالینی نیاز به هماهنگی سلولهای بنیادی خونساز همراه با ایزولِتها دارند تا استراتژی هیبریدی دقیقاً همان چیزی شود که در مدل حیوانی عملکرد داشت. محققان در حال بررسی راههایی برای افزایش بقا و عملکرد سلولهای اهدایی هستند و بهشدت دنبال پژوهش روی تولید ایزولِتهای انسانی از سلولهای بنیادی پرتوان القایی (iPSC) یا استم سلهای جنینی برای ایجاد منبع پایدار و کنترلشدهاند. تولید ایزولِت از سلولهای پرتوان، اگر با کیفیت بالای عملکردی و ایمنی همراه شود، میتواند مشکل کمبود بافت را کاهش دهد و امکان استانداردسازی محصول را فراهم سازد.
سؤالات باز دیگری هم وجود دارد: تعداد بهینهٔ سلولهای بنیادی و ایزولِتهای اهداکننده لازم چقدر است؟ رژیم دقیق شرطیسازی که اثربخشی را با ایمنی متعادل نگه دارد چیست؟ دوام طولانیمدت تحمل ایمنی تا چه اندازه حفظ خواهد شد و آیا نیاز به تقویت مجدد دارد؟ تیم تحقیق اشاره میکند که مراحل کلینیکی بنیادین برای ایجاد سیستمهای ایمنی هیبرید، هماکنون در سایر زمینههای پزشکی به کار میروند (مانند پیوند مغز استخوان و برخی پروتکلهای ایمنیدرمانی)، که میتواند طراحی کارآزماییهای انسانی برای دیابت نوع ۱ را تسریع کند اما تطبیق دقیق به شرایط این بیماری خودایمنی و ملاحظات بیولوژیک آن نیازمند کار تحقیقاتی بیشتری است.
دیدگاه کارشناسان
«استراتژی دوگانهٔ جایگزینی سلولهای بتا از دست رفته همراه با بازآموزی سیستم ایمنی هر دو سوی مسئله را هدف قرار میدهد،» میگوید دکتر لورا چن، ایمنیشناس و پژوهشگر پیوند که با این مطالعه مرتبط نیست. «اگر حالت ایمنی هیبریدی در انسانها پایدار ثابت شود، میتواند نیاز به سرکوب ایمنی مزمن را کاهش یا حذف کند — که یک مزیت بالینی بزرگ خواهد بود.»
نویسندگان مقاله محتاط اما خوشبین هستند. آنها تأکید میکنند که در حالی که نتایج هنوز بهطور مستقیم به انسان ترجمه نشدهاند، مفهوم مکانیکی — ایجاد کیمریسم کنترلشده برای القای تحمل آنتیژن-اختصاصی — در عمل بالینی برای شرایط دیگر کاربرد دارد. با بهینهسازیهای بیشتر و تولید سلولی در مقیاس بزرگ، این رویکرد هیبریدی ممکن است شیوهٔ نگرش ما به بیماریهای خودایمنی و درمانهای مبتنی بر سلول را دگرگون کند. در عین حال لازم است مطالعات سمشناسی، پاسخهای ایمنی غیرمنتظره، و پایداری طولانیمدت درمان در مدلهای حیوانی و سپس در کارآزماییهای بالینی به دقت بررسی شود.
برای اکنون، این پژوهش نشاندهندهٔ پیشرفت معناداری است: یک نمایش آزمایشگاهی که نشان میدهد اتوایمیونیتی و جایگزینی سلولی میتوانند بهطور همزمان و هماهنگ مورد توجه قرار گیرند. مسیر رسیدن به آزمایشهای بالینی انسانی نیاز به حل معماهای لجستیکی و زیستی دارد اما چشمانداز یک استراتژی بالقوه درمانی یا حتی درمانکننده برای دیابت نوع ۱ بهطرزی قابل توجه نزدیکتر شده است. این پیشرفت میتواند مبنایی برای توسعه پروتکلهای جدید پیوند ایزولِت، ایمنیدرمانی ترکیبی، و تولید ایزولِتهای مشتق از سلولهای بنیادی فراهم کند؛ حوزههایی که به دلیل بار بالای بیماری و نیاز به راهحلهای پایدار، از اهمیت بالایی برخوردارند.
در نهایت، موانع تولید و تطبیق بالینی، از جمله تامین بافت، مقیاسبندی تولید سلولی، مانیتورینگ طولانیمدت تحمل ایمنی و تعیین پارامترهای دقیق شرطیسازی، همگی باید به دقت حل شوند. اما دیدگاه کلان این است که ترکیب سلولهای بنیادی خونساز برای القای میکروجریان ایمنی کیمریک به همراه پیوند ایزولِت میتواند راهی عملی و مؤثر برای بازگرداندن عملکرد انسولینی و مهار پاسخهای خودایمنی فراهم آورد. این رویکرد نهتنها برای دیابت نوع ۱ بلکه برای سایر بیماریهای خودایمنی و پیوند اندامهای جامد نیز چشماندازهای جدیدی باز میکند.
در جمعبندی، مطالعهٔ استنفورد یک گام آزمایشی اما مهم به سوی درمانهای مبتنی بر ترکیب جایگزینی بافت و تنظیم ایمنی برای دیابت نوع ۱ است. با کار فنی دقیق روی تولید سلولی، آزمونهای بالینی محتاطانه و طراحی روشهای مراقبتی مناسب، میتوان امیدوار بود که در آیندهای نهچندان دور شاهد آزمایشهای بالینی اولیه و ارزیابی اثربخشی این رویکرد در انسان باشیم. تا آن زمان، نتایج کنونی انگیزهٔ قوی برای ادامهٔ تحقیقات در زمینهٔ ایمونوتراپی ترکیبی، القای تحمل اختصاصی و تولید ایزولِتهای قابل استفاده در درمان دیابت نوع ۱ فراهم میآورد.
منبع: sciencealert
نظرات
آرمین
حس میکنم کمی اغراق شده، موشها همیشه نشون نمیدن چی قراره تو انسان بشه. هنوز سوالای کلیدی مونده: میزان، زمانبندی، و عوارض بلندمدت.
شهرلاین
دیدگاه علمی قوی و نوآورانه، مسیر بالینی طولانیه اما ایده ترکیب سلولدرمانی و بازتنظیم ایمنی چشمگیرِ. امیدوارم استاندارد بشه
بیوانیکس
من خودم تو پروژههای پیوند تجربه دارم، این کیمریسم کنترلشده هیجانزاست، ولی تو انسان باید سمشناسی و دوام رو نشون بدن، کلی تست لازمه
توربومک
معقول بنظر میاد، بازآموزی سیستم ایمنی همراه با پیوند به جاست. تولید ایزولِت پایدار و امن لازمه، وگرنه فایده کم میشه...
کوینتون
این موفقیت تو موش به چه معناست برا آدم؟ 🤔 کلی موانع لجستیکی و ایمنی هست، به خصوص تامین ایزولِت و iPSC — واقعا امیدوارم قابل حل باشه.
دیتاپالس
وااای، انتظار نداشتم! اینکه با یک دوره شرطیسازی ملایم بتونن دیابت رو معکوس کنن خیلی بزرگه، اما ترجمه به انسان هنوز پر از سواله...

ارسال نظر