9 دقیقه
سرطان لوزالمعده منتظر نمیماند. این بیماری سالها پیش از شکلگیری تومور قابلتشخیص، متحدان خود را در بافت جمع میکند و یکی از اولین اعضای غیرمنتظره در این شبکه، دستگاه عصبی است. پژوهشگران آزمایشگاه Cold Spring Harbor گزارش دادهاند که رشتههای عصبی و فیبروبلاستهای تخصصیافته شبکهای همکاریکننده شکل میدهند که به ضایعات پیشسرطانی کمک میکند تا به بیماری بدخیم تبدیل شوند.
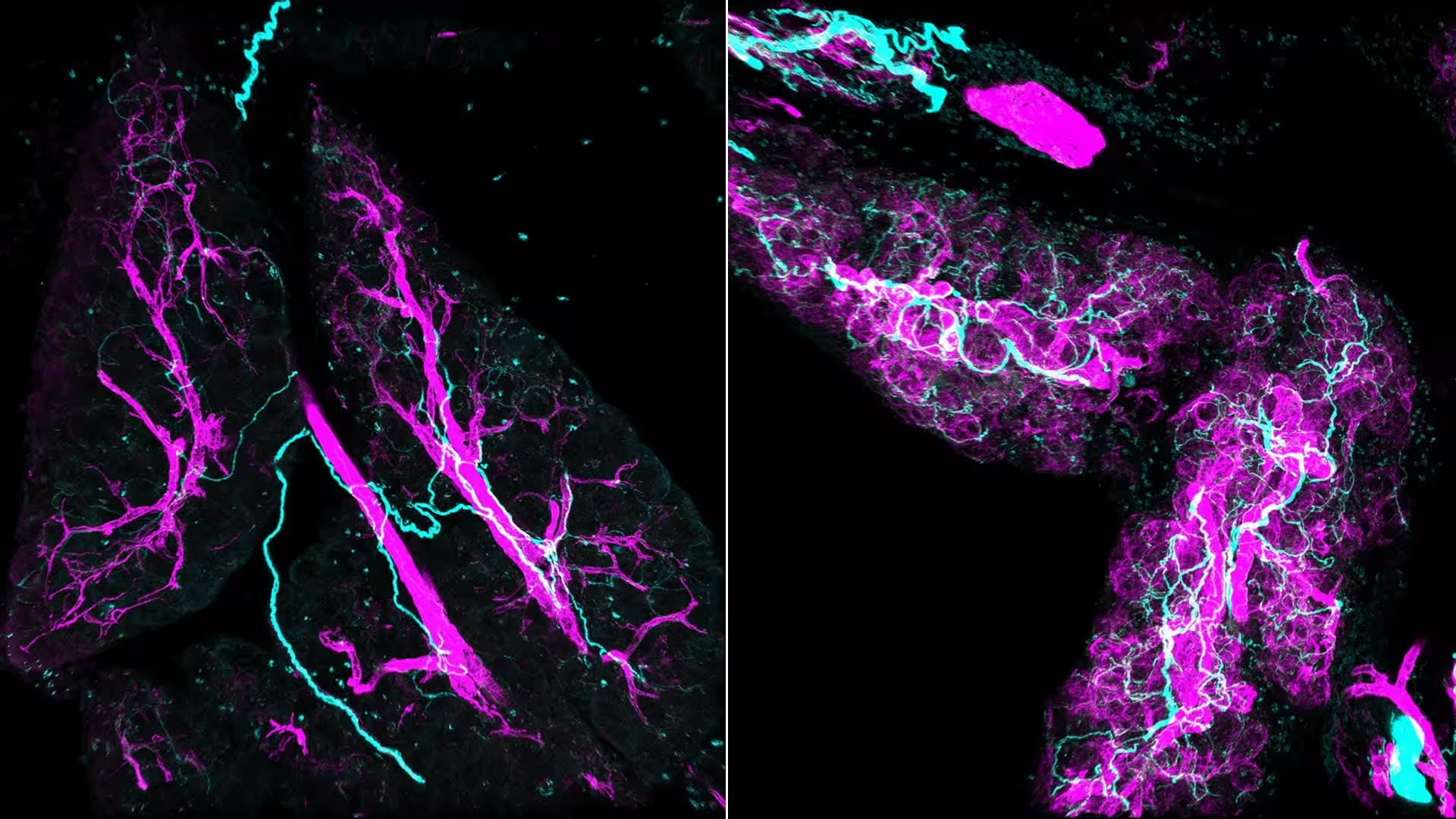
سیگنالهای استرسی در طول التهاب و سرطان بافتها را بازطراحی میکنند. چپ: نگهداری طبیعی بافت. راست: سیگنالهای استرس فیبروبلاستها را «روشن» کرده و آنها را به myCAFها (بنفش) تبدیل میکنند که فعالانه اعصاب (آبی) را به لوزالمعده جذب میکنند.
میتوانید لوزالمعده را مانند یک محله آرام تصور کنید. سپس چند خانه تغییر میکنند — سلولها شروع به رفتار خارج از روال میکنند. بهجای مواجههی مستقیم و سریع، محله خود را بازسازی میکند: سلولهای حمایتی موسوم به فیبروبلاستها به حالت فعال تبدیل میشوند، سیگنالدهی ایمنی تغییر میکند و رشتههای عصبی وارد منطقه میشوند. حاصل، میکرومحیطی بازطراحیشده است که تبدیل بدخیم را تسهیل میکند. این صرفاً تصرف سلولهای سرطانی نیست؛ بلکه یک همکاری پنهانی و سیستماتیک است.
دیدن نادیدنیها با تصویربرداری سهبعدی
میکروسکوپی سنتی بافتهای پیچیده را به برشهای نازک صاف میکند؛ در نتیجه مسیرهای طولانی عصبی مانند نقاط پراکنده به نظر میرسند. تیم تحقیقاتی از ایمونوفلورسانس تمامعضو (whole-mount immunofluorescence) برای نقشهبرداری سهبعدی ضایعات استفاده کرد و این دید کاملاً انقلابی بود: دستههای متراکم و درهمتنیدهی اعصاب که از میان و اطراف فیبروبلاستهای فعال (myofibroblastic cancer-associated fibroblasts یا myCAFs) عبور میکردند. وقتی تصاویر ظاهر شد، پژوهشگران فهمیدند چه مقدار از میکرومحیط ابتدایی تا آن زمان برای تکنیکهای استاندارد نامرئی باقی مانده بود.
بازسازیهای سهبعدی تنها از نظر بصری چشمگیر نیستند؛ آنها روایت را تغییر میدهند. اعصاب دیگر کابلهای منفعل نیستند که سرطان بعدها از آنها بهرهبرداری میکند؛ آنها شرکتکنندگان اولیهاند که با علائم شیمیایی منتشرشده از سوی myCAFها جذب میشوند و سپس سیگنالهایی را بازمیفرستند که همان فیبروبلاستها را فعالتر میکند. این گفتگوی دوطرفه یک حلقهی خودتقویتکننده ایجاد میکند که رفتارهای سلولی مرتبط با رشد تومور را ترویج میدهد.
فناوریها و روشهای تصویربرداری پیشرفته
ابزارهایی مانند تصویربرداری سهبعدی با برش نوری (optical clearing) و میکروسکوپ کنفوکال یا دو-فوتون، به همراه نشانگرهای ایمونوفلورسانس اختصاصی، امکان شناسایی همپوشانیهای فضایی بین اعصاب، فیبروبلاستها و ماتریکس خارجسلولی را فراهم میآورند. این تکنیکها علاوه بر نقشهبرداری ساختاری، میتوانند با نشانگرهای عملکردی همراه شوند تا تغییرات در سیگنالدهی سلولی، جریان کلسیم و فعالیت نورونها در زمان واقعی بررسی شود. این رویکردها درک جدیدی از تعاملات فضایی-عملکردی در میکرومحیط تومور ارائه میدهند که برای طراحی استراتژیهای درمانی و تشخیصی حیاتی است.
مکانیسم مولکولی: حلقهای که رشد تومور را تسهیل میکند
یکی از سلاحهای پنهان در این حلقه، نوراپینفرین (نوراادرنالین) است؛ یک انتقالدهنده عصبی آزادشده توسط رشتههای عصبی سمپاتیک. وقتی نوراپینفرین به فیبروبلاستها میرسد، مسیرهای سیگنالینگ کلسیمی درون سلولی را راهاندازی میکند؛ یک تغییر بیوشیمیایی سریع که عملکردهای پروتوموری آنها را افزایش میدهد و رشد بیشتر اعصاب را تشویق میکند. نتیجه: جایگاهی پیشرونده و تثبیتشده که از تبدیل بدخیم پشتیبانی میکند.
مدلهای حیوانی و آزمایشهای سلولی انسانی هر دو توالی مشابهی را تأیید میکنند: myCAFها سیگنالهای جذبکننده ترشح میکنند؛ اعصاب سمپاتیک به درون ضایعه کشیده میشوند؛ اعصاب نوراپینفرین آزاد میکنند؛ فیبروبلاستها پاسخ میدهند و فعالتر میشوند؛ و ضایعه پیشرفت میکند. قطع هر پیوند در این زنجیره باعث تضعیف بیماری میشود. در آزمایشهای آزمایشگاهی، اختلال شیمیایی در فعالیت سمپاتیک — چه با نوروکسینها و چه با مسدود کردن سیگنالدهی آدرنرژیک — فعالسازی فیبروبلاست را کاهش داد و رشد تومور را کند کرد؛ در یک گزارش کاهش نزدیک به ۵۰٪ در اندازه تومور در مدلهای مورد آزمایش مشاهده شد.
مسیرهای سیگنالدهی و اهداف مولکولی
علاوه بر نوراپینفرین، فاکتورهای رشد عصبی مانند NGF (فاکتور رشد عصبی) و مولکولهای راهنما مانند SEMAها و Netrinها نیز ممکن است در هدایت آکسونها و پروموت کردن نوروژنز در اطراف ضایعات نقش داشته باشند. گیرندههای آدرنرژیک (بهویژه گیرندههای بتا) روی فیبروبلاستها بیان میشوند و فعالسازی آنها میتواند مسیرهای cAMP، PKA و در نهایت تغییرات در بیان ژنهای مرتبط با سنتز ماتریکس و ترشح سیتوکینها را تحریک کند. تغییرات وابسته به کلسیم نیز میتوانند مسیرهای کینازی را فعال کرده و مهاجرت، تکثیر و ترشح ماتریکس خارجسلولی (ECM) را تقویت کنند—عواملی که سختی بافت و معماری تومور را تغییر میدهند و پاسخ ایمنی محلی را نیز دگرگون میسازند.
پیامدهای درمانی و بالینی
این یافتهها درِ عمل را باز میکنند. داروهای از پیش تأییدشده برای شرایط نامرتبط، مانند مسدودکنندههای آدرنرژیک (مثلاً دوکزازوسین و بتا-بلوکرها) ممکن است برای تداخل با بازسازی میکرومحیطی که توسط اعصاب هدایت میشود، بازمصرف شوند. همراه کردن این عوامل با شیمیدرمانی یا ایمنوتراپی میتواند پیشرفت بیماری را در دورهای که هنوز موضعی و آسیبپذیر است، کند کند. ترجمه بالینی نیازمند آزمونهای بالینی دقیق است، اما مزیت واضح است: حمله به اکوسیستم کمکی به جای تمرکز صرف بر سلولهای سرطانی.
بهعلاوه، یافتهها یک پیامد تشخیصی را نیز برجسته میکنند: بازسازی عصبی ممکن است بهعنوان یک نشانگر اولیه عمل کند. اگر بالینیها بتوانند این نفوذ عصبی را بهطور قابلاعتماد شناسایی یا تصویربرداری کنند، ممکن است بافت در معرض خطر زودتر شناسایی شده و قبل از تثبیت تومورها مداخله انجام شود.
گزینههای درمانی ترکیبی و بازدارنده
استراتژیهای بالقوه شامل:
- استفاده از بلاکرهای آدرنرژیک سیستمیک یا موضعی برای کاهش سیگنالدهی نوراپینفرین.
- رویکردهای نوروترانکشنال مانند دنورواسیون موضعی یا استفاده از نوروترواکسینهای هدفمند در مدلهای پیشبالینی.
- ترکیب با ایمنوتراپی برای اصلاح محیط ایمنی توموری که اغلب توسط فیبروبلاستها و ماتریکس تغییر میکند.
- هدفگیری فاکتورهای رشد عصبی یا مسیرهای هدایت آکسون برای جلوگیری از ورود اعصاب جدید.
هر یک از این رویکردها نیاز به ملاحظات ایمنی دقیق دارد، چرا که فعالیت عصبی و آدرنرژیک در عملکرد معمول بافتها و پاسخهای فیزیولوژیک حیاتی نقش دارد. کاهش سیگنالدهی سمپاتیک میتواند عوارض سیستمیک از جمله افت فشار خون، اختلالات قلبی و تغییر در پاسخ استرسی را به همراه داشته باشد. بنابراین، مطالعات روی دُز، مسیر تجویزی و هدفگیری موضعی یا سیستمیک اهمیت بالایی دارند.
پیامدهای تشخیصی و نشانههای زیستی
شناسایی زودهنگام نفوذ عصبی میتواند از طریق روشهای تصویربرداری مولکولی و ساختاری امکانپذیر شود. برخی گزینهها عبارتاند از تصویربرداری مولکولی با نشانگرهای هدفگیرندهی آدرنرژیک، PET-CT با ردیابهای اختصاصی، یا MRI با پروتکلهای بافتشناسانه پیشرفته و تکنیکهای آنالیز بافتی سهبعدی. همچنین تجزیهوتحلیل بیوپسی و مارکرهای مایعپایه (مثل محرکهای عصبی یا سیتوکینهای مرتبط با فعالشدن فیبروبلاست) ممکن است نشانگرهای زیستی نوینی فراهم کنند.
در عمل بالینی، ترکیب اطلاعات تصویربرداری سهبعدی با پروفایل مولکولی فیبروبلاستها (تمایز بین myCAFها و iCAFها و سایر زیرشاخهها) میتواند معیارهای پیشآگهی و پیشبینیکنندهی جدیدی ارائه دهد که برای غربالگری بیماران پرخطر یا طراحی درمانهای هدفمند مفید است.
چالشها و ملاحظات ترجمه بالینی
برای ترجمهی این یافتهها به آزمایشهای انسانی باید گامهای متعددی برداشته شود: شناسایی مولکولهای سیگنالدهی حیاتی، ارزیابی اثرات بلوک آدرنرژیک بر عملکرد طبیعی بافتها، تعیین ایمنی و تحملپذیری درمانهای نورو-هدفمند، و طراحی کارآزماییهایی که ترکیب دارویی مناسب (مثلاً با شیمیدرمانی یا ایمنوتراپی) را مشخص کنند. همچنین لازم است تا مشخص شود کدام بیماران بیشترین سود را خواهند برد؛ احتمالاً آنهایی که شواهدی از نفوذ عصبی یا پروفایل فیبروبلاستی مشخص دارند.
بینش کارشناسان
«قبلاً فکر میکردیم اعصاب بیشتر برای درد یا تهاجم در مراحل پایانی اهمیت دارند»، میگوید یکی از پژوهشگران ارشد مشارکتکننده در مطالعه. «این مطالعه آن دیدگاه را وارونه میکند: اعصاب از ابتدا معماران فعال میکرومحیط تومور هستند. مسدود کردن سیگنالهای آنها میتواند یک استراتژی پیشگیرانه باشد، نه فقط تسکینی.»
نیاز به تلاش متمرکز برای ترجمه این یافتهها به آزمایشهای بالینی انسان واضح است. پژوهشگران باید تعیین کنند کدام مولکولهای سیگنالی حیاتیترند، آیا بلوک کردن فعالیت سمپاتیک عملکرد بافت طبیعی را مختل میکند و بهترین روش برای ترکیب داروهای متمرکز بر اعصاب با درمانهای موجود چیست. گروههای حامی و بیماران نیز علاقهمندی خود را ابراز کردهاند؛ آنها میدانند که روشهای جدید ممکن است برای بهبود نتایج در سرطانی که بهخاطر تشخیص دیررس و پاسخ ضعیف شناخته شده، حیاتی باشند.
پیشنهاداتی برای تحقیقات آینده
برای پیشبرد این خط تحقیق پیشنهاد میشود:
- مطالعات مکانمحور با تصویربرداری سهبعدی و آنالیز تکسلولی برای تعیین دقیق فعلوانفعالات سلولی بین فیبروبلاستها، اعصاب و سلولهای پیشسرطانی.
- تحقیقات مولکولی برای شناسایی لیست هدفهای قابلدارو از جمله گیرندههای آدرنرژیک خاص، فاکتورهای رشد عصبی و مولکولهای هدایت آکسون.
- مطالعات پیشبالینی روی بازمصرف داروها (drug repurposing) مانند بلاکرهای آدرنرژیک و ارزیابی ترکیب آنها با شیمیدرمانی و ایمنوتراپی.
- توسعه روشهای تصویربرداری کلینیکی برای تشخیص نفوذ عصبی اولیه و ارزیابی آن بهعنوان نشانگر خطر برای غربالگری و پیگیری بیماران پرخطر.
درس بزرگتر این است که تومورها اکوسیستمهایی هستند. آنها اطرافیان را جذب، قانع و مصادره میکنند — از جمله دستگاه عصبی. اگر بتوان این جذب را زود تشخیص داد و قطع کرد، شاید بتوان گفتگو را کوتاه کرد و از تثبیت بیماری جلوگیری نمود.
منبع: scitechdaily
نظرات
مکس_x
خیلی پرهیاهو نشه لطفا، ایده خوبه ولی عوارض بلوک کردن سمپاتیک بزرگه، دادههای بیشتر لازم
رضا
تصویربرداری سهبعدی واقعا چشمگیره، narrativو عوض میکنه. امیدوارم تبدیل به شاخص تشخیصی بشه
بیونیکس
من تو آزمایشگاه هم دیدم فیبروبلاستا تغییر پیدا میکنن، اما تصور نمیکردم اعصاب اینقدر فعال باشن، جالبه
توربو
این نتایج تو مدلهای حیوانی واضحه، اما آیا تو بیمارای واقعی هم همینقدر قوی عمل میکنه؟
کوینکس
به نظرم منطقیه؛ بازکردن مسیرهای عصبی میتونه هدفدرمانی جدید باشه، ولی ایمنی رو باید بسنجن
بایتکس
وااای، یعنی اعصاب از روزهای اول دارن نقشه میکشن؟! شوکه شدم... اگه بشه جلوشو گرفت بازم امید هست

ارسال نظر