10 دقیقه
محیط پیش از تولد و ریسک اضطراب در طول زندگی
تحقیقات تجربی اخیر روی موشها نشان میدهد که آسیبپذیری نسبت به اضطراب در بزرگسالی ممکن است ریشه در دورهٔ پیش از تولد داشته باشد. پژوهشگران مؤسسهٔ Weill Cornell Medicine گزارش دادهاند که عفونت یا استرس مادری در دوران حاملگی میتواند نشانههای مولکولی و تغییرات در سطح مدارهای عصبی را در مغز فرزندان باقی بگذارد که در پی آن احتمال بروز رفتارهای شبیه اضطراب در آینده افزایش مییابد. این مطالعه تغییرات ویژهای را در ناحیهٔ دنتیت ژای (ventral dentate gyrus یا vDG) — زیرمنطقهای از هیپوکامپ که در ارزیابی تهدیدها و رفتارهای اجتنابی نقش دارد — شناسایی میکند و این تغییرات را به بازبرنامهریزی اپیژنتیک تنظیم ژنهای نورونی مرتبط میداند.
Study design: modeling maternal inflammation
برای بررسی اینکه چگونه دشواریهای پیش از تولد بر رشد مغز تأثیر میگذارند، تیم تحقیقاتی از مدلهای موشی مهندسی ژنتیکیشده استفاده کرد که سیگنالدهی التهابی افزایشیافته را در یک مادر باردار شبیهسازی میکنند. این روش جنبههایی از عفونت مادری یا استرس فیزیولوژیک مزمن را بازتولید میکند بدون آنکه ژنهای پاسخ به استرسِ تغییریافته بهطور مستقیم به تولهها منتقل شوند. پژوهشگران سپس فرزندان را تا بزرگسالی دنبال کردند و رفتار، فعالیت عصبی و تغییرات در الگوهای DNA را در نواحی هدفشدهٔ مغزی تحلیل نمودند.
در این مجموعه آزمایشی پژوهشگران تمرکز خود را بر روی فرزندان مذکر گذاشتند تا آزمایشهای رفتاری را انجام دهند، زیرا در این مدل، نرها رفتارهای شبیه اضطراب را با شدت بیشتری نشان میدادند. توجه مهم در اینجا این است که این نرها از نظر ژنتیکی طبیعی بودند — یعنی آنها استعداد التهابی مهندسیشده را به ارث نبرده بودند — اما بهعنوان حیوانات بالغ علائم مکرری از حساسیت بالاتر به اضطراب بروز دادند. نمونههایی از این علائم شامل گرایش قوی به فضاهای بسته، اجتناب از مناطق باز و رفتارهای بیقراری در آزمونهای استاندارد اضطرابسنجی بودند، که همگی در مقایسه با حیوانات کنترل معنیدار به نظر میرسید.
Neural circuits: overactive neurons in the ventral dentate gyrus
هنگامی که در معرض تهدید قرار گرفتند، موشهای تحت تأثیر فعالسازی بیش از حد در زیرمجموعهای از نورونها در ناحیهٔ vDG را نشان دادند. نقش vDG در پردازش اطلاعات حسی و زمینهای و ارزیابی تهدیدها بسیار مهم است؛ این منطقه به تنظیم پاسخهای رفتاری به محیط و تمایز بین ایمن و تهدیدآمیز کمک میکند. فعالشدن بیش از حد در این بخش میتواند سیگنالهای تهدید را تقویت کند و حیوان را به سمت رفتارهای اجتنابی سوق دهد. در این مطالعه، نویسندگان نشان میدهند که تجربهٔ نامطلوب در دورهٔ جنینی اثرات پایداری بر روی نورونهای vDG برجای میگذارد که واکنش این سلولها را در مواجهه با زمینههای ناایمن در بزرگسالی تغییر میدهد.
بهقول میکلش تات، نوروفارماکولوژیست و یکی از نویسندگان مقاله: "دادههای ما نشان میدهد که دشواریهای دوران بارداری اثرات پایداری بر نورونهای vDG بر جای میگذارد و محیط جنینی را به رفتارهای شبیه اضطراب پیوند میدهد." او افزود که این مکانیسم میتواند توضیحدهندهٔ حساسیت پایدار به استرس و تمایل به اجتناب در برخی از افراد با اضطراب ذاتی باشد. این نکته اهمیت دارد زیرا نشان میدهد تاثیرات دوران بارداری میتواند بهصورت نقطهای و مشخص بر مدارهای مربوط به ارزیابی تهدید عمل کند، نه آنکه یک تغییر کلی در سراسر مغز ایجاد کند.
Epigenetic reprogramming: DNA methylation and gene expression
برای بررسی مکانیسمهای مولکولی، محققان الگوهای متیلاسیون DNA را در بافت نورونی از vDG اندازهگیری کردند. متیلاسیون DNA یک برچسب اپیژنتیک است که میتواند فعالیت ژنها را بیصدا کند یا تنظیم نماید بدون اینکه توالی اصلی DNA را تغییر دهد. آنها هزاران سایت دارای متیلاسیون متفاوت را در vDG موشهایی که تحت استرس پیش از تولد قرار گرفته بودند پیدا کردند؛ این تغییرات بهطور ویژه در نواحی ژنی متمرکز بودند که مسئول ارتباط سیناپسی و قابلیت برانگیختگی نورونی هستند.
این تغییرات اپیژنتیک نه بهصورت گسترده در تمام سلولهای vDG، بلکه در یک کسر کوچک از نورونها متمرکز شده بودند. بهعبارت دیگر، یک موش ممکن است تقریبا ۴۰۰٬۰۰۰ سلول در vDG داشته باشد، اما تنها چند هزار سلول در طول بارداری تحت تأثیر این بازبرنامهریزی قرار گرفتهاند. زمانی که این نورونهای بازبرنامهریزیشده در یک محیط تهدیدآمیز قرار میگیرند، نشانگرهای فعالیت آنها تقویت میشود — وضعیتی که با یک مدار عصبی مستعد اغراق در برآورد خطر و گرایش به اجتناب سازگار است.
کریستن پلیل، زیستشناس مولکولی عصبی و از دیگر همنویسندگان، پیامد عملکردی را اینگونه خلاصه میکند: "این تغییرات اپیژنتیک بهطور کلی به برخی نورونها در vDG دستور میدهند که در بزرگسالی در مواجهه با محیطهای ناایمن متفاوت پاسخ دهند. این نورونها فعالیت بیش از حد نشان میدهند و در نهایت به این منجر میشود که موش محیط را تهدیدآمیزتر از آنچه هست ببیند." این نوع توضیح عملکردی کمک میکند تا پیوند بین سطح مولکولی و رفتاری روشنتر شود؛ یعنی چگونه یک تغییر شیمیایی کوچک روی DNA میتواند تابآوری رفتاری و ارزیابی ریسک را متحول کند.
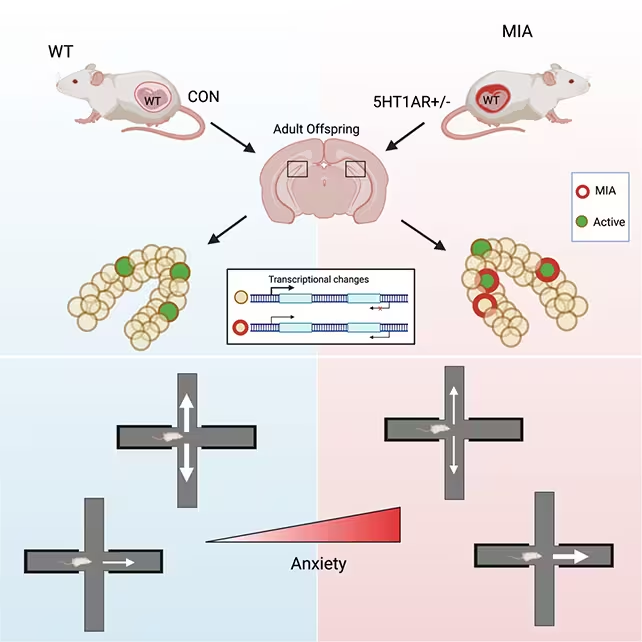
موشهایی که در رحم در معرض استرس قرار گرفته بودند در بزرگسالی اضطراب بیشتری نشان دادند.
Scientific context and implications
اختلالات اضطرابی جزو شایعترین مشکلات سلامت روانی در سطح جهان بهشمار میروند؛ مطالعات اپیدمیولوژیک نشان میدهد تقریبا از هر سه نفر، یکی در طول زندگی خود ممکن است اضطراب بالینی را تجربه کند. پژوهشهای پیشین در انسان و حیوان ارتباط بین سلامت پیش از تولد — از جمله عفونت مادری، تغذیه و سطح استرس — و افزایش شیوع اختلالات خلقی و اضطرابی در فرزندان را نشان دادهاند. این مطالعهٔ جدید روی موش زنجیرهٔ مکانیسمی قابل قبولی را مشخص میکند: التهاب مادری → تغییرات اپیژنتیک متمرکز در مدار ارزیابی تهدید → حساسیت طولانیمدت به استرس و رفتارهای اجتنابی.
با نگاشت همزمان هیپراکتیویته مدار و تغییرات متیلاسیون DNA همراه، این پژوهش به بدنهای رو به رشد از شواهد اضافه میکند که محیطهای اوایل زندگی میتوانند عملکرد مغز را از طریق برچسبهای مولکولی پایدار برنامهریزی کنند. اهمیت این یافتهها دوگانه است: از یک سو، امکان شناسایی زیستنشانگرهای تشخیصی جدید را فراهم میکند — امضاهای اپیژنتیک که ممکن است در بافت قابل دسترس مانند خون یا سلولهای دهانی قابل شناسایی باشند — و از سوی دیگر درهای توسعهٔ مداخلات هدفمند را باز میگذارد که میتوانند از آمادهسازی نامطلوب مدارها جلوگیری یا آنها را بازتنظیم کنند.
از دیدگاه پژوهشی و بالینی، این نتایج همچنین بر اهمیت نگاه چندلایهای تأکید میکند: تنها مشاهدهٔ رفتار کافی نیست؛ باید مدارها، فعالیت نورونی و نشانههای مولکولی را همزمان اندازهگیری کرد تا تصویر کاملی از علت و معلول بهدست آید. چنین چارچوب چندسطحی میتواند راهنمای مطالعات آینده باشد که به دنبال تعیین عاملهای خطر، پنجرههای حساس توسعهای و راهکارهای مداخلهای هستند.
Future directions and translational challenges
نویسندگان مطالعه نکات احتیاطی مهمی را برجسته میکنند: این نتایج از مدلهای موشی کنترلشده بهدست آمدهاند و تعمیم آنها به انسان نیازمند دقت است. پرسشهای کلیدی که هنوز بدون پاسخ ماندهاند شامل این موارد است: چرا تنها زیرمجموعهای از نورونهای vDG نشانهای اپیژنتیک را کسب میکنند؟ آیا نشانهای متیلاسیونی مشابه را میتوان در بافتهای محیطی سادهتر برای نمونهبرداری (مانند خون نوزاد یا مخاط دهان) یافت؟ آیا تفاوتهای جنسی در پاسخ به استرس پیش از تولد نقش دارند و چگونه؟
تیم تحقیقاتی قصد دارد پنجرههای زمانی توسعهای حساستر به التهاب مادری را نگاشت کند — یعنی مشخص کند در چه دورههایی از بارداری یا چگونگی شدت التهاب اثرات قویتری برجای میگذارند — و مداخلاتی را آزمایش نماید که بتوانند فعالیت vDG و رفتار را به حالت طبیعی بازگردانند. این مداخلات ممکن است شامل رویکردهای رفتاری (کاهش استرس مادری)، داروهای ضدالتهاب مطمئن در دوران بارداری، مداخلات اپیژنتیک هدفمند با استفاده از ابزارهای مولکولی نوین، یا درمانهای پس از زایمان جهت بازتنظیم مدارها باشند.
از منظر بهداشت عمومی، این مطالعه ارزش مراقبتهای پیش از زایمان و کنترل عفونتها در دوران بارداری را تقویت میکند. همچنین نشان میدهد که تغییرات ظریف در محیط جنینی ممکن است تغییرات پایداری در مدارهای عصبی ایجاد کند که گرایشهای رفتاری را برای دههها شکل میدهد. برای سیاستگذاران و کارکنان سلامت این پیام وجود دارد که سرمایهگذاری در سلامت مادران و پیشگیری از عفونتها و کاهش بار استرس در دوران بارداری میتواند پیامدهای قابلتوجهی برای کاهش بار اختلالات اضطرابی در نسلهای بعدی داشته باشد.
Expert Insight
دکتر النا وارجاس، عصبشناس رشد که در این مطالعه مشارکت نداشته است، میگوید: "این کار نمونهٔ برجستهای است از اینکه چگونه شرایط پیش از تولد میتوانند مدارهای عصبی مشخصی را از طریق مکانیسمهای اپیژنتیک شکل دهند." او افزود که اگرچه انتقال مستقیم نتیجهگیری از موش به اختلالات اضطرابی انسانی پیچیده و نیازمند مطالعات طولی و فراتحلیل است، اما ترکیب آزمونهای رفتاری، نگاشت مدارها و پروفایلینگ متیلاسیون DNA در یک مطالعه واحد، باورپذیری زیستی این فرضیه را تقویت میکند. او پیشنهاد میکند که گامهای ترجمهای آینده باید روی شناسایی نشانگرهای محیطی قابل نمونهبرداری و تعیین پنجرههای درمانی مناسب برای مداخله متمرکز شوند.
Conclusion
مطالعهٔ Weill Cornell شواهد مکانیکی ارائه میدهد که التهاب مادری در دوران بارداری میتواند با بازبرنامهریزی یک جمعیت محدود از نورونها در دنتیت ژای ونترال، فرزندان را مستعد اضطراب بیشتر کند. اگرچه این نتایج در موشها بهدست آمدهاند، اما یافتهها روشن میکنند که چگونه تجربیات پیش از تولد میتوانند اثرات مولکولی و مدار-محور پایداری برجای گذارند که رفتار را تحت تأثیر قرار میدهند. برای تعیین اینکه آیا امضاهای اپیژنتیک مشابه در انسان وجود دارند و آیا میتوان از آنها برای تشخیص زودهنگام یا مداخلات هدفمند استفاده کرد، تحقیقات بیشتری لازم است. در مجموع، این خط پژوهشی پتانسیل ایجاد راهکارهای پیشگیرانه و درمانی جدید را دارد که میتواند بار اختلالات اضطرابی را کاهش دهد.
منبع: sciencealert

ارسال نظر