10 دقیقه
بدون ریه. چهل و هشت ساعت. قلبی که بهطور پیوسته میتپید در حالی که ماشینی کار تنفس هر دو ریه را انجام میداد.
در بهار ۲۰۲۳ مردی ۳۳ ساله به آنفلوانزا مبتلا شد که رفتاری غیرمعمول از خود نشان داد. عفونت سریع به پنومونی بدل شد، سپس به سپسیس و در نهایت به سندرم دیسترس تنفسی حاد (ARDS) پیشرفت کرد — فروپاشی ناگهانی قابلیت ریهها در تبادل اکسیژن. آنتیبیوتیکها بیاثر ماندند. بافت ریه عملاً تخریب و مایعوار شد و التهاب در بدن بیمار پخش شد. تیم پزشکی با انتخابی دشوار روبهرو شد: گذاشتن ریههای عفونی در جای خود احتمالاً به مرگ بیمار منجر میکرد؛ برداشتن آنها هم میتوانست قلب را که از گردش خون ریوی مناسب محروم میماند، در معرض نارسایی قرار دهد.
تبدیل ریهها به ریههای درخواستی
جراحان دانشگاه نورثوسترن با سازوکاری جسورانه در حمایت خارجبدنی پاسخ مشکل را دادند: ریه مصنوعی کامل (TAL). برخلاف اکمو معمولی (ECMO ـ اکسیژندهی غشایی خارجبدنی) که خون را اکسیژنه میکند اما به دینامیک مدار ریوی طبیعی وابسته است، TAL ساختهشده توسط تیم، تبادل گازی ریوی را شبیهسازی کرد و در عین حال جریان خون را فعالانه مدیریت و از قلب محافظت کرد.
این دستگاه دو کانال جریان خون موازی را با یک شنت تطبیقدهنده جریان ترکیب میکرد. نتیجه سیستمی بود که میتوانست تغییرات ناگهانی در گردش خون پس از برداشتن هر دو ریه (پنیومونکتومی دوطرفه) را هموار کند — مانعی کلیدی که معمولاً باعث مرگ این بیماران میشود. با برداشتن ریهها و نصب TAL، نشانههای بهبود سیستمیک از عفونت ظرف چند ساعت (نه هفته) ظاهر شد.
دکتر انکیت بهارات، جراح قفسه سینه که رهبری عمل را برعهده داشت، گفت: «او دچار عفونت ریهای شده بود که با هیچ آنتیبیوتیکی قابل درمان نبود، چون به همه مقاوم بود. آن عفونت باعث شد ریههایش مثل مایع درآیند و سپس به سایر نقاط بدن سرایت کند.» تحلیل مولکولی ریههای خارجشده تأیید کرد که تیم حدس میزد: آسیب ایمنی و فیبروتیک به حدی بود که بهبود خودبهخودی ناممکن است. پیوند، نه نجات موضعی، تنها مسیر واقعبینانه برای بقا بود.
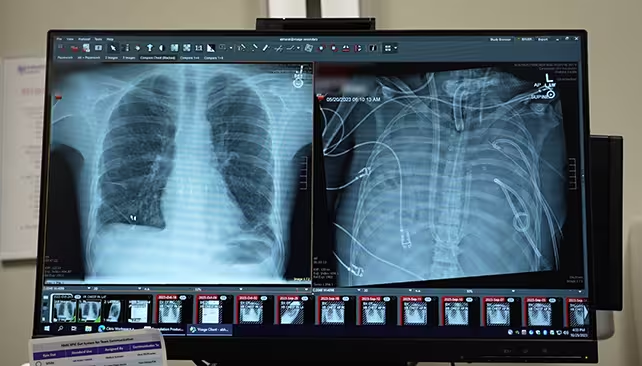
ریههای جدید بیمار (چپ) و ریههای قدیمی (راست).
TAL زمان خرید. زمان کافی برای کنترل سپسیس بیمار، تثبیت سایر ارگانها و فراهم شدن امکان دریافت یک جفت ریه از اهداکننده. پس از ۴۸ ساعت روی TAL، جراحان پیوند دوجانبه ریه را انجام دادند. دو سال بعد، بیمار بهبود یافته و با ریههای اهدایی عملکردی زندگی میکند.
این داستان نمونهای قدرتمند از کاربرد فناوری حمایت خارجبدنی در وضعیتهای حاد تنفسی است و نشان میدهد که نوآوریهای ترکیب مهندسی و جراحی میتواند پنجرههای درمانی جدیدی برای بیماران با آسیب ریوی غیرقابل بازگشت ایجاد کند.
چرا این موضوع اهمیت دارد
ARDS ناشی از عفونتها معمولاً با مراقبت حمایتی شدید درمان میشود و بسیاری از پزشکان بر این باورند که اگر بیمار به اندازه کافی حمایت شود، ریهها به مرور بهبود مییابند. این مورد این فرض را به چالش میکشد. این تجربه نشان میدهد که در بیماران منتخب با تخریب غیرقابلبرگشت بافت ریوی بهعلت عفونت، برداشتن اندامهای بیمار و جایگزینی آنها با یک ریه مصنوعی قابل اعتماد میتواند نجاتبخش باشد — مشروط بر اینکه پیوند در یک پنجره زمانی محدود قابل انجام باشد.
محدودیتهای عملی وجود دارد. ساخت و راهبری یک TAL با این پیچیدگی در حال حاضر نیازمند تیمهای جراحی تخصصی و پشتیبانی مهندسی است که تنها در چند مرکز در دسترساند. در دسترسبودن ریههای اهدایی نیز همچنان عاملی تعیینکننده است. با این حال، نوآوریهای بهکاررفته در این مورد — بهویژه معماری دوکاناله جریان و شنت تطبیقدهنده جریان — میتوانند راهنمای بازطراحی دستگاههای خارجبدنی شوند که بهطور گستردهتری در بخشهای مراقبتهای ویژه بکار گرفته شوند.
برای بیماران جوانی که دچار آسیب فاجعهبار ریوی ناشی از عفونت شدهاند، پیوند میتواند حتی در شرایط حاد جانبخش باشد، مشروط بر اینکه تیمهای جراحی این گزینه را در نظر بگیرند و زیرساخت لازم وجود داشته باشد.
دیدگاه کارشناسان
«این مورد نحوه تفکر ما درباره نارسایی حاد ریوی را بازتعریف میکند» میگوید دکتر امیلی کارتر، متخصص مراقبتهای فشرده قلبی-قفسه سینه با تجربه طولانی در پشتیبانی گردش خون مکانیکی. «قبلاً پیوند را برای بیماریهای مزمن و پیشرونده رزرو میکردیم. اکنون میبینیم که وقتی عفونت ساختار ریه را فراتر از ترمیم از بین میبرد، پشتیبانی موقت با ریه مصنوعی کامل بههمراه پیوند بهموقع میتواند — و باید — بخشی از گفتگو باشد.»
فراتر از پیروزی بالینی آنی، این مورد یک دستورکار فنی گستردهتر را مطرح میکند: هوشمندتر کردن سیستمهای خارجبدنی از نظر مدیریت جریان، کاهش ریسک ترومبوز و طراحی دستگاههایی که تیمهای مراقبتهای ویژه بتوانند با آموزش مناسب بهطور گستردهتری استفاده کنند. دستیابی به این هدف نیازمند همکاریهای مهندسی، مسیرهای نظارتی شفاف و برنامههای آموزشی برای مقیاس دادن توانمندیهایی است که امروز عمدتاً در مراکز برتر متمرکز است.
چه کسانی از این تلاش بهرهمند میشوند؟ بیمارانی که امروز اغلب گزینهای ندارند. چه کسی هزینه را پرداخت میکند؟ نظامهای بهداشتی که باید هزینههای کوتاهمدت را در برابر جانهای نجاتیافته و بهبودی بلندمدت بسنجند. گام بعدی گسترش کارآزماییها و گزارش نتایج است تا این رویکرد از یک گزارش موردی چشمگیر تبدیل به مسیر درمانی معتبر شود — برای تعداد کمی که اکنون به آن نیاز دارند و شاید در آینده برای بسیاری بیشتر.
این یادآوری است که لبههای پزشکی جایی است که مهندسی، مراقبتهای بحرانی و شجاعت جراحی به هم میرسند — و گاهی بقا به معنای تصویرسازی عملکرد یک عضو آنقدر طولانی است که بتوان آن را جایگزین کرد.
جزئیات فنی: چگونه TAL کار میکند
برای پزشکان و مهندسان، مهم است که سازوکار عملکردی TAL را دقیقتر بفهمند. در اصل، یک ریه مصنوعی کامل باید سه عملکرد کلیدی را انجام دهد:
- اکسیژندهی مؤثر خون و حذف دیاکسیدکربن،
- مدیریت جریان خون و فشارها بهنحوی که قلب تحت فشار غیرطبیعی قرار نگیرد،
- حداقلسازی خطرات هموراژیک و ترومبوتیک، و حفظ پایداری همودینامیک.
نسخهای که در این مورد استفاده شد از دو مسیر جریان موازی بهره میبرد که هر مسیر میتواند بخشی از دبی قلب را دریافت و اکسیژنه کند. شنت تطبیقدهنده با نظارت بر فشار و جریان، جریان بین دو مسیر را تنظیم میکند تا نوسانات ناگهانی فشار پسبار را کاهش دهد و از اختلال پیچیده در بازگشت و خروجی قلب جلوگیری کند. از منظر مهندسی، این کار به معنی ترکیب حسگرهای فشار، شیرهای جریان قابل تنظیم و طراحی مدولار غشاهای تبادلگاز با سطح تماس بالا است.
در مقایسه با اکمو سنتی، که غالباً جریان ثابت یا نسبت ثابتی بین وریدی و شریانی دارد و همچنان نیاز به تعامل با مدار ریوی بیمار احساس میشود، TAL بهعنوان دستگاهی کاملاً جایگزین عمل میکند که مستقل از ساختار ریوی آسیبدیده گردش گاز را برقرار میسازد و بار مکانیکی را از روی قلب برمیدارد یا بهطور کنترلشده تقسیم میکند.
ملاحظات جراحی و مراقبت پس از عمل
برداشتن هر دو ریه (پنیومونکتومی دوطرفه) عملی نیست که بدون آمادهسازی و تیم گسترده انجام شود. تصمیمگیری شامل موارد زیر بود:
- تأیید عدم پاسخ به تمامی درمانهای آنتیبیوتیکی و درمان حمایتی، بر پایه بررسیهای میکروبیولوژیک و تصویربرداری؛
- ارزیابی عملکرد سایر ارگانها و تصمیمگیری در مورد توانایی بیمار برای تحمل عمل جراحی و پسپیوند؛
- برنامهریزی دقیق برای نصب TAL، شامل محلدهی کانولها، هموستاز، و مدیریت آنتیکواگولاسیون برای کاهش خطر لخته و خونریزی؛
- هماهنگی با شبکه پیوند برای دریافت ریههای اهدایی در کمترین زمان ممکن.
مرحله پس از عمل روی TAL شامل نظارت دقیق همودینامیک، کنترل آنتیبیوتیکی هدفمند بر اساس کشتها، و پشتیبانی از سایر ارگانها تا زمان پیوند بود. موفقیت در این مرحله مستلزم تیمی از جراحان قفسه سینه، متخصصین مراقبتهای ویژه، پرستاران آموزشدیده در اکمو/TAL و مهندسان بیومدیکال بود.
محدودیتها و چالشها
چند محدودیت عملی و علمی هنوز بر سر راه توسعه و انتشار وسیع این رویکرد وجود دارد:
- در دسترسبودن اعضای اهدایی: صف انتظار پیوند و تطابق پیوندی همواره محدودیت دارد؛ زمان بحرانی پس از برداشتن ریهها کوتاه است و تأمین سریع اهداکننده دشوار است.
- نیاز به تخصص و زیرساخت: کمتر مرکز درمانی امکانات لازم برای اجرای چنین پروتکلهایی را دارد؛ توسعه ظرفیت نیازمند سرمایهگذاری، آموزش و برنامههای نظارتی است.
- مسائل ایمنی و عوارض: خطرات ترومبوز، خونریزی، عفونتهای دستگاهی و ناپایداری همودینامیک همچنان وجود دارند و باید از طریق طراحی بهتر و پروتکلهای مراقبتی کاهش یابند.
- ملاحظات اخلاقی و اقتصادی: اختصاص منابع محدود به یک بیمار بحرانی، در مقابل هزینه-فایده در جمعیت بزرگتر، سوالات پیچیدهای ایجاد میکند.
مسیر توسعه آینده
برای اینکه این دستاورد به یک گزینه درمانی گستردهتر تبدیل شود لازم است:
- مطالعات بالینی گستردهتر و ثبت دادههای متعدد انجام شوند تا نتایج، شاخصهای بقا و پارامترهای ایمنی مشخص شوند؛
- توسعه صنعتی و استانداردسازی قطعات و سیستمها به منظور کاهش هزینهها و افزایش قابلیت تکرارپذیری؛
- برنامههای آموزشی و گواهینامه برای تیمهای جراحی و مراقبتهای ویژه تا مراکز بیشتری بتوانند TAL را بهکار بگیرند؛
- گفتگوهای قانونی و اخلاقی درباره اولویتبندی اهداکنندگان و تصمیمگیری در شرایط حاد گسترش یابد.
اگر این گامها عملی شوند، ممکن است TAL و دستگاههای مشابه در آینده نزدیک بهعنوان بخشی از مجموعه درمانی ARDSهای شدید که به درمانهای معمول پاسخ نمیدهند، در نظر گرفته شوند و نه فقط یک اقدام استثنایی در مراکز منتخب.
نتیجهگیری
این پرونده بالینی یادآور این است که تلفیق مهندسی پیشرفته و شجاعت جراحی میتواند مرزهای درمان را جابجا کند. تصور کردن عملکرد یک عضو برای مدت محدودی تا زمان تهیه یک عضو جایگزین، اکنون از قلمرو فرضیات خارج شده و در موارد منتخب به واقعیت تبدیل شده است. حرکت بعدی تبدیل این دستاوردها از گزارش موردی به مسیرهای درمانی مستند و قابل پیادهسازی است تا درمانگران در سراسر جهان بتوانند از آن بهرهمند شوند و جانهای بیشتری نجات یابند.
منبع: sciencealert

ارسال نظر