8 دقیقه
یک قرص کوچک روزانه میتواند جان افراد را نجات دهد — و در عین حال گاهی عضلات را بسوزاند، دچار گرفتگی کند یا از کار بیندازد. برای تقریبا یک نفر از هر ده نفری که استاتین میخورند تا کلسترول LDL را کاهش دهند، دردهای نامشخص و خستگی عمیق به یک دلیل واقعی برای قطع درمان تبدیل میشود.
پژوهشگران دانشگاه کلمبیا و دانشگاه رورِستر بسیاری از این علائم را به یک لغزش مولکولی واحد پیوند زدهاند: به نظر میرسد برخی استاتینها کانال کلسیم را در سلولهای عضله اسکلتی باز میکنند. وقتی آن دروازه نیمهباز باقی بماند، کلسیم به فیبرها هجوم میآورد، آنزیمها فعال میشوند و آبشاری از آسیب میتواند رخ دهد — از درد و ضعف مزمن تا سندرمهای نادر اما فاجعهآمیزی مانند رابدومیولیز.
چگونه یک داروی کاهشدهنده کلسترول با دروازه عضله برخورد میکند
استاتینها کار مفید خود را در کبد انجام میدهند. آنها آنزیم HMG-CoA reductase را مهار میکنند، آنزیمی که برای سنتز کلسترول ضروری است، و بدین ترتیب سطح لیپوپروتئین با چگالی کم (LDL) را کاهش میدهند؛ LDL یکی از عوامل اصلی آترواسکلروز و سکتههای قلبی است. اما زیستشناسی پیچیده است؛ مولکولهایی که برای یک پروتئین طراحی شدهاند میتوانند به پروتئینهای دیگر هم اثر بگذارند.
وارد RyR1 میشویم — گیرنده ریانودین 1 — یک کانال کلسیم به شکل قارچ که در رتیکولوم سارکوپلاسمی اطراف فیبرهای عضلانی جاسازی شده است. RyR1 را میتوان مانند نگهبان یک باشگاه شلوغ تصور کرد: او تعیین میکند چه زمانی کلسیم میتواند وارد کف رقص شود و فیبرهای عضلانی را منقبض کند. اگر خیلی کم باشد، حرکت دچار نقصان میشود؛ اگر خیلی زیاد باشد، بافت خودتخریبی را آغاز میکند.
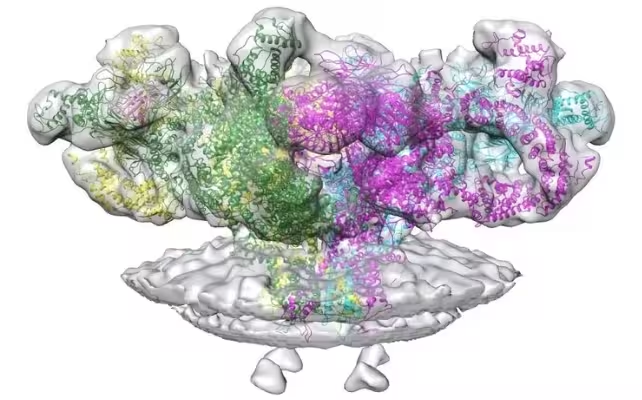
ساختار RyR1، کانال پروتئینی که اجازه نشت کلسیم به داخل عضلات را میدهد.
با استفاده از میکروسکپ الکترونی کرایو (cryo-EM) روی بافت موش، تیم پژوهشی مولکولهای استاتین را در حالت نشسته روی RyR1 و تغییر شکل آن ثبت کردند. کرایو-EM نمونهها را منجمد میکند و پراکندگی الکترون را نقشهبرداری میکند تا ساختارهای نزدیک به اتمی را نشان دهد؛ در این مطالعه نشان داده شد چگونه سیمواستاتین و ترکیبات مشابه میتوانند حالت باز کانال را پایدار کنند و اجازه دهند کلسیم به طور مداوم به داخل سلولهای عضلانی نشت کند.
خودِ نشت توضیحدهنده بسیاری از شکایات رایج است: درد مداوم عضله، حساسیت، گرفتگیها و احساس ضعف پایدار. اما در افرادی با برخی واریانتهای ژنتیکی RyR1، خطرات افزایش مییابد. آن افراد از قبل کانالهایی دارند که به باز شدن بیش از حد حساسند و میتوانند هنگام قرار گرفتن در معرض داروهای محرک، هیپرترمیا میلنگرانکننده (malignant hyperthermia) را تجربه کنند، یا ضعف دیافراگم را تجربه کنند که تنفس را تحتالشعاع قرار میدهد.
نتایج نادرتر و وخیمتر نیز وجود دارد. رابدومیولیز، وضعیتی که در آن فیبرهای عضلانی پاره میشوند و محتویات سمیشان به جریان خون وارد میشود، میتواند در پی آسیب شدید مرتبط با RyR1 رخ دهد و منجر به نارسایی کلیه شود. میوزیت نکروتیزان خودایمنی — حمله ایمنی که سلولهای عضلانی را میکشد — نیز ممکن است در معرض استاتین رخ دهد، اگرچه به نظر میرسد آن مکانیزم از نشت مستقیم از طریق RyR1 متمایز باشد.
پیامدها، درمانها و گامهای بعدی
این کشف هر مورد از علائم عضلانی مرتبط با استاتین (SAMS) را توضیح نمیدهد. اما مسیر قابل سنجش و قابل آزمونی را ارائه میدهد. برای پزشکان، یافته نشان میدهد که غربالگری ژنتیکی برای واریانتهای RyR1 و ارزیابی دقیقتر شکایات عضلانی میتواند به تمایز بین تحملناپذیری واقعی استاتین و دردهای نامرتبط کمک کند.
دو مسیر درمانی امیدبخش به نظر میرسند. یکی شیمی دارویی است: بازطراحی استاتینها بهگونهای که مهار هدفمند سنتز کلسترول در کبد را حفظ کنند اما تمایل اتصال به RyR1 را از دست بدهند. مسیر دیگر نجات دارویی کانال است. در موشهایی که نسبت به سیمواستاتین تحمل نداشتند، کلاس دارویی آزمایشی به نام Rycals رفتار بستهشدن کانال را بازگرداند و از ضعف عضلانی جلوگیری کرد.
از منظر بالینی، این دو رویکرد مکمل هم هستند: یکی خطر را در منبع کاهش میدهد (طراحی مجدد دارو)، و دیگری عارضه را در سطح مولکولی تصحیح میکند (بازگردانی عملکرد کانال). هر دو مسیر نیاز به مطالعات پیشبالینی و کارآزماییهای بالینی دقیق دارند تا ایمنی و اثربخشی مشخص شود؛ از جمله ارزیابی تداخل دارویی، دوز مناسب و پیامدهای طولانیمدت بر عملکرد عضلانی و قلبی.
برای بیماران و پزشکان، توصیههای عملی موقتی میتواند شامل موارد زیر باشد: ثبت دقیق زمان شروع علائم پس از شروع استاتین، اندازهگیری آنزیمهای عضلانی (مثل CK)، ارزیابی عملکرد تنفسی در موارد مشکوک و در نظر گرفتن تعویض نوع استاتین یا استفاده از جایگزینهای دارویی با مکانیسم متفاوت در صورت نیاز. همچنین آموزش بیمار درباره علائم هشداردهنده رابدومیولیز (ادرار تیره، ضعف شدید، درد غیرطبیعی) اهمیت دارد.
«من بیمارانی داشتهام که استاتین برایشان تجویز شده و بهخاطر عوارض جانبی از مصرف آن امتناع کردهاند،» میگوید اندرو مارکس، کاردیولوژیست کلمبیا و رهبر مطالعه. «این شایعترین دلیلی است که بیماران استاتین را کنار میگذارند، و مسئلهای واقعی است که به راهحل نیاز دارد.»
ملاحظات بهداشت عمومی نیز بزرگ است. حدوداً 40 میلیون بزرگسال در ایالات متحده استاتین مصرف میکنند. حتی اگر بخش کوچکی از این جمعیت دچار SAMS معنادار بالینی شوند، فرصتهای پیشگیری از سکتههای قلبی از دست میرود، در حالی که بیماران درد و ناتوانی قابل اجتنابی را تحمل میکنند.
از منظر سیاستگذاری سلامت، این یافته میتواند منجر به توصیههای هدایتشدهتر برای غربالگری ژنتیکی در گروههای پرخطر یا بهکارگیری پروتکلهای نظارتی قویتر در آغاز درمان با استاتین شود. تحلیل هزینه-فایده برای اجرای گستردهتر تستهای ژنتیکی و ارزیابیهای دورهای عضلانی باید در مطالعات سلامت جمعیت بررسی شود.
بینش تخصصی
«این کار به ما یک هدف قابل آزمون میدهد،» میگوید دکتر النا مورالس، فیزیولوژیست عضله در یک مرکز پزشکی بزرگ که در این مطالعه شرکت نداشت. «از منظر ترجمهای میتوانیم داروها را برای اتصال به RyR1 در مراحل اولیه غربال کنیم، و پزشکان هنگام بروز میوپاتی استاتینی میتوانند عملکرد RyR1 را مد نظر داشته باشند. این یک پل بین شیمی ساختاری و تصمیمگیری بالینی است.»
تحقیقات حاضر یک معمای دیرپا را به مکانیزمی ملموس تبدیل میکند. این مسیرها را برای درمانهای ایمنتر کلسترول و درمانهای هدفمند میگشاید که میتواند منافع استاتین را در دسترس بیمارانی قرار دهد که بیشترین نیاز را به آن دارند.
کدام مسیر را پزشکان و توسعهدهندگان دارو در پیش خواهند گرفت؟ زمان — و کارآزماییهای دقیق — پاسخ خواهد داد.
افزون بر این، پژوهش آینده میتواند به سؤالات عملیتری پاسخ دهد: چه فراوانی از بیماران دارای واریانتهای RyR1 هستند، آیا شباهتهای ساختاری بین گونههای مختلف استاتین و میزان نشت کلسیم وجود دارد، و آیا تستهای بیوشیمیایی ساده میتوانند پیشبینیکنندههای قابل اتکایی برای حساسیت به استاتین ارائه دهند؟
همچنین اهمیت دارد که رابطه بین استاتین و رخدادهای ایمنی مانند میوزیت نکروتیزان بهتر تعریف شود؛ اگرچه این پدیده ممکن است مسیر ایمنی مجزایی داشته باشد، فهم کامل آن برای مدیریت بیماران ضروری است. ترکیب دادههای ساختاری (مثل کرایو-EM)، دادههای ژنتیکی و مطالعات بالینی میتواند چارچوبی قوی برای توسعه راهنماییهای درمانی فراهم کند.
در نهایت، پیام برای بیماران روشن است: در حالی که استاتینها داروهایی موثر در پیشگیری از رویدادهای قلبی عروقی هستند، هرگونه علامت عضلانی جدید را باید جدی گرفت و با پزشک در میان گذاشت. تشخیص بهموقع و مدیریت مناسب میتواند از پیامدهای شدید جلوگیری کند و در عین حال مزایای محافظتی استاتینها را حفظ نماید.
منبع: sciencealert
نظرات
اتو_ر
یکم حس میکنم رسانه دارد موج میسازد، ولی کشف ساختاری مهمه؛ امیدوارم داروها سریع تر اصلاح بشن
پمپزون
خلاصه این، استاتینها مفیدن ولی باید مراقب باشن، غربالگری معقول به نظر میاد
آرمین
من یکی از آشناها بعد از شروع استاتین کلی درد داشت، دکتر گفت همینه اما حالا میخوام بدونم آیا تست ژنتیکی مفیده 😕
بایونیکس
این واقعاً شامل همه استاتینها میشه؟ یا فقط چند نمونه؟ تست ژنتیک رو باید رایج کنن؟
رودکس
وای، یعنی یه قرص میتونه هم جان نجات بده هم عضله بسوزونه؟ غیرقابل باوره...

ارسال نظر