8 دقیقه
آرتریت روماتوئید (RA) میتواند سالها پیش از نمایان شدن ورم دردناک مفاصل آغاز شود. پژوهشهای جدید نشان میدهد که تغییرات مشخصی در دستگاه ایمنی — که سالها پیش از سینویت بالینی در خون قابل شناسایی هستند — مرحلهای خاموش را نشان میدهند که در آن فعالیت خودایمنی بهتدریج تشدید میشود. شناسایی این بیومارکرهای زودهنگام میتواند دقت پیشبینی را بالا برد، امکان درمانهای زودهنگام را فراهم کند و از آسیب مفصلی پیشروندهای که آرتریت روماتوئید را تعیین میکند جلوگیری کند یا شدت آن را کاهش دهد.
زمینه: خودایمنی خاموش و ACPAها
آرتریت روماتوئید یک بیماری خودایمنی مزمن است که در آن سیستم ایمنی به بافتهای مفصلی حمله میکند و موجب التهاب پایدار، درد مداوم و تخریب ساختاری مفاصل میشود. التهاب قابل مشاهده بالینی در مفاصل را سینویت مینامند؛ اما شواهد نشان میدهد که فرایندهای مولکولی و سلولی که منجر به سینویت میشوند مدتها قبل از بروز علائم بالینی آغاز میشوند. یکی از شاخصهای شناختهشده این مرحلهی پیشبالینی، وجود آنتیبادیهایی به نام آنتیبادیهای ضد پروتئین سیترولینه شده (ACPAs) در سرم است. اگرچه مثبت بودن ACPA ریسک ابتلا به RA را افزایش میدهد، اکثر افراد ACPA-مثبت فوراً دچار بیماری فعال نمیشوند و مسیرهای بیولوژیک انتقال از خودایمنی خاموش به RA بالینی تا پیش از این مطالعه بهصورت دقیق مشخص نبود.
طراحی مطالعه و روشها
تیمی از محققان آمریکایی به سرپرستی پژوهشگرانی از Allen Institute for Immunology، دانشگاه کالیفرنیا سن دیگو و دانشگاه کلرادو آنشوتز، گروهی از افراد ACPA-مثبت را بهصورتی طولی دنبال کردند تا تغییرات سیستم ایمنی پیش از پیدایش RA را نقشهبرداری کنند. این همگروه شامل 45 نفر بود که بهدلیل وجود ACPA در خون در معرض خطر تلقی شدند؛ از میان این افراد، 16 نفر بعداً به RA بالینی تبدیل شدند. دادههای مربوط به افراد سالم به عنوان گروه کنترل برای مقایسه بهکار رفت. برای ساختن یک جدول زمانی از فعالسازی ایمنی در مرحله در معرض خطر، محققان از ترکیبی از پروتئومیکس خون (اندازهگیری گسترده پروتئینهای التهابی و پیامرسان)، پروفایلسازی سلولی جمعیتهای ایمنی و تحلیلهای عملکردی لنفوسیتهای B و T استفاده کردند. این رویکرد چندرشتهای امکان شناسایی ارتباط میان تغییرات مولکولی، تغییرات در جمعیتهای سلولی و علائم بالینی احتمالی را فراهم میآورد.
کشفهای کلیدی
نتایج مطالعه نشان داد که در میان شرکتکنندگان ACPA-مثبت، افزایش قابلتوجهی در پروتئینهای مرتبط با التهاب و فعالیت ایمنی نسبت به گروه کنترل وجود دارد. بهویژه پروتئینهایی که به مسیرهای ایمنی ذاتی (innate immunity) و اکتسابی (adaptive immunity) مرتبط هستند، فراوانتر و در وضعیت فعالتری مشاهده شدند. تحلیل عمیقتر لنفوسیتها نشان داد که هم سلولهای B (تولیدکننده آنتیبادی) و هم سلولهای T (هماهنگکننده پاسخ ایمنی و کمککننده به سلولهای B) تمایل دارند به یک وضعیت «آمادهباش» یا primed منتقل شوند؛ وضعیتی که آنها را مستعد پاسخ التهابی قویتر میکند. بهعلاوه، هرچه افراد به آستانه تشخیص RA نزدیکتر شدند، فراوانی زیرگروههایی از سلولهای T و B که گرایش به پاسخهای التهابی دارند افزایش یافت، حتی شامل زیرگروههایی از سلولهای T که معمولاً فنوتیپ کمالتهابی دارند و در شرایط طبیعی نقش تنظیمی ایفا میکنند.
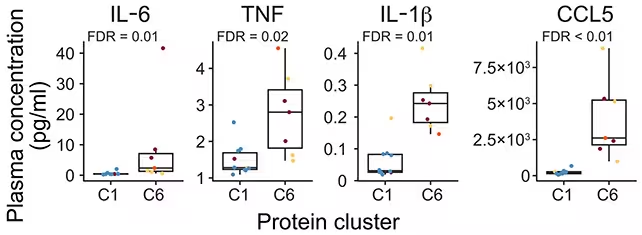
پروتئینهای التهابی در گروهی که عمدتاً شامل افراد در معرض خطر آرتریت (C6) بود، بیشتر یافت شدند. (He et al., Sci. Transl. Med., 2025)
اگرچه بین افرادی که به RA پیشرفت کردند و کسانی که پیشرفت نکردند همپوشانی وجود داشت، الگوی نوظهور نشان میدهد که مرحله در معرض خطر چگونه از منظر بیولوژیک به بیماری بالینی تبدیل میشود. نویسندگان این مطالعه اشاره میکنند که «نتایج ما از این مفهوم حمایت میکند که بیماری التهابی RA مدتها قبل از بروز سینویت فعال آغاز میشود، و این آغاز زودتر از آن است که در عمل بالینی عموماً تشخیص داده میشود.» این یافته نشان میدهد که پنجره پیشبالینی میتواند فرصتی برای مداخله داشته باشد، اما نیازمند تعریف بهتر بیومارکرها، معیارهای پیشبینی و طراحی مداخلات هدفمند و ایمن است.
پیامدها برای تشخیص و درمان
شناخت سیگنالهای ایمنی که نشاندهنده پیشرفت به RA هستند، چندین کاربرد عملی و پژوهشی ایجاد میکند. نخست اینکه پانلهای ترکیبی از پروتئینهای التهابی، نشانگرهای سلولی و آنتیبادیها میتوانند توانایی پیشبینی را در میان افراد ACPA-مثبت بهطور قابلتوجهی بهبود بخشند؛ به عبارت دیگر، ترکیب اطلاعات مولکولی و سلولی با وضعیت آنتیبادی میتواند حساسیت و خصوصیت پیشبینی بیماری را افزایش دهد. این پانلها ممکن است شامل اندازهگیریهای سیتوکینهایی مانند IL-6، TNF-α، یا نشانگرهای مرتبط با مسیر اینترفرون نوع اول و فاکتورهای فعالسازی لنفوسیتها باشند. دوم اینکه، مداخلاتی که در این پنجره پیشبالینی اجرا شوند ممکن است ظهور یا تشدید سینویت و آسیب ساختاری را متوقف یا به تعویق اندازند؛ برای مثال، داروی ایمنومدولاتور abatacept که هماکنون در برخی بیماران پرخطر برای به تعویق انداختن RA بهکار میرود، شواهدی از بازگرداندن برخی جنبههای فعالسازی ایمنی را نشان داده است و از این منظر میتواند بهعنوان الگویی برای درمانهای پیشگیرانه مورد توجه قرار گیرد.
علاوه بر این، تلفیق دادههای پروتئومیکس با پروفایلینگ سلولی و حتی تصویرنگاری حساس (مثل اولتراسوند مفصل که التهاب بالینی را زودتر مشخص میکند) میتواند مدلهای پیشبینی مبتنی بر یادگیری ماشین را تقویت کند. این مدلها میتوانند به پزشکان کمک کنند تا بیماران پرخطر را شناسایی کنند، تصمیمگیری درباره آغاز درمان پیشگیرانه را بهبود دهند و در نهایت هزینههای مراقبت سلامت را با هدف کاهش آسیب مفصلی و نیاز به درمانهای تهاجمیتر در مراحل بعدی کاهش دهند. با این حال، اجرای استراتژیهای غربالگری و درمان پیشگیرانه نیازمند ارزیابیهای هزینه-فایده، ملاحظات اخلاقی در مورد درمان افراد بدون بیماری فعلی و مطالعات طولی بزرگ برای تأیید اثرات بلندمدت است.
کوین دین (Kevin Deane)، روماتولوژیستی در CU Anschutz و از اعضای تیم تحقیق، در بخشی از یافتهها اشاره دارد که این نتایج «میتوانند پشتیبان مطالعات تکمیلی باشند … تا بهتر پیشبینی کنیم چه کسی به RA مبتلا خواهد شد، اهداف بیولوژیک بالقوه برای پیشگیری از RA را شناسایی کنیم و راههایی برای بهبود درمانها بیابیم.» این دیدگاه بر اهمیت پژوهشهای ترجمهای تأکید دارد؛ یعنی تبدیل یافتههای مولکولی و سلولی به ابزارهای تشخیصی و درمانی کاربردی که در مراقبت بالینی واقعی قابل استفاده باشند.
نتیجهگیری
این پژوهش مرحله پیشبالینی آرتریت روماتوئید را بهصورت مجموعهای از سیگنالهای قابل اندازهگیری توصیف میکند که با افزایش پروتئینهای التهابی و فعالتر شدن پیشرونده سلولهای B و T همراه است. هرچند تغییرات درمانی مبتنی بر این بیومارکرها به مطالعات بالینی گسترده و زمانبر نیاز دارند، شناسایی چنین سیگنالهای اولیهای مسیر را بهسمت رویکردهای پیشگیرانه و تهاجمی کمتر هموار میسازد. در عمل، ترکیب بیومارکرهای سرمی، سنجشهای عملکردی سلولی، تصویربرداری حساس و مدلهای پیشبینی میتواند به تدوین استراتژیهای شخصیسازیشده منجر شود که هدفشان کاهش درد، حفظ کارکرد مفصلی و جلوگیری از ناتوانی در درازمدت است.
برای پیشرفت این حوزه، لازم است که یافتهها در جمعیتهای متنوعتر بازتکرار شوند، پانلهای بیومارکری با معیارهای آزمایشگاهی استانداردسازی گردند و مطالعات تصادفیشده برای ارزیابی اثر پیشگیری با داروهای ایمن و هدفمند انجام شود. همچنین شناسایی ترکیبی از عوامل ژنتیکی، محیطی (مانند سیگار، عفونتها، یا میکروبیوم)، و تغییرات متابولیکی که میتوانند آغازگر یا تقویتکننده این فرایندهای ایمنی باشند، به درک بهتر مکانیسمها و کشف اهداف درمانی جدید کمک خواهد کرد. در مجموع، این مجموعه شواهد راه را برای گذار از تشخیص مبتنی بر علائم به تشخیص مبتنی بر ریسک مولکولی باز میکند — تغییری که میتواند کیفیت زندگی میلیونها نفر را تحت تأثیر قرار دهد.
منبع: sciencealert

ارسال نظر