9 دقیقه
پژوهشگران از طراحی یک پپتید مهندسیشده کوچک خبر میدهند که میتواند پروتئین مرتبط با بیماری پارکینسون، آلفا-سینوکلئین، را در ساختار طبیعی و عملکرد عادیاش ثابت نگه دارد. این پپتید از تغییر شکل نامناسب و تجمعهای سمی که تصور میشود به نورونها آسیب میزنند جلوگیری میکند. آزمایشها در یک مدل ساده کرمی انجام شد؛ مولکول موردنظر مقاوم در برابر تخریب داخل سلولی است و نقش فیزیولوژیک آلفا-سینوکلئین در انتقال عصبی را مختل نمیکند — رویکردی اولیه اما امیدبخش برای جلوگیری از تجمع پروتئینی پیش از تبدیل آن به فرم سمی.
یک پپتید کوچک که آلفا-سینوکلئین را تثبیت میکند
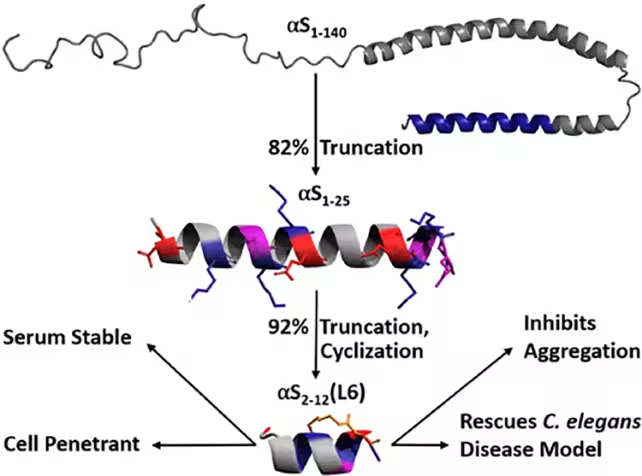
آلفا-سینوکلئین یک پروتئین کوتاه در نورونهاست که در تنظیم دوپامین و سایر ناقلهای عصبی نقش دارد. در بیماری پارکینسون و اختلالات مرتبط، این پروتئین ممکن است دچار اشتباهتاختگی (misfolding) شده و به صورت تجمعهای نامحلول درآید که با اختلال در ارتباطات عصبی و در نهایت مرگ سلولی همراه است. به جای تلاش برای حل کردن تودههای موجود، تیمی از دانشگاه Bath پپتیدی طراحی کردند که به آلفا-سینوکلئین میچسبد و کانفورماسیون سالم آن را تثبیت میکند — به عبارت دیگر آن را «قفل» میکند تا فرصت گرفتن شکل نادرست را از دست بدهد.
این رویکرد با یک قطعه بزرگتر از آلفا-سینوکلئین شروع شد که قبلاً نشان داده شده بود میتواند تجمع را کاهش دهد. محققان آن قطعه را به حداقل توالی فعال کوتاه کردند و با استفاده از پلهای لاکتام (lactam bridges) ساختار را شیمیایی تقویت نمودند؛ این حلقهها ساختار پپتید را قفل کرده و مقاومت آن را در برابر تجزیهی داخل سلولی افزایش میدهند. در مدلهای کرمی پارکینسون، این پپتید مهندسیشده از اشتباهتاختگی آلفا-سینوکلئین جلوگیری کرد، تجمعهای سمی را کاهش داد و همهی اینها بدون مشاهدهٔ سمیت قابلتوجه سلولی صورت گرفت.
برای درک بهتر اهمیت طراحی چنین پپتیدهایی لازم است به جزئیات ساختاری، تعاملات سطحی و پویاییهای مولکولی توجه کرد. انتخاب توالیهای کوتاه فعال، بهینهسازی ثبات ساختاری و ارزیابی قابلیت نفوذ داخل سلولی از جمله ملاحظات فنی کلیدی در روند توسعه هستند. استفاده از پیوندهای لاکتام نمونهای از تکنیکهای مهندسی شیمیایی است که میتواند نیمهعمر پپتید را در محیطهای بیولوژیک افزایش دهد و تعامل اختصاصی با سایتهای هدف روی پروتئین را تقویت کند؛ این موضوع برای دستیابی به «تثبیتکنندههای کانفورماسیونی» با قابلیت اجرای درمانی حیاتی است.
چرا جلوگیری از اشتباهتاختگی برای بیماری اهمیت دارد
میان درمانهایی که تجمعهای پروتئینی را حذف میکنند و آنهایی که سعی در پیشگیری از شکلگیری تجمع دارند تفاوت مهمی وجود دارد. تجمعها میتوانند نتیجهٔ فرآیندهای بیماریزا باشند یا خودِ عامل محرک پیشرفت بیماری باشند — تفکیک علت از معلول یکی از چالشهای اصلی پژوهش در نورودژنراسیون به شمار میرود. یک مولکول پیشگیرانه مانند پپتید مورد بررسی، هدفش مسدود کردن نخستین رخداد در آبشار تجمع است: همان اشتباهتاختگی اولیه که منجر به نُوکسازی و رشد فیبری میشود.
زاویهٔ پیشگیری برای افرادی که بهواسطهٔ غربالگری ژنتیکی یا نشانگرهای زیستی زودهنگام در معرض خطر بالاتر پارکینسون شناسایی شدهاند میتواند بهویژه مفید باشد. با حفظ آلفا-سینوکلئین در حالت عملکردی، سلولها تنظیم ناقلهای عصبی را حفظ میکنند و در عین حال از تجمع پیشروندهٔ تودههای سمی محفوظ میمانند. همانطور که تیم دانشگاه Bath اشاره کرده است، پپتید در سیستمهای زنده عملکرد دارد و نقشی در اختلال فعالیت طبیعی آلفا-سینوکلئین ندارد — نکتهای کلیدی برای هر درمانی که هدفش پروتئینی فراوان و معمولاً مفید است.
در سطح مفهومی، جلوگیری از نقطهٔ آغازین تجمع میتواند مزایای چندلایه فراهم کند: کاهش بار سمی سلولی، کاهش فعالسازی مسیرهای التهابی، و محافظت از سیناپسها و مدارهای عصبی بحرانی. از منظر زیستشناسی مولکولی، چنین رویکردی همچنین فرصت مطالعهٔ دقیقتری از روندهای کانفورماسیونی آلفا-سینوکلئین فراهم میآورد؛ شناسایی سایتهای اتصال کلیدی و نقشهبرداری از نقاط ضعف پروتئین میتواند راه را برای مولکولهای کوچک، آنتیبادیها یا پپتیدهای بیشتر باز کند.
این رویکرد پیشگیرانه میتواند بهعنوان بخشی از برنامههای جامع مدیریت ریسک برای افراد در معرض خطر عمل کند. ترکیب استراتژیهای پپتیدی با تشخیص بهموقع از طریق بایومارکرها، تصویربرداری مغزی یا آزمونهای ژنتیکی میتواند مداخلهٔ درمانی پیشگیرانه و سفارشیسازی شدهای را امکانپذیر سازد. در حالت ایدهآل، تثبیت کانفورماسیون بومی آلفا-سینوکلئین به معنای حفظ عملکرد نرمال ناقلهای عصبی مانند دوپامین و جلوگیری از دارماگزیستهای التهابی خواهد بود که در طول زمان به زوال نورونها منجر میشوند.
چالشهای دارورسانی، پیامدها و جهتهای آینده
با وجود نتایج دلگرمکننده در مدلهای کرمی، تبدیل یک پپتید پایدار داخلسلولی به یک درمان انسانی چالشهای متعددی دارد. پپتیدها میتوانند به سرعت از گردش خون حذف شوند، عبور از سد خونی-مغزی (blood–brain barrier) برایشان دشوار باشد و ممکن است تحت شناسایی ایمنی و پاکسازی قرار گیرند. کار انجامشده در Bath ثبات داخلسلولی را از طریق اصلاح شیمیایی هدف قرار داده است، اما رساندن ایمن و موثر مولکول به بافت مغزی انسان همچنان یک مسئلهٔ مهندسی و داروشناسی جدی است.
در سطح تکنیکی، چندین محور اصلی برای توسعهٔ بالینی وجود دارد:
- بهبود نیمهعمر پپتید در خون و مایعات بینبافتی از طریق اصلاحهای شیمیایی یا پوششدهی مولکولی؛
- طراحی حاملهایی که سد خونی-مغزی را بازتاب کنند یا از مسیرهای نقلوانتقال اختصاصی عبور کنند؛
- استفاده از نانوذرات یا حاملهای لیپیدی که به ورود هدفمند به نورونها کمک کنند؛
- کاهش ایمونوجنیسیته (واکنش ایمنی) با تغییر توالی یا استفاده از حاملهای بیوفیلمسلولپسند؛
- ارزیابی فارماکوکینتیک و فارماکودینامیک در مدلهای پستانداران قبل از طراحی کارآزمایی بالینی.
گزینههای دارورسانی شامل نانوتکنولوژی (نانوذرات لیپیدی، نانوذرات پلیمری)، اصلاح پپتیدی برای افزایش نفوذپذیری از طریق سد خونی-مغزی، یا استفاده از بردارهای ویروسی غیربازآفرین است که میتواند پپتید یا ژن کدکنندهٔ آن را به نورونها منتقل کند. هر یک از این روشها مزایا و معایب خود را از منظر ایمنی، هزینه و قابلیت تولید در مقیاس صنعتی دارند.
تیم پژوهشی و حامیان مالی تأکید میکنند که این مطالعه یک گام اولیه اما مهم است. جولیا دادلی از سازمان Alzheimer's Research UK، که از پژوهش حمایت مالی کرده است، به ارتباط وسیعتر این رویکرد اشاره کرد: فرآیندهای تجمع مشابه زیربنای دمانس با اجسام لوی (Lewy body dementia) و بیماری آلزایمر را تشکیل میدهند و تثبیت کانفورماسیونهای بومی پروتئین میتواند به یک استراتژی گستردهتر در اختلالات نورودژنراتیو تبدیل شود. این مطالعه در نشریه JACS Au (2025) منتشر شده و بر نقشهبرداری ساختاری قبلی از سایتهای تعامل آلفا-سینوکلئین بنا شده است.
از منظر ترجمهٔ بالینی، مسیر معمول شامل آزمایشهای تکمیلی در مدلهای پستانداران، ارزیابی ایمنی بلندمدت، تعیین دوز بهینه و درنهایت انجام کارآزماییهای بالینی مرحلهای است. در هر مرحله باید نشان داده شود که پپتید نه تنها تجمع را کاهش میدهد بلکه عملکرد عصبی را نیز حفظ کرده و بدون ایجاد اثرات جانبی مهم است. ارزیابیهای رفتاری، بیوشیمیایی و تصویربرداری در مدلهای حیوانی نقش مهمی در تصمیمگیری برای ورود به آزمایشهای انسانی خواهند داشت.
دیدگاه تخصصی
«طراحی پپتیدی که هم در داخل سلول پایدار باشد و هم برای فرمهای بیماریزا یک پروتئین اختصاصی عمل کند، یک عمل تعادلی دشوار است»، میگوید دکتر مارک الیسون، نوروشیمیدان و رابط علمی (شخصیت ساختگی). «این مطالعه مسیری مبتنی بر طراحی منطقی نشان میدهد که میتوان تجمع را کاهش داد بدون اینکه عملکرد طبیعی پروتئین را مختل کرد — دقیقاً همان سطح از اختصاصیسازی که برای پیشبرد از مدلهای آزمایشگاهی به آزمایشهای بالینی نیاز داریم.»
گامهای بعدی پژوهش شامل آزمایش در مدلهای پستانداران، بهینهسازی استراتژیهای دارورسانی (برای مثال حاملهای نانوذرهای یا پپتیدهای اصلاحشده که از سد خونی-مغزی عبور کنند) و ارزیابی ایمنی و اثربخشی در بلندمدت است. اگر این مراحل با موفقیت پیش بروند، پپتید یا مولکولهای مرتبط ممکن است بخشی از استراتژیهای پیشگیرانه برای افراد در معرض خطر بالا برای پارکینسون یا سایر اختلالات تجمع پروتئینی شوند.
در حال حاضر، این مطالعه یک اثبات امکانپذیری است: میتوان پپتیدهای کوچک را بهصورت منطقی طراحی کرد تا در سطح سلولی اقدام به گشتزنی (patrol) کرده و تجمع مضر پروتئینها را بلوکه کنند در حالی که زیستشناسی طبیعی حفظ میشود — الگویی امیدبخش برای رویکردهای جدید تغییردهندهٔ بیماری در نورودژنراسیون.
علاوه بر جنبههای فنی، پیامدهای اجتماعی و بالینی چنین پیشرفتهایی قابل توجه است. یک درمان پیشگیرانه موفق میتواند بار اقتصادی و اجتماعی ناشی از بیماریهای نورودژنراتیو را کاهش دهد، کیفیت زندگی بیماران و خانوادهها را بهبود بخشد، و پنلهای تشخیصی و ریسکسنجی را به سمت پیشبینی و پیشگیری هدایت کند. ترکیب پژوهش پایه، مهندسی دارویی و مطالعات بالینی یک رویکرد میانرشتهای لازم دارد تا ایدههایی مانند پپتید تثبیتکنندهٔ آلفا-سینوکلئین از آزمایشگاه به تخت بیمار منتقل شوند.
در نهایت، اگرچه چالشها و عدم قطعیتهای قابل توجهی باقی است، این کار نشان میدهد که هدفگیری کانفورماسیونی پروتئینها با مولکولهای کوچک یا پپتیدی میتواند یک مسیر مفید برای توسعهٔ درمانهای بیماریمحوری (disease-modifying) در اختلالات تجمع پروتئینی باشد. پژوهشهای آتی باید ضمن تمرکز بر رفع موانع دارورسانی، اثبات اثربخشی طولانیمدت و ایمنی را در سلسله مدلهای پیشبالینی و بالینی دنبال کنند.
منبع: sciencealert

ارسال نظر