7 دقیقه
پژوهشگران مسیر تازه و غافلگیرکنندهای برای ساخت سلولهای تولیدکنندهٔ انسولین یافتهاند: بازبرنامهریزی بافت معدهٔ انسان. با استفاده از ارگانوئیدهای معدهٔ کشتشده در آزمایشگاه و یک «کلید» ژنتیکی کنترلشدنی، دانشمندان سلولهای گاستریک را به سلولهایی شبیه به سلولهای بتا تبدیل کردند که قادر به ترشح انسولین و کمک به کنترل قند خون در موشهای دیابتی هستند. این روش میتواند به عنوان یک راهکار جایگزین در درمان دیابت نوع 1 و توسعهٔ درمانهای مبتنی بر سلول مطرح شود.
From stomach organoids to insulin factories
دیابت نوع 1 زمانی رخ میدهد که پانکراس سلولهای اختصاصی بتا که مسئول تولید انسولین هستند را از دست میدهد یا سیستم ایمنی آنها را تخریب میکند؛ در نتیجه بیماران وابسته به تزریقهای مادامالعمر انسولین و پایش مداوم قند خون میشوند. برای جایگزینی سلولهای بتا، محققان مسیرهای متعددی را بررسی کردهاند — از جزایر تولیدشده از سلولهای بنیادی تا پیوند بافت اهداکننده — اما هر رویکرد موانعی مانند رد ایمنی، کمبود بافت اهداکننده و پیچیدگی تولید و فرآوری را دارد که توسعهٔ بالینی را دشوار میسازد.
اکنون یک تیم بینالمللی به سرپرستی شیائوفنگ هوانگ (Weill Cornell Medicine، ایالات متحده) و چینگ شیائو (دانشگاه پکن، چین) جایگزین هوشمندانهای ارائه کردهاند: استفاده از سلولهایی که از پیش در بدن وجود دارند. بر پایهٔ آزمایشهای پیشین در موش، پژوهشگران مدلهای مینیاتوری معدهٔ انسان را که به ارگانوئید معده معروفاند در شرایط آزمایشگاهی پرورش دادند تا ویژگیهای کلیدی بافت گاستریک را بازآفرینی کنند. سپس مجموعهای از فاکتورهای ژنتیکی برنامهپذیر را وارد این ارگانوئیدها کردند — عملاً یک «کلید» ژنتیکی — که وقتی فعال میشود، میتواند این سلولهای معدهای را وادار سازد تا هویت شبه بتا پیدا کنند و برنامهٔ بیان ژنها و پروتئینهای مرتبط با تولید انسولین را فعال نمایند.
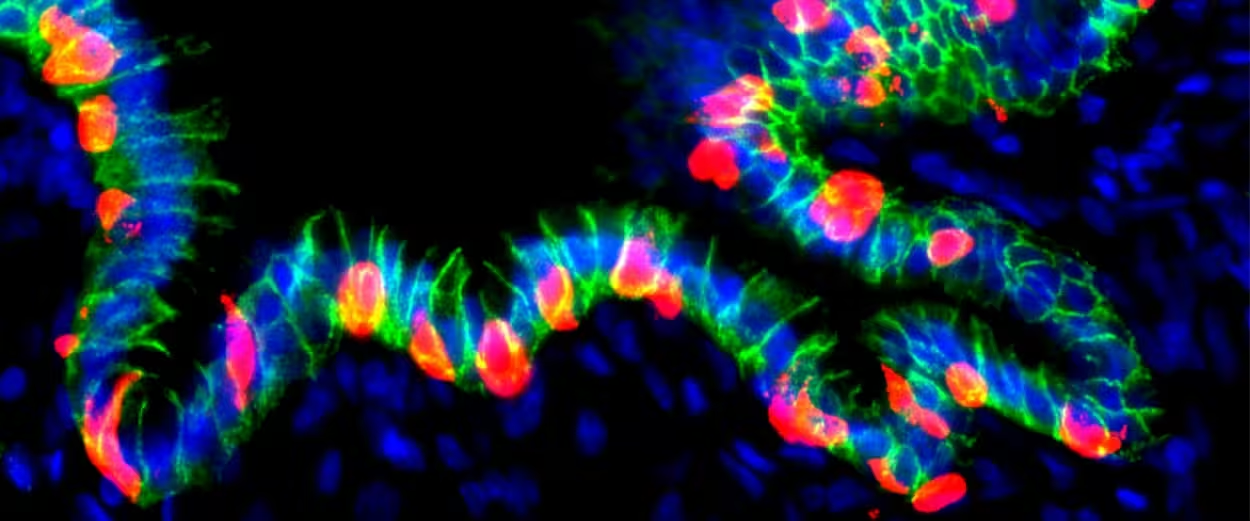
عضو پیوندی hGO-NPM تولیدکنندهٔ سلولهای انسولین+
How the reprogramming worked
- تیم، ارگانوئیدهای گاستریک انسانی را در شرایط آزمایشگاهی کشت داد تا منبعی قابل تجدید از سلولها فراهم شود؛ این ارگانوئیدها رفتارها و ساختارهای اپیتلیال معده را تقلید کرده و برای دستکاری ژنتیکی مناسب بودند.
- آنها این ارگانوئیدها را با یک برنامهٔ ژنتیکی کنترلشونده مهندسی کردند که مجموعهای از فاکتورها و فاسیلها را شامل میشد تا ژنها و پروتئینهای مشخص سلولهای بتا را فعال کند؛ این برنامه طوری طراحی شد که در حالت خاموش بیاثر باشد و تنها با تحریک مشخص فعال شود.
- پس از پیوند این ارگانوئیدهای مهندسیشده به حفرهٔ شکمی موشها، بافت پیوندی به رگهای خونی میزبان متصل شد و ماهها زنده ماند؛ این یک شاخص کلیدی برای پایداری عملکردی بافتهای تبدیلشده است.
- وقتی «کلید» ژنتیکی روشن شد، سلولهای مشتقشده از معدهٔ انسان تولید انسولین را آغاز کردند و نشانگرهای ژنتیکی و پروتئینی مشابه سلولهای بتا در پانکراس را از خود بروز دادند؛ همچنین پاسخهای تنظیمی به گلوکز در سطح مولکولی مشاهده شد.
Why this matters for Type 1 diabetes
در موشهای دیابتی، انسولین آزادشده توسط سلولهای معدهٔ تبدیلشده به تنظیم قند خون کمک کرده و علائم بیماری را بهبود بخشید — که این خود یک اثبات مفهوم مهم است. با توجه به اینکه دسترسی به بافت معده از طریق روشهای کمتهاجمی مانند اندوسکوپی امکانپذیر است، این روش امکان بازبرنامهریزی سلولهای خود بیمار را در محل (in situ) مطرح میکند؛ رویکردی که میتواند کمبود اهداکننده را از بین ببرد و خطر رد ایمنی را کاهش دهد، چرا که استفاده از سلولهای خودی معمولاً نیاز به سرکوب ایمنی طولانیمدت را کاهش میدهد.
البته موانع عمدهای هنوز باقی است. تیم نتایج را در نشریهٔ Stem Cell Reports (۶ نوامبر) گزارش کرده اما تأکید نمودهاند که پیش از شروع آزمایشهای بالینی روی انسان، باید ایمنی، دوام و عملکرد بلندمدت این روش اثبات شود. پرسشهای مهم شامل کنترل دقیق بازبرنامهریزی، جلوگیری از رفتارهای ناخواستهٔ سلولی (مانند رشد غیرقابلکنترل یا تبدیل به انواع سلولی نامطلوب) و تضمین آن است که سیستم ایمنی میزبان به سلولهای تازهتبدیلشده حمله نکند. علاوه بر این، سوالات مرتبط با میزان و نحوهٔ فعالسازی «کلید» ژنتیکی، پتانسیل جهش یا اثرات دگرگونکنندهٔ طولانیمدت و نحوهٔ همزیستی این بافتها با میکرومحیط میزبان از اهمیت بالایی برخوردارند.
What comes next: paths and challenges
کارهای آینده بر اصلاح «کلید» ژنتیکی، ارزیابی بقای بلندمدت و عملکرد و توسعهٔ استراتژیهایی برای محافظت از سلولهای تبدیلشده در برابر حملهٔ خودایمنی که مشخصهٔ دیابت نوع 1 است متمرکز خواهد بود. راهبردهای حفاظتی میتوانند شامل طراحی سیستمهای رهاسازی کنترلشده برای فعالسازی ژنها، استفاده از پوششهای ایمونولوژیک یا تکنیکهای کپسولهسازی سلول (encapsulation) و نیز همزمانی با درمانهای ایمنیتراپی برای کاهش پاسخهای خودایمنی باشند.
اگر این رویکرد در مراحل بالینی موفق شود، بازبرنامهریزی گاستریک میتواند به مجموعهٔ رویکردهای بازساختی دیگر — مانند جزایر مشتق از سلولهای بنیادی، فناوریهای کپسولهسازی و پیوندهای بهبود یافته — افزوده شود و مجموعهای از ابزارها برای بازگرداندن تولید فیزیولوژیک انسولین فراهم آورد. علاوه بر کاربرد مستقیم در درمان دیابت، این تحقیق نشاندهندهٔ یک تغییر پارادایمی در زیستدرمانی است: بازاستفاده و بازتعریف نقش بافتهای موجود در بدن به عنوان منابعی برای سلولدرمانی و بازسازی بافت با حداقل تهاجم و با استفاده از ظرفیتهای درونی بیمار.
در سطح فنیتر، مطالعه نشان میدهد که اپیژنتیک، مسیرهای سیگنالینگ سلولی و فاکتورهای رونویسی نقش کلیدی در تعیین سرنوشت سلولی دارند و با کنترل دقیق این مؤلفهها میتوان هویت سلولی را تغییر داد؛ این بینشها برای توسعهٔ روشهای بازبرنامهریزی دیگر در حوزههای درمانی گوناگون نیز اهمیت دارد. علاوه بر این، ایجاد ارگانوئیدهای انسانی واقعی که ساختار سهبعدی و تعاملات سلولی را حفظ میکنند، بستر مناسبی برای آزمون داروها، بررسی مکانیسمهای بیماری و شخصیسازی درمانها فراهم میآورد.
در مجموع، این مطالعه یک اثبات مفهوم جذاب ارائه میدهد: معده، که معمولاً نقش مستقیمی در کنترل قند خون ندارد، میتواند به منبعی برای تولید انسولین تبدیل شود. این تغییر دیدگاه، چشماندازهای جدیدی برای درمانهای سلولی دیابت باز میکند و نشان میدهد محققان با چه خلاقیتی به سراغ راهحلهای بیماریهای مزمن میروند. برای پیشبرد این رویکرد به سمت بالین، نیاز به تلاشهای چندرشتهای از جمله زیستشناسی سلولی، مهندسی زیستی، ایمونولوژی بالینی، توسعهٔ دارو و مقررات بالینی وجود دارد تا تضمین شود این فناوری ایمن، مؤثر و قابل تولید در مقیاس بالین است.
نکات کلیدی و کلمات کلیدی مرتبط که در متن به طور طبیعی گنجانده شدهاند شامل: بازبرنامهریزی معده، ارگانوئید معده، سلولهای بتا، تولید انسولین، درمان سلولی دیابت، دیابت نوع 1، ایمنی پیوند، کپسولهسازی سلولی، و کاربردهای بالینی بازساختی. این ترکیب از جزئیات فنی، پیامدهای بالینی و چالشهای توسعهای به خواننده تصویری جامع و قابل اتکا از اهمیت علمی و بالقوهٔ درمانی این پژوهش ارائه میدهد.
منبع: scitechdaily
نظرات
کوینکس
من تو آزمایشگاه یه چیز شبیه دیدم، ارگانوئیدها پتانسیل دارن، ولی مقابله با خودایمنی موضوعِ کلیدیه؛ باید ترکیبی کار کرد و محافظت ساخت.
نورتاب
زیاد هیجانزده نشیم، خیلی از مطالعات شبیه این نیمهراه میمونن، هزینه و ایمنی مهمتره، امید هست ولی واقعبین باشیم.
حمید
رویکرد جالب؛ بهخصوص ایده استفاده از بافت خودی. مسیر بالینی طولانیه اما ایدهاش منطقیه، باید صبر داشت و دقیق آزمود.
لابکور
این همه وعده، اما آیا میشه کلید ژنتیکی رو واقعاً کنترل کرد؟ خطر رشد غیرقابل کنترل و اثرات طولانیمدت جدیه. دادههای طولانیمدت کجان؟
دیتاویو
واو، فکرشم نمیکردم معده بشه کارخانهٔ انسولین! اگه واقعاً کار کنه تحولی بزرگه… ولی هیجان بدون دادهٔ بلندمدت نگرانکننده س.

ارسال نظر