10 دقیقه
تصور کنید یک پیچش عجیب در زیستشناسی سرطان: حیوانات بسیار پیر، نه بیشتر، بلکه کمتر دچار سرطان میشوند. پژوهشی تازه از دانشگاه استنفورد نشان میدهد که موشهای درسن پیشرفته تومورهای ریه کمتری تولید میکنند و اندازه تومورها در آنها کوچکتر است نسبت به حیوانات جوان که همان جهشهای سرطانزا را دارند. این نتایج فرضیه سادهای که میگوید خطر سرطان صرفاً با زمان و بدون توقف افزایش مییابد را به چالش میکشد و نشان میدهد تغییرات وابسته به سن ممکن است بهطور پارادوکسیال از شکلگیری تومور جلوگیری کنند.
محققان این مطالعه میگویند یافتهها به توضیح الگویی که مدتها در انسانها مشاهده شده کمک میکند: فراوانی سرطان تا سالمندی افزایش مییابد اما اغلب در افراد بسیار مسن کاهش یا تثبیت میشود. تیم استنفورد از موشهای دستورزیشده ژنتیکی و تجزیه و تحلیلهای مولکولی دقیق استفاده کرد تا بررسی کند کدام جنبههای پیری ممکن است رشد تومور را محدود کند و جهشهای مشخص چگونه در طول عمر رفتار متفاوتی نشان میدهند.
الگوی شگفتآور در موشهای پیر: تومورهای ریه کمتر و کوچکتر
گروه استنفورد تشکیل تومور را در دو گروه سنی از موشهای آزمایشگاهی مقایسه کردند: بزرگسالان «جوان» (چهار تا شش ماهه) و حیواناتی که به سن پیشرفته رسیده بودند (۲۰ تا ۲۱ ماهه، معادل تقریبی سالمندی بسیار بالا در انسان). برای القای سرطان ریه، پژوهشگران از یک سیستم هدفمند انتقال ژن از طریق استنشاق استفاده کردند که تومورهای برچسبخورده فلورسانس تولید میکند و امکان تصویربرداری و اندازهگیری دقیق را فراهم میسازد.
پس از ایجاد سرطان و گذشت ۱۵ هفته، تفاوت بسیار واضح بود. موشهای جوان تقریباً سه برابر بار توموری بیشتر، از نظر وزن ریه و سطح فلورسانس، داشتند و تعداد تومورهای جداگانه نیز در آنها حدود سه برابر بود. تومورها در حیوانات جوان بزرگتر و سریعتر رشد میکردند. بهاختصار، به هر معیار مورد استفاده، بیماری در موشهای جوان تهاجمیتر بود.
این نتایج بازتابی از مشاهدات اپیدمیولوژیک در انسان است: نرخهای سرطان تا میانسالی و سالمندی افزایشی هستند اما اغلب پس از حدود سن ۸۵ سال ثابت یا کاهش مییابند. تا پیش از این، دانشمندان درباره این کاهش در افراد بسیار مسن اختلاف نظر داشتند — آیا علت آن کمتر بودن غربالگری و کمتشخیصدادن است یا عوامل زیستی که از بروز تومور میکاهند؟ دادههای جدید موشها نشان میدهد یک اثر زیستی وابسته به سن وجود دارد که شروع و رشد تومور را سرکوب میکند.
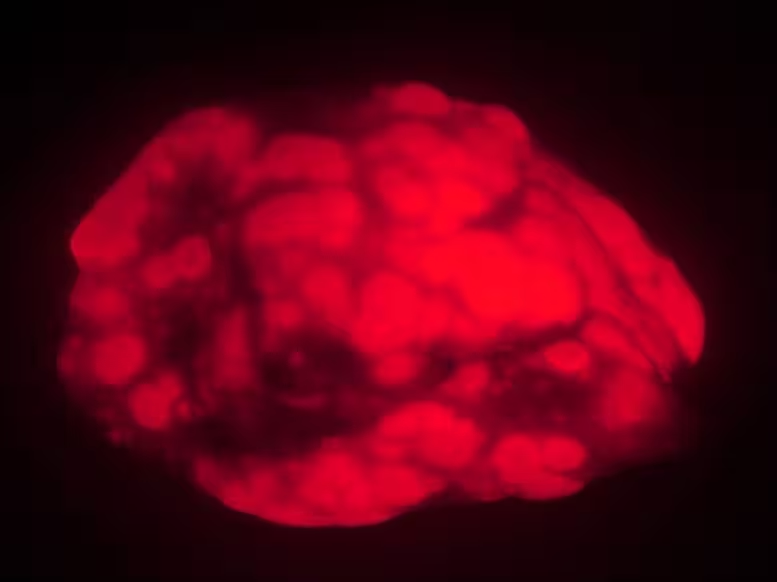
موشهای پیر در یک مدل سرطان، تومورهای ریه کمتری (قرمز) نسبت به حیوانات جوانتر نشان میدهند. این یافتهها پیشنهاد میکنند فرآیند پیری در حیوانات یا انسانهای بسیار مسن تشکیل سرطان را مهار میکند.
چه تغییراتی با سن میتواند مانع سرطان شود؟
در نگاه اول پیری به نظر میرسد که به نفع سرطان است: هر تقسیم سلولی خطر آسیب DNA را افزایش میدهد و بسیاری از نشانگرهای پیری—ناپایداری ژنومی، تغییر الگوهای متیلاسیون DNA و جابهجاییهای DNA میتوکندریایی—مانند زمینهای مساعد برای تبدیل بدخیم به نظر میرسند. در بخش زیادی از بزرگسالی، تجمع این آسیبها با افزایش شیوع سرطان همبستگی دارد.
با این حال تیم استنفورد استدلال میکند که برخی تغییرات مرتبط با سن ممکن است در واقع محیط را برای نئوپلازی خصمانه کنند. مطالعه بررسی کرد که غیر فعالسازی مجموعهای از ۲۵ ژن شناختهشدهٔ مهارکننده تومور چگونه تشکیل تومور را در موشهای جوان در مقایسه با پیر تحت تأثیر قرار میدهد. ژنهای مهارکننده تومور محصولات پروتئینی دارند که بهطور طبیعی رشد سلولی کنترلنشده را محدود میکنند؛ وقتی این ژنها از دست میروند یا غیرفعال میشوند، احتمال بروز سرطان افزایش مییابد.
گرچه خاموشکردن بسیاری از ژنهای مهارکننده تومور در هر دو گروه سنی باعث افزایش تومورها شد، اندازهٔ این اثر تقریباً همیشه در موشهای جوان بزرگتر بود. به عبارت دیگر، همان آسیب ژنتیکی در جوانی نتیجه بدتری داشت. یک ژن برجسته ظاهر شد: PTEN. غیر فعالسازی PTEN تأثیر تقویتکننده تومور را در حیوانات جوان بسیار قویتر نشان داد نسبت به حیوانات پیر، که نشان میدهد زمینهٔ زیستی بافتهای مسن نحوهٔ عملکرد یک مسیر عمدهٔ سرطانی را تغییر میدهد.
برای کاوش مکانیزمها، پژوهشگران الگوهای بیان ژنی را در سلولهای سرطانی از موشهای پیر و جوان و از تومورهایی با PTEN فعال یا غیرفعال توالییابی کردند. بهطور غیرمنتظره، حتی سلولهای سرطانی با تقسیم سریع که از حیوانات پیر جدا شده بودند، علائم مولکولی مرتبط با پیری را حفظ کردند. این الگوهای رونویسی مرتبط با پیری هنگامی که PTEN غیرفعال شد کاهش یافت، و سلولهای سرطانی فاقد PTEN در موشهای پیر شباهت به نمایه بیان ژن تومورهای جوان پیدا کردند — نشانهای جالب از این که برخی ویژگیهای پیری ممکن است وقتی مسیرهای کلیدی مخدوش میشوند پاک شوند.
یادداشتی کوتاه دربارهٔ زمینهٔ فنی
این مطالعه از برچسبگذاری فلورسانس برای کمیسازی بار تومور، ابزارهای کنترلشدهٔ غیرفعالسازی ژن برای آزمودن اثر مهارکنندههای تومور و پروفایلینگ RNA برای بررسی پایداری نشانگرهای پیری در سلولهای تغییرشکلیافته استفاده کرد. طراحی تجربی زمانبر بود — پژوهشگران تقریباً دو سال منتظر ماندند تا موشها به سن پیشرفته برسند، که نشان میدهد چرا اثرات پیری بهسختی در آزمایشها مطالعه میشود.
از نظر فنی، استفاده از مدلهای موشی دستورزیشده به پژوهشگران امکان داد تا بهصورت کنترلشده به سوالاتِ علت و معلولی نزدیک شوند؛ مثلاً اینکه آیا غیرفعالسازی یک ژن مهارکننده تومور دقیقاً باعث تفاوت در نرخهای آغاز تومور یا رشد تومور میشود یا خیر. ترکیب تصویربرداری فلورسانس با توالییابی RNA تکسلولی و آنالیزهای مسیر سیگنالینگ، اطلاعات مولکولی و فنوتیپی را با هم پیوند زد تا چشمانداز جامعی از تغییرات وابسته به سن ارائه کند.
چرا این یافتهها برای پژوهش و درمان سرطان اهمیت دارد
برداشتهای عملی از این مطالعه قابل توجه است. اولا، مدلهای سرطان معمولاً بر پایهٔ موشهای بالغ جوان هستند و ممکن است زیستشناسی وابسته به سن را بهدرستی بازتاب ندهند. این میتواند آزمونهای پیشبالینی داروهای هدفمند را تحریف کند؛ داروهایی که در تِکان بافتهای جوان موثر بهنظر میرسند ممکن است در بافتهای پیر که چشمانداز مولکولی متفاوت است، عملکرد متفاوتی داشته باشند.
دوما، مطالعه نشان میدهد پیری لزوماً بهطور کلی تومورزا نیست. برخی جنبههای میکرو محیط پیر یا تغییرات درونسلولی ممکن است مانع شروع تومور شوند یا پیشرفت آن را کند کنند. درک این مکانیسمهای محافظتی میتواند استراتژیهای درمانی جدیدی را آشکار کند: اگر پیری بافت را طوری بازسیمکشی میکند که در برابر سرطان مقاومت نشان دهد، آیا میتوان آن بازسیمکشی را بهصورت درمانی تقلید کرد؟
سوما، اثر متفاوت غیرفعالسازی PTEN هشداری است که جهشهای محرک مشخص و درمانهای هدفمند مرتبط با آنها ممکن است بهصورت وابسته به سن عمل کنند. انکولوژی دقیق اغلب داروها را با پروفایلهای جهشی مطابقت میدهد؛ اما زمینهٔ وابسته به سن میتواند قدرت آن جهشها و در نتیجه اثربخشی درمانها را تعدیل کند. این موضوع پیامدهای مستقیم برای طراحی کارآزماییهای بالینی دارد، بهویژه اگر جمعیتهای مسنتر در آزمونها بهدرستی نمایندگی نشده باشند.
مونته وینسلو، دانشیار ژنتیک و آسیبشناسی و نویسندهٔ ارشد مقاله، میگوید این نتایج نیاز به بازنگری در انتخاب مدلها برای تحقیقات ترجمهای را نشان میدهد. دیمیتری پتروف، نویسندهٔ همکار ارشد، یافته را بهصورت گستردهتری فُرِیمبندی میکند: پیری ممکن است فوایدی کمتر شناختهشده داشته باشد که دانشمندان میتوانند آنها را فراگیرند.
دیدگاه کارشناسی
دکتر لنا مورالس، پژوهشگر فرضی در زمینهٔ علوم پیری (University Center for Aging Biology)، چنین اظهار میکند: «این دادهها تأکید میکنند که پیری یک نزول خطی واحد نیست. برخی مسیرهای سلولی که با سن تغییر میکنند ممکن است میکرومحیطهایی ایجاد کنند که برای آغاز تومور نامساعدتر باشند. این بدان معنا نیست که پیری بهطور کلی محافظتی است — بزرگسالان مسنتر با ضعف و بیماریهای دیگر روبهرو هستند — اما راه جدیدی از پرسشها را باز میکند: کدام ویژگیهای محافظتی بافتهای مسن قابل جداسازی و بهکارگیری درمانی هستند؟»
دیدگاه او یک چالش تحقیقاتی کلیدی را برجسته میکند: جدا کردن تغییرات مفید از مضر مرتبط با سن و سپس تعیین اینکه کدامیک ایمنِ نسخهبرداریِ دارویی هستند. این روند مستلزم مطالعات بینرشتهای است که بیولوژی مولکولی، ایمنیشناسی، اپیدمیولوژی و مدلسازی بالینی را ترکیب کند.
پیامدهای گستردهتر و گامهای بعدی
- توسعهٔ مدل: آزمایشگاهها باید حیوانات مسن را در خطوط پیشبالینی وارد کنند تا اثرات وابسته به سن روی زیستشناسی تومور و پاسخ به درمان را ثبت کنند. این امر به طراحی بهتر داروها و آزمایشهای بالینی منجر میشود.
- کار مکانیکی: پژوهشگران باید مشخص کنند کدام نشانگرهای پیری—نشانههای اپیژنتیک، تغییرات متابولیک، بازسازی ایمنی—رانندهٔ سرکوب تومور در بافتهای پیر هستند. این مطالعات میتوانند از فناوریهایی مانند توالییابی تکسلولی، کروماتینریمپینگ و متابولومیکس بهره ببرند.
- ترجمهٔ بالینی: اگر مکانیسمهای محافظتی وابسته به سن تایید شوند، میتوانند مبنای توسعهٔ داروهایی قرار گیرند که آن حالات را در بیماران جوانتر تقلید کنند یا درمانها را در بیماران مسن تقویت کنند بهگونهای که تفاوتهای فیزیولوژیک را در نظر گیرد.
این مطالعه که به رهبری نویسندهٔ اول امیلی شولدینر منتشر شد و در تاریخ ۴ نوامبر در مجلهٔ Nature Aging منتشر گردید، نمایانگر یکی از اولین نمایشهای کنترلشدهای است که نشان میدهد پیری میتواند بهطور فعال آغاز و رشد تومور را در یک مدل پستانداران مهار کند. همچنین نشان میدهد که نشانگرهای مولکولی وابسته به سن میتوانند درون سلولهای سرطانی تقسیمشونده حفظ شوند و این موضوع فرضیات مربوط به اینکه «سلولهای سرطانی جوان» باید چگونه در سطح رونویسی بهنظر برسند را پیچیده میکند.
در مجموع، این کار چارچوب نگاه به پیری در پژوهش سرطان را بازتنظیم میکند: بهجای اینکه سن را تنها بهعنوان تجمیع آسیب ببینیم، دانشمندان باید آن را یک تغییر سیستمیک پیچیده در نظر بگیرند که گاهی محدودیتهای جدیدی بر سلولهای بدخیم وضع میکند. دنبال کردن این ریشهها میتواند استراتژیهای جدیدی برای پیشگیری و درمان آشکار سازد که با زیستشناسی گروههای سنی مختلف همراستا باشد.
نکتهٔ تکمیلی: برای اعتبار نتایج و کاربرد بالینی، لازم است یافتهها در مدلهای متفاوت تکرار شوند و دادههای جمعیتی انسانی با کنترل دقیق سن و غربالگری تحلیل گردد تا مشخص شود کدام مشاهدات قابل انتقال به مراقبت بالینی هستند. همچنین توجه به نقش سیستم ایمنی، فیبروبلاستها، تغییرات میکروبیوم و وضعیت متابولیک کلی بدن در بافتهای پیر، برای تکمیل تصویر اهمیت دارد.
منبع: scitechdaily
نظرات
ماکس_ای
جالب اما نگرانم که نتایج تو مدلهای دیگه تکرار نشن، مخصوصا وقتی PTEN انقدر وضعیت بافت رو عوض میکنه. باید ببینیم انسانی هم همینه
آرمین
حسی دارم که داره روش مانور زیادی داده میشه، لازمِ دادهٔ جمعیتی و مدلی از انسان باشه تا بتونیم مطمئن بشیم؛ تبلیغی نشه
شهرلاین
نقطه نظر جالبیه، یه یادآوری که پیری فقط جمع آسیب نیست و میتونه ترکیباتی ایجاد کنه که ضد توموره، نیاز به بررسی بیشتر
لابکور
تو آزمایشگاه مون هم الگوهایی شبیه دیدم، اما مکانیسمها روشن نیست؛ باید single-cell و ایمونولوژی رو وارد کنیم، عجله نکنیم
توربو
این واقعا توی آدمها هم صادق هست؟ یا فقط تو مدل موشیه؟ کمتشخیص و مرگومیر هم بازی میکنه یا نه؟
کوینهاب
تا حدودی منطقیه، ولی باید با دادههای انسانی و کنترل غربالگری اثبات بشه، عجولانه نمیشه نتیجه گرفت
رودایکس
وای، حیرت انگیزه! یعنی پیری هم میتونه تا حدی جلوی سرطان رو بگیره؟ چقدر پیچیده... مشتاق تکرارهای بعدی ام

ارسال نظر