8 دقیقه
کشف مهم: آنزیمی که شکستن فاجعهآمیز DNA در سرطان را شعلهور میکند
پژوهشگران دانشگاه کالیفرنیا در سندیگو آنزیمی را شناسایی کردهاند که آغازگر «کروموتریپسیس» است — رویدادی فاجعهبار که طی آن یک کروموزوم به قطعات متعدد شکسته و بهطور تصادفی و مخرب بازسازی میشود. این نوع آشفتگی ژنومی باعث تکامل سریع تومورها، تقویت مقاومت دارویی و توضیحدهنده رفتار برخی سرطانها مانند ماشینهایی با عملکرد بسیار بالا و فراتر از حد طراحیشده است. یافتهها بینش جدیدی در مورد مکانیسمهای ناپایداری ژنی، جهشهای گسترده و تولید DNA خارجکروموزومی (ecDNA) ارائه میدهند که برای متخصصان آنکولوژی و محققان ژنومیک اهمیت بالایی دارد.
آنچه تیم پژوهشی یافت
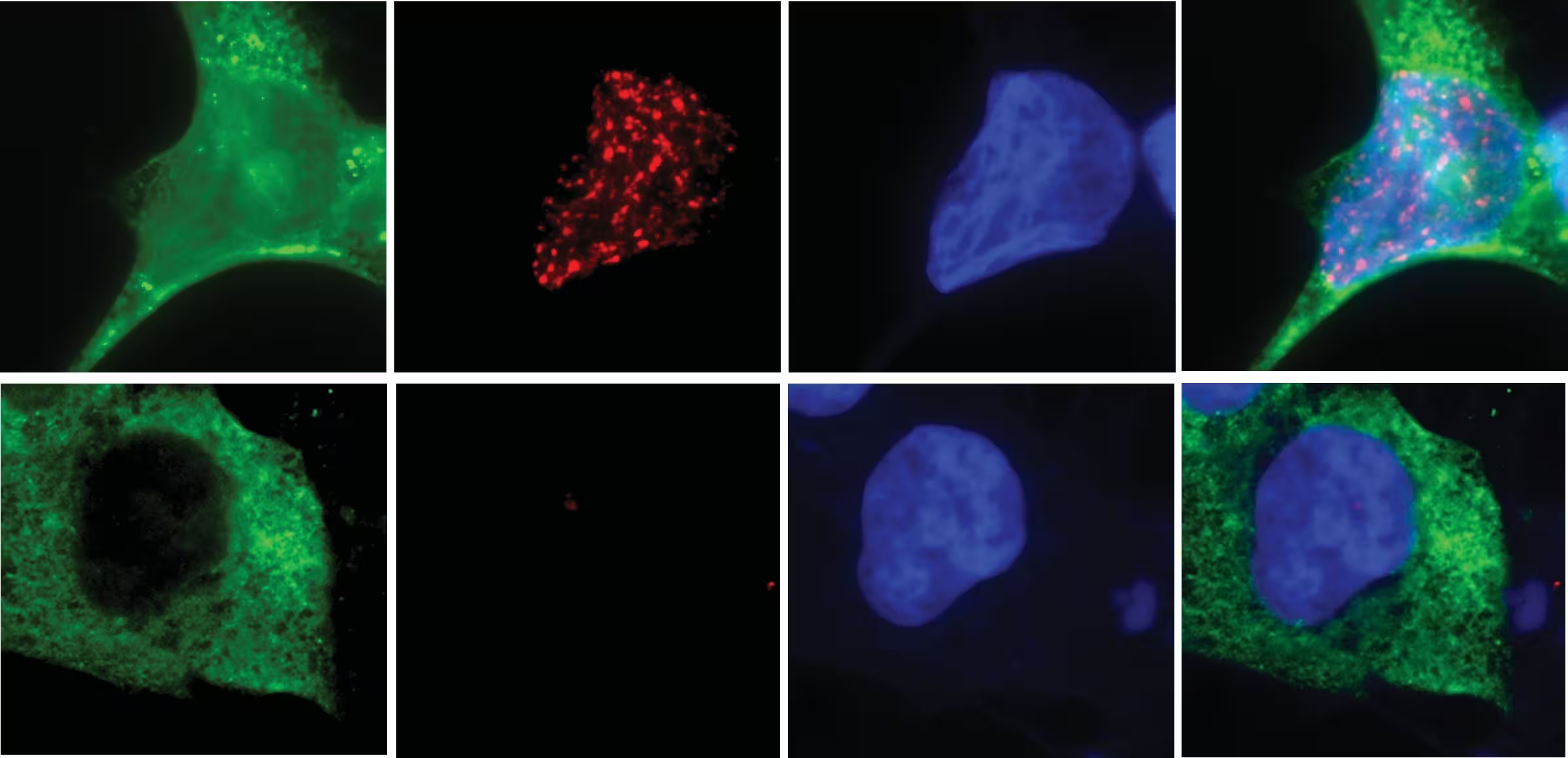
با استفاده از تصویربرداری سلولهای زنده و یک غربال سیستماتیک از نوکلئازهای شناختهشده و پیشبینیشده انسانی، گروه UC San Diego مولکولی به نام N4BP2 را بهعنوان آغازگر مولکولی معرفی کرد که قادر است وارد میکرونوکلئوسهای آسیبپذیر شود و DNA را به قطعات خرد کند. حذف N4BP2 از سلولهای سرطانی بهطور چشمگیری میزان خردشدگی کروموزومی را کاهش میدهد. در مقابل، وارد کردن اجباری این آنزیم به هستههای سالم موجب شکستهای گسترده DNA حتی در سلولهای غیرسرطانی میشود. این نتایج که در نشریه Science منتشر شدهاند، معمایی چندساله در ژنومیک سرطان را روشن میکنند و مسیرهایی برای پژوهشهای درمانی و تشخیصی جدید باز مینمایند.
چرا کروموتریپسیس اهمیت دارد
کروموتریپسیس با انباشت تدریجی جهشها که معمولاً در ذهن عامه شکل میگیرد فرق دارد. در این پدیده، دهها یا صدها بازآرایی میتواند در یک واقعه واحد شکل بگیرد و سرعت کسب ویژگیهای تهاجمی توسط تومور را بهطور چشمگیری افزایش دهد. محققان برآورد میکنند حدود یکچهارم از سرطانهای انسانی نشانههای مولکولی کروموتریپسیس را دارند، و شیوع آن در انواعی مانند استئوسارکوم و بسیاری از تومورهای مغزی بهویژه بالاست.
میتوان آن را شبیه تصادف سنگین یک خودرو تصور کرد: شاسی شکسته، قطعات جانبی با هم قاطی میشوند و عملکرد و کنترل خودرو غیرقابلپیشبینی میشود. در تومورها، کروموتریپسیس میتواند منجر به تولید DNA خارجکروموزومی (ecDNA) شود — قطعات دایرهشکل حامل ژن که آنکوژنها را تقویت میکنند و مقاومت در برابر درمان را تشدید مینمایند. ایجاد ecDNA میتواند افزایش نسخههای ژنهای محرک سرطان را موجب شود، که در نهایت پاسخدهی به داروها را کاهش میدهد و پیشآگهی را بدتر میسازد.
چگونه N4BP2 واکنش زنجیرهای را آغاز میکند
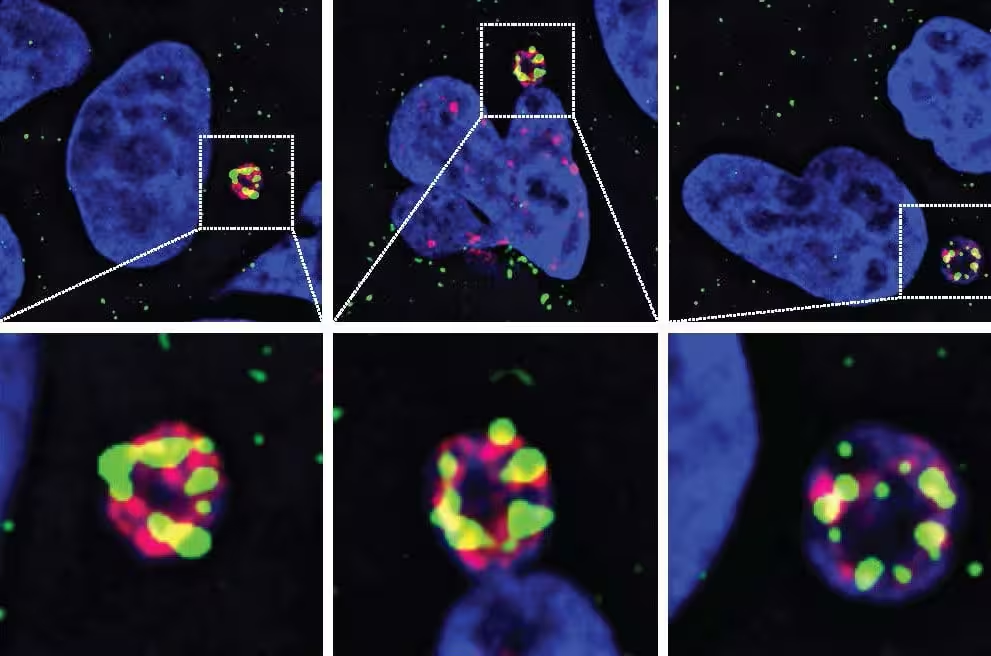
خطاها در هنگام تقسیم سلولی گاهی یک کروموزوم کامل را داخل یک میکرونوکلئوس کوچک و ناپایدار محبوس میکنند. وقتی میکرونوکلئوس پاره میشود، آن کروموزوم محبوس در معرض نوکلئازها قرار میگیرد. اگرچه نوکلئازهای زیادی در سلول وجود دارند، تیم UC San Diego نشان داده است که N4BP2 توانایی منحصربهفردی دارد تا وارد میکرونوکلئوسها شود و قطعهقطعه شدن DNA را کاتالیز کند و عملاً جرقه کروموتریپسیس را روشن سازد.
مشاهدات کلیدی تجربی شامل موارد زیر است:
- غربالهای مبتنی بر تصویربرداری نشان دادند N4BP2 در میکرونوکلئوسهایی تجمع مییابد که در آنها آسیب DNA انباشته شده است؛ این همبستگی مکانی قوی بین آنزیم و نقاط آغاز شکستهای کروموزومی فراهم میکند.
- حذف ژنتیکی N4BP2 در سلولهای تومور مغزی بهطور قابلتوجهی خردشدگی کروموزومی را کاهش داد؛ این دادهها نقش ضروری آنزیم را در وقوع کروموتریپسیس پشتیبانی میکنند.
- هدایت مصنوعی N4BP2 به داخل هستههای سالم باعث تولید شکستهای DNA شد و نشان داد که این پروتئین بهتنهایی برای شروع شکستن گسترده کافی است، نه صرفاً تنها یک نشانگر همراه با آسیبهای دیگر.
«این آنزیم جرقهٔ گمشده است — وقتی آن را دیدید، مکانیزم کروموتریپسیس قابلعمل میشود»، گفت دون کلیولند، دکترای تخصصی، نویسنده ارشد این مطالعه.
پیامدهای بالینی: هدف جدید برای تومورهای تهاجمی و مقاوم به درمان
آنالیز بیش از 10,000 ژنوم سرطانی ارتباط بین بیان بالای N4BP2 و افزایش میزان کروموتریپسیس، بازآراییهای ساختاری و افزایش سطح ecDNA را نشان داد. تومورهایی که دارای ecDNA فراوان هستند از مقاومترینها در برابر درمان بهشمار میروند و این مطالعه ecDNA را بهعنوان یک پیامد ثانویه از پدیده وسیعتر کروموتریپسیس بازتعریف میکند. با قرار دادن N4BP2 در آغاز این آبشار مولکولی، پژوهشگران یک نقطۀ مداخله بالقوه برای کاهش ناپایداری ژنومی و کندسازی سازگاری تومور پیدا کردهاند.
مسیرهای ترجمهای بالقوه عبارتاند از:
- مولکولهای کوچک یا بیولوژیکهایی که فعالیت N4BP2 یا مکانیابی آن به میکرونوکلئوس را مهار میکنند — این مداخلهها میتوانند از وقوع کروموتریپسیس جلوگیری نمایند یا آن را کاهش دهند.
- آزمایشهای تشخیصی برای اندازهگیری سطح N4BP2 بهعنوان یک نشانگر زیستی برای تومورهای مستعد کروموتریپسیس — این بیومارکر میتواند در تصمیمگیری درمانی و اولویتبندی بیماران کمک کند.
- استراتژیهای ترکیبی که مهار N4BP2 را با درمانهای موجود تلفیق میکنند تا از ظهور سریع کلونهای مقاوم جلوگیری شود؛ این رویکرد میتواند پایداری پاسخ درمانی را افزایش دهد.
از آزمایشگاه تا جاده: تشبیهات خودرویی و دیدگاه عملی
علاقهمندان به اتومبیل اغلب یک خودرو را بر اساس موتور، شاسی و سیستمهای تشخیصی آن ارزیابی میکنند — همین نگاه کمک میکند تا رفتار تومور نیز بهتر قابل درک شود. N4BP2 مانند یک واحد کنترل موتور (ECU) معیوب عمل میکند که یک آبشار خطا را راهاندازی میکند، بهطوری که مؤلفههای حیاتی همزمان دچار مشکل میشوند بهجای اینکه یکییکی از کار بیفتند. همانطور که سازندگان خودرو از تشخیصهای درونسیستمی برای شناسایی و جداسازی خطاها استفاده میکنند، آنکولوژی اکنون میتواند یک خوانش مولکولی برای شناسایی سرطانهایی که آماده وقوع «فاجعههای ژنومی» هستند، در اختیار داشته باشد.
برای خوانندگانی که روندهای خودرویی را دنبال میکنند، این کشف شبیه آن است که یک حسگر تشخیصی جدید بتواند استراتژیهای نگهداری را متحول کند: تشخیص زودهنگام خطا از فروپاشی کلی جلوگیری میکند. در حوزه درمان سرطان، هدفگیری N4BP2 میتواند احتمال اینکه تومور ناگهان خود را بهشکل تهاجمیتر و مقاومتر بازچینش کند، کاهش دهد — مشابه جلوگیری از خرابی فاجعهآمیز موتور که شما را در جاده رها میکند.
تأثیر بر صنعت و پژوهش
فراتر از جذابیت آزمایشگاهی، این یافته پیامدهایی برای توسعه بالینی و نحوه اولویتبندی اهداف پژوهشی دارد. ecDNA — که اکنون از طریق N4BP2 به کروموتریپسیس مرتبط شده است — به تمرکز رو به رشد در پژوهش سرطان تبدیل شده و توجه منابع مالی و سازمانهای تأمین بودجه را جلب میکند. محدود کردن منشاء تشکیل ecDNA میتواند تقاضای بازار برای تشخیصها و درمانهای هدفمند علیه سرطانهای سختدرمان مانند گلیوبلاستوما و استئوسارکوم را تغییر دهد.
برای سرمایهگذاران زیستفناوری و استراتژیستهای دارویی، این کشف یک پروفایل هدف روشنتر فراهم میکند: آنزیمی که بهتنهایی قادر است رخدادهای ژنومی فاجعهبار را ایجاد کند و در هزاران ژنوم توموری قابلاندازهگیری است. این شفافیت در هدفپژوهی میتواند مراحل طراحی دارو، تحلیل ریسک-بازده و انتخاب مدلهای پیشبالینی را تسهیل نماید.
خلاصهٔ نکات برای عموم و علاقهمندان خودرو
- N4BP2 آنزیمی است که میتواند کروموتریپسیس را شعلهور کند؛ این شکلی سریع و فاجعهآمیز از بازآرایی ژنومی است.
- تومورهایی با بیان بالای N4BP2 نشاندهنده کروموتریپسیس و افزایش ecDNA هستند که با مقاومت درمانی مرتبطاند.
- درمانها یا آزمایشهای تشخیصی هدفگیرنده N4BP2 میتوانند به تثبیت ژنوم تومورها کمک کنند — درست مانند نگهداری پیشگیرانه که از فروپاشی مکانیکی گسترده جلوگیری مینماید.
همانند هر کشف عمدهٔ دیگری، تبدیل این دانش به درمانهای ایمن و مؤثر زمانبر خواهد بود. با این حال، شناسایی «جرقه» مولکولی نحوهٔ تفکر دانشمندان دربارهٔ ناپایداری ژنومی را تغییر میدهد و یک نقطهٔ شروع مشخص برای استراتژیهای ضدسرطان جدید فراهم میآورد. کارهای بعدی باید شامل بررسی عملکرد N4BP2 در انواع گستردهتری از بافتها، تطبیق مدلهای حیوانی و توسعه مهارکنندههای اختصاصی باشد.
برای طرفداران خودرو که دقت مهندسی را میستایند: تصور کنید آیندهای وجود داشته باشد که پزشکان بتوانند قطعهای را تشخیص دهند و خنثی کنند که باعث خرابی فاجعهآمیز میشود. این وعدهای است که یافتههای UC San Diego برای مبارزه با تهاجمیترین سرطانها به ارمغان میآورد، و میتواند پایهای برای ابزارهای تشخیصی مولکولی و درمانهای هدفمند فراهم کند.
منبع: scitechdaily
نظرات
سریعرو
خلاصه اینکه شناسایی 'جرقه' مهمه، اما سوال من اینه؛ آیا مهار این آنزیم عوارض جانبی نخواهد داشت؟ فکر میکنم ترکیب درمانی لازم باشه
رضا
کمی به نظر اغراقآمیز میاد، مهمه ولی ترجمه به درمان عملی زمان و ریسک داره. امیدوارم نتایج مستقل هم تایید کنن، نه فقط یک مقاله.
توربو
مثل یه ECU معیوب؛ منطقیه، هدفگیری N4BP2 میتونه جلوی خرابکاریهای ناگهانی رو بگیره، اما دارو دادن این موضوع کار سادهای نیست.
بیونیکس
واقعاً N4BP2 خودش این همه مسئولیت رو داره؟ شواهد تصویری جالبه ولی چرا فقط بعضی تومورها؟ باید توی مدلهای حیوانی و مجموعههای مستقل تکرار بشه، نه؟
روداکس
واااای! یه آنزیم تونسته کروموتریپسیس رو راه بندازه؟ یعنی تومور میتونه یک شبه وحشی بشه... ترسناک و هیجانانگیز، ولی کلی کار مونده


ارسال نظر