8 دقیقه
پژوهشگران در ژاپن گزارش دادهاند که افزایش سطح یک پروتئین میتوکندریایی به نام COX7RP توان تولید انرژی در سلولها را بهبود میبخشد، نشانههای پیری را کند میکند و در موشهای نر بهطور میانگین حدود 6.6 درصد به طول عمر میافزاید. این کار پیوندی قوی بین سازماندهی بهتر میتوکندری و بهبود متابولیسم و توان بدنی نشان میدهد و راهبردهای جدیدی برای تقویت سلامتپایدار (healthspan) مطرح میسازد. یافتهها بهویژه برای محققانی که روی زیستشناسی میتوکندری، پروتئینهای سازهای و مداخلات افزایش طول عمر کار میکنند، اهمیت دارد و دریچهای برای توسعه روشهای درمانی هدفمند باز میکند.
سوپرکامپلکسهای میتوکندری و نقش COX7RP
میتوکندری اغلب بهعنوان باتری سلولی توصیف میشود؛ کمپلکسهای تنفسی آن در حالت طبیعی میتوانند به واحدهای بزرگتری موسوم به سوپرکامپلکسها (supercomplexes) سازماندهی شوند تا اثربخشی و کارایی تولید ATP افزایش یابد. پروتئین COX7RP یکی از اجزای تنظیمکننده و تثبیتکننده این تجمعات مولکولی است. در مطالعه جدیدی که توسط دانشگاه پزشکی سایتاما و دانشگاه چیبا انجام شد، موشها بهصورت ژنتیکی مهندسی شدند تا بیان COX7RP در بافتهای مختلف افزایش یابد و محققان سپس خروجیهای متابولیکی، مولکولی و طول عمر را در این نمونهها دنبال کردند. این طراحی تجربی شامل مقایسه گروههای شاهد و گروههای دارای افزایش بیان COX7RP با استفاده از شاخصهای بالینی و مولکولی متعدد بود تا تأثیرات سیستماتیک بر متابولیسم گلوکز، لیپیدها، ظرفیت بیواکسیداتیو و نشانگرهای استرس سلولی مشخص شود.
تجزیه و تحلیل نمونههای بافتی نشان داد میتوکندریهای موشهای دارای افزایش COX7RP سوپرکامپلکسهای تنفسی بیشتری تشکیل میدهند و در نتیجه تولید انرژی را با کارآیی بالاتری انجام میدهند. این تغییر ساختاری با کاهش تولید گونههای فعال اکسیژن (reactive oxygen species یا ROS) همراه بود؛ مولکولهایی که میتوانند در طول زمان به مولکولهای زیستی آسیب بزنند و فرایندهای پیری سلولی را تسریع کنند. کاهش ROS و بهبود بهرهوری زنجیره انتقال الکترون از منظر زیستی-مولکولی به کاهش آسیبهای پروتئینی، لیپیدی و DNA منجر میشود و نشاندهنده کاهش استرس اکسیداتیو و بهبود هموستاز سلولی است. در مقیاس عملکردی، این سازوکارها میتوانند متابولیسم سلولی را به سوی مسیرهای محافظتیتر هدایت کنند و مقاومت سلولها در برابر تنشهای متابولیک را افزایش دهند.
چه تغییراتی در موشهای اصلاحشده مشاهده شد
موشهای نری که بیان COX7RP در آنها افزایش یافته بود، بهطور میانگین 6.6 درصد طول عمر بیشتری نسبت به گروه کنترل داشتند و مجموعهای از شاخصهای سلامتپایدار را نیز نشان دادند. نتایج قابل توجه شامل تحمل بهتر به گلوکز (glucose tolerance)، کاهش سطح اسیدهای چرب آزاد در گردش خون و افزایش استقامت عضلانی بود که همگی از خصوصیات مهم برای حفظ تحرک، عملکرد فیزیکی و ثبات متابولیک در سنین بالاتر محسوب میشوند. در سطح مولکولی نیز نشانگرهای زیستی مرتبط با پیری، مانند نمایه بیان ژنهای پاسخ به استرس، سطح پروتئینهای مربوط به بازسازی میتوکندری (mitochondrial biogenesis) و شاخصهای مرتبط با چرخههای متابولیکی، به سمت وضعیتهای مطلوبتر جابهجا شدند؛ این جابهجایی با کاهش استرس سلولی و تقویت ظرفیت تولید ATP همراستا بود. همچنین ارزیابیهای فیزیولوژیک نشان داد که ظرفیت هوازی و تحمل به خستگی در آزمونهای عملکردی افزایشی معنادار داشت که میتواند به حفظ کیفیت زندگی و کاهش آسیبپذیری نسبت به بیماریهای وابسته به سن کمک کند.
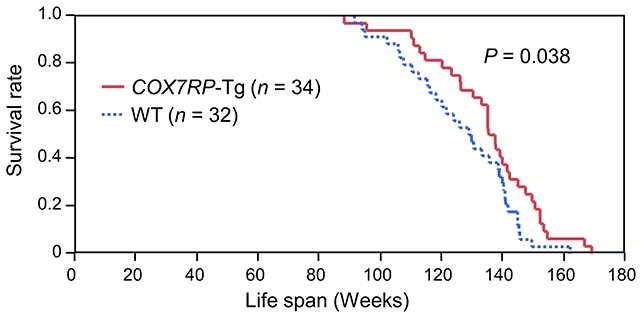
نشان داده شد موشهای مهندسیشده ژنتیکی طول عمر بیشتری دارند.
زمینه علمی و پیامدها
تحقیقات پیری مدتهاست که کاهش کارایی میتوکندری را با بیماریهایی از جمله زوال عقلی، سندرم متابولیک و مقاومت به انسولین مرتبط میدانند. بسیاری از مداخلاتی که در مدلهای آزمایشگاهی طول عمر را افزایش میدهند بر فرایندهای بیماریمحور خاصی تمرکز دارند؛ اما شواهدی که نشان دهد تقویت ساختار میتوکندری در شرایط غیر بیمار نیز میتواند طول عمر و سلامتپایدار را افزایش دهد، کمتر در دسترس بوده است. این مطالعه پشتیبانی تجربی مستقیمی ارائه میدهد که استحکامبخشی به معماری میتوکندریایی میتواند هم سلامت و هم طول عمر را تحت تأثیر قرار دهد و بنابراین مفهوم سوپركامپلکسهای تنفسی بهعنوان هدف درمانی معنادارتر میشود. از منظر زیستشناسی سیستمها، تثبیت یا تقویت تجمعات پروتئینی میتواند اثرات شبکهای در مسیرهای متابولیک و سیگنالینگ ایجاد کند؛ این تأثیرات ممکن است شامل بهبود مصرف اکسیژن، کاهش لیک الکترونها و بهینهسازی مصرف سوخت سلولی باشد.
نویسندگان پیشنهاد میکنند که مداخلاتی که به تشکیل یا پایداری سوپرکامپلکسهای تنفسی میتوکندری کمک میکنند، ممکن است به عنوان راهکارهای درمانی بررسی شوند. گزینههای ممکن شامل مولکولهای کوچک (small molecules) با هدف مشخص، مکملهای تغذیهای با مکانیسم مؤثر بر تثبیت پروتئینهای سازهای، بیولوژیکهای هدفمند که فعالیت COX7RP را تقویت یا تقلید میکنند، و همچنین رویکردهای مبتنی بر ژندرمانی برای افزایش بیان این پروتئین در بافتهایی که بیشترین آسیب پیری را متحمل میشوند، است. این استراتژیها باید با مطالعات دقیق روی فارماکوکینتیک، هدفگیری بافتی و ارزیابی اثرات جانبی احتمالی همراه باشند تا امکان انتقال یافتهها به محیط بالینی فراهم گردد.
محدودیتها و گامهای بعدی
اگرچه نتایج در موشها امیدوارکننده است، انتقال این یافتهها به انسان هنوز با عدم قطعیتهای قابل توجهی روبهروست. تفاوتهای پایهای در طول عمر، فیزیولوژی و پیچیدگیهای پیری انسانی باعث میشود که یافتههای مدلهای جونده تنها یک گام ابتدایی باشند نه تضمینی برای نتیجه مشابه در انسان. کارهای آینده باید ایمنی بلندمدت افزایش COX7RP یا مداخلات مرتبط را ارزیابی کنند، روشهای بهینه تحویل (delivery) به بافتهای هدف را مشخص سازند و بررسی کنند که آیا بهبودهای میتوکندریایی مشابه با مزایای بالینی در انسانها همزیستی دارد یا خیر. از جنبههای فنی، نیاز به طراحی مولکولهای با اختصاصیت بالا و ارزیابی اثرات بافتی-مکرو وجود دارد زیرا تغییرات در پروتئینهای سازهای میتوانند پاسخهای متفاوتی در انواع سلولها ایجاد کنند. همچنین مطالعات طولی و مدلسازی سیستمیک میتواند به شناسایی پنجرههای درمانی و زمانبندی مداخلات کمک کند؛ بهعنوان مثال آیا افزایش COX7RP در سنین جوانی، میانسالی یا پیری بیشترین منفعت را دارد و آیا این منفعتها با هزینههای متابولیک یا ایمنی همراه هستند.
دیدگاه کارشناسی
دکتر النا مارکز، زیستشناس میتوکندری در یک دانشگاه تحقیقاتی، اشاره میکند که این مطالعه یک پیوند مکانیکی روشن بین ساختار اندامک و پیری ارگانیسمی ارائه میدهد. او توضیح میدهد که هدفگیری تجمعات پروتئینی یک راهبرد ظریف است: تغییرات کوچک در یک پروتئین سازهای مانند COX7RP میتواند در سراسر متابولیسم سلولی اثر کند، اما اثرات نامطلوب خارج از هدف (off-target) و پاسخهای وابسته به نوع بافت نیازمند بررسی پیشبالینی دقیق خواهند بود. دکتر مارکز تأکید میکند که اگرچه درمانهای ژنی یا مولکولهای کوچک دقیق ممکن است در آینده پدیدار شوند، دادههای جامع ایمنی پیش از ورود به کارآزماییهای انسانی ضروری است. او همچنین اشاره میکند که شواهد پایهای از مطالعات فیلوژنتیکی، بیوشیمیایی و مدلهای سلولی تکسلولی میتواند به درک بهتر نقش COX7RP در بافتهای مختلف کمک کند و مسیرهای همکار (interacting pathways) را روشنتر سازد.
نتیجهگیری
مطالعه روی COX7RP یک سازوکار سلولی قابلدسترس برای کند کردن بخشهایی از پیری در یک مدل پستاندار را برجسته میسازد. با بهبود نحوه سازماندهی و تولید انرژی توسط میتوکندری، محققان به افزایشهای قابلاندازهگیری در سلامت متابولیک، استقامت عضلانی و طول عمر دست یافتند. ترجمه این نتایج به انسان مستلزم مطالعات بیشتر است؛ با این حال، مفهوم تثبیت سوپرکامپلکسهای میتوکندریایی اکنون بهعنوان یک هدف امیدوارکننده در جستوجوی مداخلاتی که سلامتپایدار را افزایش دهند، مطرح شده است. در پایان، ترکیب شواهد مولکولی، فیزیولوژیک و عملکردی از مطالعات پیشبالینی میتواند چارچوبی برای توسعه رویکردهای بالینی فراهم آورد که هدفشان بهبود کیفیت زندگی در سنین بالاتر و کاهش بار بیماریهای وابسته به پیری است.
منبع: sciencealert
نظرات
بلوکتون
تبلیغی شده انگار؛ 6.6٪ که خوبه ولی اغراق تو پیامها زیاده. نیاز به تکرار و ایمنی بلندمدت داریم
توربو
تو آزمایشگاه ما هم قاطعاً دیدم که معماری میتوکندری فرق زیادی ایجاد میکنه، ولی تحویل بافتی کابوسه، کلی چالش داره
مهران
واقعاً روی انسان جواب میده؟ یا فقط توی موشها؟ مطالعه خوبه اما شک دارم، نمونههای بزرگتر کجاست؟
بیوانیکس
منطقیه، بهینهسازی میتوکندری میتونه کلی فایده داشته باشه. ولی ترجمه به انسان؟ مسیر طولانیه.
دیتاپالس
نخوام اغراق کنم ولی 6.6٪؟! یعنی فقط با یه پروتئین انقدر؟ امیدوارم تأثیرات جانبی نادیده گرفته نشده باشه، کنجکاوم...


ارسال نظر