8 دقیقه
یک مطالعه جدید نشان میدهد که میتوان با وادار کردن کبد به تولید سیگنالهایی که معمولاً در تیموس ساخته میشوند، بهطور موقت عملکرد ایمنی جوانتر را بازیابی کرد. در مدلهای موشی، یک درمان هدفمند مبتنی بر mRNA تولید سلولهای T را باززنده کرد و پاسخها به واکسیناسیون و تومورها را بهبود بخشید — مسیری احتمالی برای جوانسازی ایمنی امنتر در افراد سالمند.
سلولهای T بخش کلیدی از سیستم ایمنی بدن هستند.
چرا تیموس اهمیت دارد — و با افزایش سن چه اتفاقی میافتد
تیموس یک اندام کوچک در بالای قلب است که سلولهای نابالغ را تعلیم میدهد تا به سلولهای T تبدیل شوند؛ این سلولها نگهبانان خط مقدم سیستم ایمنی محسوب میشوند. از اوایل بزرگسالی، تیموس بهتدریج کوچک و عملکردش کند میشود؛ فرایندی که به آن «آتروفی تیموس» یا thymic involution گفته میشود. نتیجه این تغییر این است که تعداد سلولهای T جدید کاهش مییابد و تنوع مجموعه سلولهای ایمنی کم میشود؛ در نتیجه افراد مسن در برابر عفونتها، سرطانها و پاسخهای ضعیفتر به واکسنها آسیبپذیرتر میگردند.
کاهش تولید لنفوسیتهای T و کاهش تنوع گیرندههای سلولی (TCR repertoire) از ویژگیهای اصلی پیری ایمنی یا ایمنیسُنیسنس است. این تغییرات پیچیده شامل کمبود فاکتورهای رشدی، تغییر در میکرومحیط تیموس، و افزایش سیگنالهای التهابی مزمن است. تیم تحقیقاتی در مؤسسه Broad وابسته به MIT و Harvard تصمیم گرفتند بهجای تلاش برای بازسازی کامل تیموس، بخشی از عملکردهای سیگنالدهی آن را جایگزین کنند. راهکار آنها این بود که از کبد بهعنوان یک کارخانه تولید پروتئین استفاده شود؛ کبد با وجود پیری معمولاً هنوز توان تولید پروتئینهای دورانبر را دارد و دسترسی هدفمند به آن برای درمانهای موضعی عملیتر بهنظر میرسد.
تبدیل کبد به کارخانه پروتئینسازی شبیه تیموس
ابتدا تیم پژوهشی سیستم ایمنی موشهای جوان و پیر را مقایسه کردند تا سیگنالهای کلیدی که با سن کاهش مییابند را شناسایی کنند. آنها روی سه پروتئین تمرکز کردند که نقش مهمی در هدایت سرنوشت سلولی و حفظ سلامت سلولهای در حال تکوین T دارند: DLL1، FLT3-L، و IL-7. این سه عامل نقش دستورالعملهایی را بازی میکنند که میگویند «به سلول T تبدیل شو» و «زنده بمان و عملکردی باقی بمان».
DLL1 (یک لیگاند مسیر Notch) در انتخاب سرنوشت سلولی و تمایز پیشسازهای لنفوییدی مؤثر است. FLT3-L (عامل رشد گیرنده FLT3) در تولید و نگهداری پیشسازهای لنفوییدی و سلولهای دندریتیک تأثیر دارد و به ایجاد محیط مناسب برای بلوغ سلولهای T کمک میکند. IL-7 یک سیتوکین حیاتی برای بقا، تکثیر و هومئوستازی لنفوسیتهای T است؛ فقدان یا کاهش IL-7 با کاهش زنده ماندن سلولهای T جوان و افت تنوع ایمنی همراه است. ترکیب این سه فاکتور میتواند مجموعهای از سیگنالهای چندجانبه فراهم کند که هم هدایت تمایزی و هم پشتیبانی بقایی را فراهم سازد.
mRNA دستورالعملها را تحویل میدهد
در مرحله بعد، محققان mRNA (رونوشت پیامرسان) رمزگذار این پروتئینها را بستهبندی کردند و آن را طی چند هفته به کبد موشهای مسن تزریق نمودند. mRNA بهعنوان الگوی موقتی عمل میکند که به سلولها اجازه میدهد پروتئینهای مشخصی را بسازند — همان پلتفرمی که در برخی واکسنهای مدرن بهکار میرود — و این امکان را فراهم آورد که کبد بدون تغییر دائمی بافت، DLL1، FLT3-L و IL-7 تولید کند.
انتخاب قالب mRNA مزایایی دارد: موقتی بودن بیان پروتئین و کاهش خطرات تغییرات ژنتیکی دائمی، امکان تنظیم دوز و مدت درمان، و قابلیت تلفیق با روشهای تحویل هدفمند که بیان را به اندام مشخصی محدود میکنند. در مطالعات پیشبالینی معمولاً از نانوذرات لیپیدی یا حاملهای مشابه برای حفاظت از mRNA و تسهیل ورود آن به سلولهای کبدی استفاده میشود؛ این روشها باید در مطالعات بعدی برای بهبود کارایی و ایمنی بهینهسازی شوند.
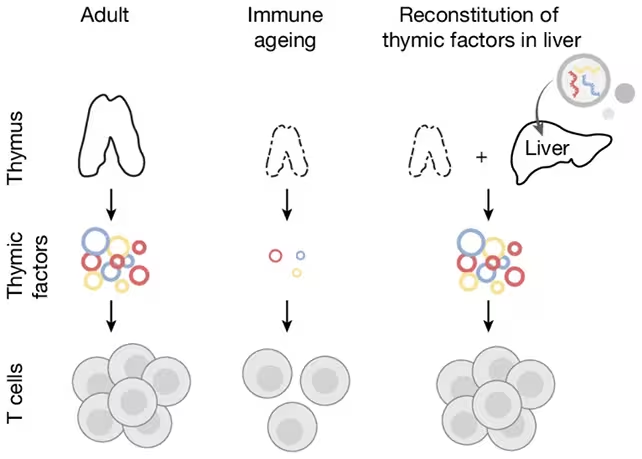
محققان از کبد موشها برای تحریک تولید سلولهای T استفاده کردند.
سلولهای T قویتر و متنوعتر — ولی فقط برای مدتی
پس از چهار هفته درمان، موشهای مسن بهبودهای قابلتوجهی نشان دادند: تعداد بیشتری سلول T، تنوع بالاتر در جمعیت سلولهای T، پاسخهای آنتیبادی بهتر به واکسن و کنترل بهتر تومور در آزمونهای چالشی سرطان. بهعبارت دیگر، نمایه ایمنی این حیوانات جوانتر و مقاومتر بهنظر میرسید. آزمایشها معمولاً شامل ارزیابی زیرگروههای سلولهای T (CD4+ و CD8+)، اندازهگیری گستره تنوع گیرندههای T (TCR repertoire)، تعیین عیار آنتیبادیها پس از واکسیناسیون و چالش با سلولهای سرطانی برای سنجش کنترل تومور بودند.
یک نکته مهم این است که اثر مشاهدهشده گذرا بود. افزایش ترشح کبد پس از قطع درمان کاهش یافت که نویسندگان آن را بهعنوان یک ویژگی ایمنی برجسته کردند: افزایش موقت تولید سلولهای T ریسک بیشتحریک مزمن سیستم ایمنی را کاهش میدهد، امری که میتواند به التهاب مضر یا واکنشهای خودایمنی منجر شود. ایمنی کنترلشده و برگشتپذیر بیان پروتئین در اندامی مانند کبد یک مزیت برای جلوگیری از پیامدهای نامطلوب طولانیمدت بهشمار میرود.
معنی این یافتهها برای سلامت انسان و گامهای بعدی
نتایج در موشها نشاندهنده یک جایگزین امیدوارکننده برای استراتژیهای تقویت سیستم ایمنی سراسری است که معمولاً تمام جریان خون را اشباع میکنند و ممکن است عوارض جانبی ایجاد نمایند. از آنجا که کبد خون را فیلتر میکند و نسبتاً در دسترس درمانهای هدفمند قرار دارد، ممکن است مکان مناسبی برای تحویل کنترلشده و انداممحور تنظیم ایمنی باشد. این رویکرد میتواند بهعنوان یک ابزار برای بهبود اثربخشی واکسنها در سالمندان، کاهش عفونتهای مرتبط با پیری ایمنی، یا تکمیل درمانهای ایمنیدرمانی سرطان مورد بررسی قرار گیرد.
با این حال، موفقیت در موش تضمینی برای اثربخشی در انسان نیست. محققان برنامهریزی کردهاند تا این رویکرد را در مدلهای حیوانی دیگر آزمایش کنند، ترکیب و دوز سیگنالها را اصلاح نمایند و مدت زمان مناسب تحویل را تعیین کنند. همچنین باید تأثیرات روی انواع سلولهای ایمنی دیگر، پیامدهای سیستمی بالقوه، و نشانگرهای زیستی قابلاعتماد برای پایش پاسخ ایمنی بررسی شوند. ترجمه بالینی نیازمند کار دقیق روی تعیین دوز، مطالعات سمشناسی، ارزیابی ایمنی بلندمدت و برنامهریزی برای کارآزماییهای بالینی مرحلهای است.
میرکو فریدریش (Broad Institute/MIT) در توضیح منطقی این استراتژی هدفمند کبدی گفت: «ما تلاش کردیم با تقلید از ترشحات تیموس، حفاظت ایمنی را برای مدت طولانیتری در زندگی حفظ کنیم.» فن زنگ (MIT) روش را بهعنوان راهی مصنوعی و مهندسیشده برای بازآفرینی سیگنالهای تیموس بدون بازسازی کامل تیموس توصیف کرد. این دیدگاه ترکیبی از زیستشناسی پایه، مهندسی زیستی و فناوری mRNA را نشان میدهد که میتواند راهکارهای جدیدی را برای مشکلات مرتبط با پیری ایمنی ارائه دهد.
اگر در انسانها تأیید شود، درمان مبتنی بر mRNA متمرکز بر کبد میتواند به ابزاری برای کاهش افت ایمنی مرتبط با سن تبدیل شود؛ بهبود اثربخشی واکسنها و مقاومت در برابر بیماریها در سالمندان را افزایش دهد و در عین حال برخی از خطرات مرتبط با تزریق مستقیم در جریان خون را کاهش دهد. با این وجود، چالشهای مهمی وجود دارد: نیاز به سازگاری فرمولاسیونهای تحویل، مدیریت پاسخهای التهابی موضعی یا سیستمیک احتمالی، مسائل مربوط به تولید در مقیاس و هزینه، و نیز چارچوبهای نظارتی برای داروهای ژنمحور و mRNA.
برای افزایش قابلیت اطمینان و قابلیت اجرا، مطالعات بعدی میتوانند شامل موارد زیر باشند: پژوهشهای مکانیزمی عمیقتر درباره تعامل بین سیگنالهای ارائهشده توسط کبد و میکرومحیط تیموسی، آزمایشِ دوزهای کمتر و بیشتر و ارزیابی طولانیمدت بقای سلولهای T تولیدشده، و ترکیب این روش با راهبردهای دیگر مانند واکسنهای تقویتی یا درمانهای ایمونومدولاتور هدفمند. علاوه بر این، بررسی تفاوتهای گونهای در پاسخها و سنجش نشانگرهای پیشبینیکننده پاسخ — مانند سطح پایه IL-7 یا شاخصهای التهابی سیستمی — برای طراحی کارآزماییهای انسانی حیاتی خواهد بود.
در نهایت، دستیابی به هدف کاهش پیری ایمنی نیازمند تعادل بین افزایش محافظت علیه عوامل بیماریزا و جلوگیری از تحریک مفرط سیستم ایمنی است. رویکرد مبتنی بر کبد ممکن است این تعادل را با فراهم کردن افزایش موقت و قابل کنترل در تولید سلولهای T بهدست دهد؛ اما اثبات ایمنی، پایداری اثر و مزیت بالینی در انسانها پیشنیاز هر گونه ترجمه به درمان واقعی است.
منبع: sciencealert
نظرات
کوینتو
یکم بزرگش کردن به نظر میاد اما ایده تولید موقت در کبد جذابه. هزینه، تولید در مقیاس و مقررات چهطور بررسی میشن؟
اتو_ر
رویکرد جالبی برای سالمندان. کنترلپذیر بودنش مهمه، امیدوارم نتایج طولانی مدت و عوارض جانبی رو هم ببینیم
آرمان
منفیهاش هم زیاده، ولی منطقیه؛ mRNA کبدی راهحل عملیتر و امنتر به نظر میاد، به شرط کنترل دقیق
بیونیکس
این روی موش خوبه، ولی آیا تو انسان هم همین کار میکنه؟ مدلهای دیگه و طولانیمدت لازمه، نه فقط هیجان اولیه.
رودایکس
واو، یعنی میشه تیموس رو دور زد؟ ایده جالب و کمی نگرانکننده هم هست… اگر ایمنی برای مدتی بهتر بشه یه قدم بزرگه، ولی عوارض بلندمدت چی؟

ارسال نظر