8 دقیقه
انگل در برابر چشم پنهان میشود. در مغز موشهایی که هفتهها آلوده شدهاند، توکسوپلاسما گوندیی ثابت نمیماند؛ این انگل تنوعپذیری بالایی نشان میدهد. پژوهشهای جدید نشان میدهد که کیستهایی که پس از ۲۸ روز بازیابی میشوند، ترکیب گونههای زیرمجموعهٔ انگل غنیتری دارند تا آنچه در فاز اولیه و حاد عفونت دیده میشود. این یافتهها چشماندازی تازه دربارهٔ زیستشناسی کیستها، پایداری عفونت مزمن و راهبردهای درمانی ارائه میدهند.
مرحلهٔ اولیه دینامیک بالایی دارد. در هفتهٔ اول، انگلها به حالت رشد سریعتری تغییر میکنند — جهشی کوتاهمدت که به گسترش عفونت کمک میکند. اما داستان با یک انتقال ساده و مرتب پایان نمییابد. پس از آن انفجار اولیه، بسیاری از انگلها به فرمهای رشد کندتری میروند که به نظر میرسد برای نگهداری کیستها تخصصی شده باشند. جمعیت داخل یک کیست بیشتر شبیه یک اکوسیستم است تا یک گونهٔ واحد که از مرحلهای مشخص به مرحلهٔ بعد میرود.
مطالعه و پیامدها
ویلسون و همکارانش معتقدند که دیدگاه مرسوم کتابهای درسی — رشد خطی و مرحلهبهمرحله از یک وضعیت یکنواخت به وضعیت بعدی — دیگر با دادهها سازگار نیست. تحلیل آنها که در نشریهٔ Nature Communications منتشر شده است، فرایند بلوغ پیچیدهتری را نقشهبرداری میکند که در آن استراتژیهای رشد متعدد همزیستی دارند و با گذر زمان تغییر میکنند. به طور ساده: بلوغ یک خط مستقیم نیست.
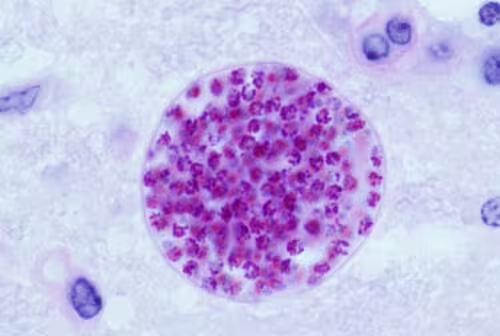
این نکته چرا اهمیت دارد؟ زیرا زیستشناسی کیست زیربنای عفونت مزمن، فرار از ایمنی و امکان راکتیو شدن را تشکیل میدهد. اگر کیستها میزبان انواع متنوعی از انگلها با پروفایلهای متابولیک و رشد متفاوت باشند، درمانهایی که برای هدف قرار دادن تنها یک مرحله از چرخهٔ زندگی طراحی شدهاند ممکن است جمعیتهای زیرمجموعهٔ مهمی را از قلم بیندازند. واکسنها و داروهایی که بر اساس چرخهٔ زندگی ایستا و منظم طراحی شدهاند، ممکن است کارایی کمتری از انتظار نشان دهند.
«برای دههها چرخهٔ زندگی بسیار سادهسازی شده بود،» ویلسون اشاره میکند، «و یافتههای ما رشتهٔ پژوهش را به سمت بهروزرسانی مدلها سوق میدهد.» این پژوهش نوع دیگری از تفکر را دربارهٔ پایداری در مغز مقدّم میکند و مسیرهای آزمایشی جدیدی را پیشنهاد میدهد که هدفشان نقشهبرداری از تنوع درونکیستی و شناسایی آسیبپذیریهاست.
در حالی که پژوهشگران نقشهٔ فازهای پنهان توکسوپلاسما را بازطراحی میکنند، جستوجو برای مداخلاتی که بتوانند آن تنوع را در نظر بگیرند — یا از آن بهره ببرند — آغاز میشود. از منظر بیماریشناسی، این تحول درک ما از توکسوپلاسموز مزمن (toxoplasmosis) را عمیقتر میکند و پیامد مستقیم بر توسعهٔ داروها، طراحی واکسن و سیاستهای بهداشت عمومی دارد.
جزئیات فنی و روششناسی
تحلیلهای مدرن که به ارائهٔ این نتیجه انجامیدند عمدتاً بر فنّاوریهای دقیق تکسلولی (single-cell RNA-seq)، پروفایلهای متابولیک و میکروسکوپهای با وضوح بالا تکیه دارند. با استفاده از تکسل رونوشتسنجی، محققان توانستند الگوهای بیان ژن را در جمعیتهای مختلف داخل کیست شناسایی کنند و نشان دهند که برادیزویتها (bradyzoites) و تاکیزویتها (tachyzoites) تنها نمایندگانِ دو حالت ثابت نیستند، بلکه طیفی از حالتهای میانجی با پروفایلهای متابولیک متمایز وجود دارد.
این حالتهای میانجی ممکن است تفاوتهای بنیادین در مسیرهای انرژیزایی، مصرف گلوکز، قابلیت استفاده از اسیدهای آمینه و پاسخهای تنش اکسیداتیو نشان دهند. برخی زیرگروهها نشاندهندهٔ مصرف بالای گلوکز و تقسیم سریع هستند، در حالی که گروههای دیگر به متابولیسم آهستهتر و حفاظت از ساختارهای داخلکیستی متمایلاند. همچنین تغییرات در بیان ژنهای مرتبط با فرار از ایمنی میزبان و بازسازی دیوارهٔ کیستی مشاهده شده است.
برای تایید این الگوها، مطالعات تکمیلی از تصویربرداری زنده و فلورسنت برای دنبالکردن رفتار سلولی در طول زمان استفاده کردند؛ روشهایی که قادرند هم تعاملات سلول-میزبان و هم تنوع دروناجزایی انگل را بهطور همزمان نشان دهند. ترکیب این مجموعهٔ دادهها با تجزیه و تحلیل بیوانفورماتیک پیچیده، مدلی را به دست میدهد که در آن کیست به عنوان یک جامعهٔ پویا معرفی میشود تا یک ساختار یکنواخت.
پیامدها برای درمان و طراحی واکسن
اگر کیستها هتروژنیتهٔ داخلی قابلتوجهی داشته باشند، رویکردهای درمانی سنتی نیاز به بازاندیشی دارند. داروهایی که برای هدف قرار دادن تنها تاکیزویتهای تقسیمشونده طراحی شدهاند ممکن است اثری محدود بر گروههایی که در حالت برادیزویت یا دیگر فرمهای کمفعال قرار دارند داشته باشند. بنابراین یک راهبرد چندوجهی که هم فرمهای رشد سریع و هم فرمهای کمفعال را هدف بگیرد، منطقیتر به نظر میرسد.
از نظر طراحی واکسن، فرض وجود یک مرحلهٔ کاملاً مشخص که واکسن به آن متکی است میتواند فریبدهنده باشد. واکسنهایی که بر ایمنی سلولی در برابر آنتیژنهای مشترک در تمام زیرگروهها تمرکز کنند — یا واکسنهای چندآنتیژنی — ممکن است شانس بهتری برای ایجاد محافظت بلندمدت داشته باشند. بهعلاوه، درک تفاوتهای متابولیک بین زیرگروهها میتواند هدفهای دارویی جدیدی مانند آنزیمهای کلیدی در مسیرهای انرژیزایی یا عوامل سازگارکنندهٔ استرس را معرفی کند.
یکی از چالشهای کلیدی، شناسایی هدفهایی است که در تمام زیرپوشهها محافظتشده و ضروری باشند؛ هدفهایی که حذف آنها منجر به اختلال عملکرد کیست و کاهش توان راکتیو شدن انگلها شود. ترکیب داروهای تهاجمیتر در فاز حاد با داروهای مولکولی که متابولیسم برادیزویتها را مختل میکنند، یکی از استراتژیهایی است که باید بررسی شود.
پیوند با سیستم ایمنی و راکتیو شدن
کیستهای توکسوپلاسمایی در مغز با محیط ایمنی خاصی روبهرو هستند؛ میکروگلیا و سلولهای ایمنی نفوذپذیر، سیتوکینها و فاکتورهای التهابی همگی در شکلگیری تعادل بین پایداری و پاکسازی نقش دارند. تنوع درونکیستی میتواند موجب شود که گروههایی از انگلها بهطور موقت از واکنش ایمنی فرار کنند یا پاسخ ایمنی را تغییر دهند.
همچنین، راکتیو شدن کیستها — بازگشت شکل تهاجمی و فعال انگل و ایجاد عفونتهای بالینی مجدد — ترکیبی از عوامل میزبان و انگل است. وجود زیرگروههایی که نسبت به استرسهای متابولیک یا التهابی مقاومتر هستند، ممکن است شانس راکتیو شدن را افزایش دهد. بنابراین عوامل مستعدکنندهٔ راکتیو شدن (مانند سرکوب ایمنی، التهاب سیستمیک یا تغییرات متابولیک میزبان) باید در کنار تنوع درونکیستی مورد بررسی قرار گیرند.
مسیرهای آیندهٔ پژوهشی
- نقشهبرداری جامع از تنوع درونکیستی با استفاده از توالییابی تکسلولی در زمانهای مختلف و با نمونهگیریهای گستردهتر از بافت مغز.
- آزمایشهای عملکردی برای تعیین نقش زیرگروهها در تشکیل و پایداری کیست، با استفاده از مهندسی ژنتیک (CRISPR) برای مختلکردن ژنهای هدف در زیرمجموعههای مشخص.
- پروفایلهای متابولیک و متابولومیک برای شناسایی مسیرهای انرژیزایی حیاتی در هر زیرگروه و طراحی مهارکنندههای اختصاصی متابولیک.
- مطالعات طولی در مدلهای حیوانی تا بررسی پیامدهای تنوع درونکیستی بر توانایی راکتیو شدن، انتقال و اثرات نورولوژیک در میزبان.
- ارزیابی ترکیبات دارویی و استراتژیهای واکسیناسیون که همزمان چندین حالت زیستی را هدف میگیرند.
این مسیرها نه تنها به افزایش درک پایهای از زیستشناسی توکسوپلاسما کمک میکنند، بلکه میتوانند منافع عملی مستقیم در توسعهٔ درمانها و راهبردهای پیشگیری داشته باشند. همکاریهای بینرشتهای شامل زیستشناسی سلولی، ایمنیشناسی، بیوانفورماتیک و داروشناسی برای پیشبرد این اهداف ضروری خواهد بود.
پیام نهایی برای جامعهٔ علمی و بالینی
تغییر پارادایم از دیدگاه خطی و سادهشدهٔ چرخهٔ زندگی به مدلی که تنوع و همزیستی چند حالت را در نظر میگیرد، میتواند راههای نوآورانهای برای درمان توکسوپلاسموز مزمن باز کند. پزشکان، پژوهشگران دارویی و طراحان واکسن باید این دادهها را در برنامهریزی مطالعات بالینی و پیشبالینی لحاظ کنند. در نهایت، فهم دقیقتر از تنوع درونکیستی میتواند منجر به مداخلاتی شود که پایداری انگل در مغز را کمتر میکند و خطر عوارض مزمن یا راکتیو شدن را کاهش میدهد.
در میدان پژوهش زیستپزشکی، جزئیات مهماند: دانستن اینکه یک کیست فقط یک حالت ایستا نیست، بلکه از گروههایی با استراتژیهای بقاء متفاوت تشکیل شده، میتواند تفاوت بین درمان سنتیِ ناکافی و درمانی مؤثر و بلندمدت را رقم بزند. با بازتعریف نقشهٔ فازهای پنهان توکسوپلاسما، اکنون زمان آن است که مداخلات همسطح و چندبعدی طراحی و آزمایش شوند.
برای خوانندگان علاقهمند به جنبههای تخصصیتر، پژوهشهای آتی باید بر تعیین ژنهای کلیدی در تنظیم انتقالهای متابولیک، تعاملات مولکولی بین انگل و میزبان در مرزهای کیستی و توسعهٔ مدلهای محاسباتی که رفتار جمعیت داخل کیست را پیشبینی میکنند، تمرکز کنند. این ترکیب از دادههای تجربی و مدلسازی میتواند راهنمایی قوی برای توسعهٔ داروها و واکسنهای نسل بعدی فراهم آورد.
منبع: sciencealert
نظرات
مهدی
دیدگاه جدید مهمه؛ مدلهای ایستا دیگه کارایی ندارن. فقط سوال؛ چطور میشه هدفی مشترک بین زیرگروهها پیدا کرد؟
شهرلاین
قلمبه سلمبهست، کمی اغراق شده به نظر میاد، ولی مسیر تحقیق خوبه. باید دادههای بیشتری ببینیم
بیوانیکس
تو آزمایشگاه دیده بودم گرم شدن متابولیک باعث تغییر حالت میشه، اینکه از تکسلولی استفاده کردن عالیه. امیدوارم CRISPR جواب بده :)
توربوپایا
منطقیش هست، ولی درمان چندوجهی یعنی چه عملاً؟ امیدوارم زودتر تست کنن، زمان محدود.
کوینوی
آیا این دادهها قابل تکرار هستن؟ آزمایشها رو کجا و چندتا انجام دادن؟ شک دارم به کلیت نتیجه.
رودایکس
واقعاً! نمیدونستم کیستها انقدر پیچیدهان، یعنی انگار یه دنیا کوچیک تو مغز... ایدههای درمانی باید تجدید نظر کنن، شگفتزده شدم

ارسال نظر