7 دقیقه
مدار عصبی جدید پیوند میان خواب و بازسازی بدن را نشان میدهد
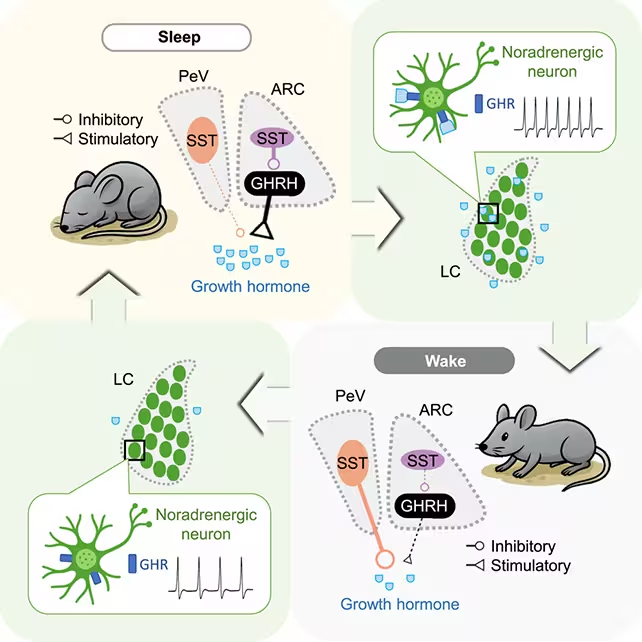
زمانی که میخوابیم، بدن وارد حالت بازسازی میشود: هورمون رشد (GH) برای بازسازی عضله و استخوان و تنظیم فرآیندهای متابولیک آزاد میشود. تا اخیراً، پژوهشگران سطح GH را با نمونهگیری خون در طول خواب اندازهگیری میکردند، اما مدارهای عصبی که این آزادسازی را آغاز و تنظیم میکنند تا پیش از این نامشخص بود. گروهی به سرپرستی دانشگاه UC Berkeley اکنون با ثبت فعالیت عصبی در موشها طی چند چرخه خواب-بیداری، مداری را شناسایی کردهاند که زمانبندی ترشح هورمون رشد را بین خواب REM و خواب غیر-REM متفاوت میکند و نشان میدهد که کنترل عصبی هورمون رشد پیچیده و وابسته به مرحله خواب است.
پیشزمینهٔ علمی و روششناسی آزمایشی
این گروه از ثبتهای پیوستهٔ عصبی در موشها همراه با آزمایشهای هورمونی استفاده کردند تا همبستگی بین جمعیتهای نورونی مشخص و پالسهای GH را نقشهبرداری کنند. با دنبال کردن فعالیت نورونهای هیپوتالاموس که مرکز کنترل ترشح هورمون رشد هستند و گرههایی که بر هوشیاری تأثیر میگذارند، پژوهشگران الگوهای متمایزی از تنظیم GH در خواب REM نسبت به خواب غیر-REM مشاهده کردند. این کار که در سال 2025 در نشریه Cell منتشر شد، بر شواهد دیرینه مبنی بر اینکه کیفیت خواب مستقیماً عملکرد غدد درونریز و سلامت متابولیک را تحت تأثیر قرار میدهد میافزاید و از روشهای چندرشتهای مانند الکتروفیزیولوژی پیوسته، اپتوژنتیک و آزمایشهای هورمونی پشتیبانی میکند.
پژوهشگران آزادسازی هورمون رشد را در موشها طی چرخههای خواب/بیداری تحلیل کردند.
نکات فنی کلیدی
- ثبتهای الکتروفیزیولوژیک و اپتوژنتیک پیوسته امکان همزمانسازی دقیق بین فعالیت شلیک نورونی و پالسهای GH را فراهم کرد؛ این هماهنگی زمانی برای درک مکانیزمهای ضربانی ترشح هورمون حیاتی است.
- مطالعه نورونهایی را که ترشح GH را ترویج میکنند از آنهایی که آن را مهار میکنند تفکیک کرد، و نشان داد که نفوذ این جمعیتها در مراحل مختلف خواب بهشکل پویا تغییر میکند. این شامل نقش نورونهای تولیدکننده GHRH (هورمون آزادکننده هورمون رشد) و نورونهای سوماتوستاتینی کنترلکننده است.
- بهطور مهمی، هستهٔ لُکوسِرولئوس (locus coeruleus)—یک هستهٔ ساقهٔ مغز که در بیداری مرکزی محسوب میشود—یک حلقهٔ فیدبک با مدارهای تنظیمکنندهٔ GH تشکیل میدهد و نشان میدهد که حالتهای هوشیاری و سیگنالهای غددی بهصورت متقابل یکدیگر را تنظیم میکنند.
یافتههای اصلی و پیامدهای فیزیولوژیک
هورمون رشد در هر دو مرحلهٔ خواب REM و غیر-REM افزایش مییابد، اما رانندهها و مهارکنندههای عصبی این آزادسازی بسته به مرحلهٔ خواب نفوذ نسبی متفاوتی دارند. کشف حلقهٔ متقابل با هستهٔ لُکوسِرولئوس نشان از سامانهای بسیار متوازن دارد: خواب موجب تسهیل ترشح GH میشود و خود GH نیز از طریق مسیرهای گردشخور به وضعیت هیجانی و سطح هوشیاری تأثیر میگذارد. وقتی این توازن مختل میشود—مثلاً بر اثر کمخوابی مزمن، وقفههای مکرر در خواب یا نقص مدارهای عصبی—پیامدهای متابولیک قابلتوجهی به دنبال خواهد داشت.
GH تنها برای رشد و ترمیم بافت ضروری نیست؛ این هورمون نقش مؤثری در تنظیم متابولیسم گلوکز و لیپیدها دارد. آزادسازی ناکافی یا زمانبندینشدهٔ GH، مانند حالتی که در خوابهای تکهتکه یا مختل رخ میدهد، با خطر بالاتر چاقی، مقاومت به انسولین، دیابت نوع 2 و بیماریهای قلبی-عروقی مرتبط است. بینشهای جدید سطح مدار بنابراین عصبی پایهٔ خواب را به تنظیم غددی و سلامت بلندمدت متصل میکنند و نشان میدهند که اصلاح رفتار یا مدارهای عصبی خواب میتواند اثرات گستردهای بر متابولیسم داشته باشد.
کاربردهای بالینی و پژوهشی بالقوه
درک مدار عصبی که زمانبندی ترشح GH را تعیین میکند، افقهای درمانی تازهای را میگشاید. دارودرمانی هدفمند یا تنظیم عصبی میتواند ریتمهای طبیعی GH را در افرادی که دچار اختلالات خواب یا بیماریهای متابولیک هستند بازیابی کند. پژوهشگران پیشنهاد میکنند که هستهٔ لُکوسِرولئوس میتواند هدفی امیدوارکننده باشد: کاهش برانگیختگی این هسته ممکن است زمانبندی GH را بازتعادل کند و پیوستگی خواب را بهبود دهد.
ترجمهٔ نتایج از موش به انسان نیازمند اعتبارسنجی بیشتر است، اما نقش محافظتشدهٔ ساختارهای هیپوتالاموس و ساقهٔ مغز در کنترل خواب و غدد درونریز مسیر منطقیای را نشان میدهد. پژوهشهای آینده ممکن است بررسی کنند آیا بازخورد خواب–GH در پیشرفت بیماریهای نورودژنراتیو مانند آلزایمر نقش دارد یا خیر؛ در این بیماریها اختلال خواب و اختلال در تنظیم متابولیک شایع است و میتواند در یک چرخهٔ معیوب یکدیگر را تشدید کنند.
در سطح درمانی، گزینههایی مانند داروهای تنظیمکنندهٔ گیرندههای عصبی، اپتوژنتیک در مدلهای تجربی، و روشهای تنظیم عصبی غیرتهاجمی مانند تحریک مغناطیسی فراجمجمهای (TMS) یا تحریک جریان مستقیم فراجمجمهای (tDCS) ممکن است برای تغییر فعالیت لوکوسِرولئوس یا مدارهای هیپوتالامیک مورد استفاده قرار گیرند. همچنین تکنیکهای جدید مانند تنظیم سلولتایپمحور یا استفاده از وکتورهای ژنی جهت خاموش یا فعالسازی انتخابی گونههای نورونی میتوانند به بررسی علیت و پتانسیل درمانی کمک کنند.
دیدگاه تخصصی
«این ثبتها یک نگاه مکانیکی به ما میدهد که چگونه انتقال بین مراحل خواب دروازهٔ پالسهای هورمونی را کنترل میکند»، دکتر النا مارتینز، عصبشناس خواب که در این مطالعه مشارکت نداشت، میگوید. «اگر مدارهای مشابهی در انسان وجود داشته باشند، فرصتهای روشنی برای بهبود درمانهایی وجود دارد که هم کیفیت خواب و هم سلامت متابولیک را هدف قرار میدهند؛ دو مشکل در هم تنیده در جوامع معاصر.»
دکتر مارتینز اضافه میکند که ابزارهای نوظهوری مانند تنظیم ژن اختصاصی به نوع سلول و تحریک غیرتهاجمی مغز میتوانند برای آزمودن این ایده به کار گرفته شوند که آیا تنظیم فعالیت هستهٔ لُکوسِرولئوس میتواند ریتمهای طبیعی هورمون رشد را بدون عوارض جانبی بزرگ بازگرداند یا خیر. او تأکید میکند که پیش از هر کاربرد بالینی گسترده، مطالعات طولی انسانی و ارزیابی سلامت سیستمی لازم است.
محدودیتها و گامهای بعدی
این مطالعه پایهٔ مفهومی مهمی را فراهم میآورد اما رفتار مدارها را در انسان اثبات نمیکند. مطالعات طولی انسانی که پلیسومنوگرافی (پلیاسجی)، نمونهگیری هورمونی مکرر و تصویرسازی یا مداخلات تنظیم عصبی را ترکیب کنند، ضروری خواهند بود. پژوهشگران همچنین باید تعیین کنند که چگونه پیری، چاقی و بیماریهای نورودژنراتیو این حلقهٔ خواب–GH را اصلاح میکنند یا آسیب میزنند. برای مثال، تغییرات سنی در فرکانس و دامنهٔ پالسهای GH و نیز در پاسخ نورونهای هیپوتالامیک میتواند حساسیت افراد را نسبت به اختلالات متابولیک تغییر دهد.
از منظر روششناختی، ترجمهٔ نتایج به انسان نیازمند توسعهٔ ابزارهای غیرتهاجمی دقیق برای اندازهگیری و تغییر فعالیت نورونی در ساختارهای عمقی مانند هیپوتالاموس و هستههای ساقهٔ مغز است. علاوه بر این، تعیین مسیرهای مولکولی واسطه—از جمله نقش نوروترنسمیترها (نوروآدرنالین از لُکوسِرولئوس)، نوروافکتورهای هیپوتالامیک مانند GHRH و سوماتوستاتین، و سیگنالهای وابسته به متابولیسم سلولی—برای درک کامل مکانیسمهای کنترلی ضروری است.
نتیجهگیری
این پژوهش یک مدار عصبی را نقشهبرداری میکند که زمانبندی آزادسازی هورمون رشد را در مراحل مختلف خواب تعیین میکند و هستهٔ لُکوسِرولئوس را بهعنوان یک گرهٔ فیدبک که سیگنالهای درونریز را به هوشیاری مرتبط میسازد شناسایی میکند. با نشان دادن اینکه چگونه خواب REM و غیر-REM بهطور متفاوت ترویجکنندهها و مهارکنندههای GH را درگیر میکنند، این مطالعه پلِی بین فیزیولوژی خواب و سلامت متابولیک برقرار میسازد. تحقیقات پیوسته میتواند به توسعهٔ درمانهای هدفمند برای اختلالات خواب، بیماریهای متابولیک و دیگر شرایطی که با خواب مختل و عدم تعادل هورمونی همراهند، منجر شود. چنین تلاشهایی نیازمند مطالعات بینرشتهای، از مدلهای حیوانی تا کارآزماییهای بالینی کنترلشده و اندازهگیریهای مولکولی و سیستمیک خواهند بود.
منبع: sciencealert


ارسال نظر