9 دقیقه
افزایش سریع توان میتوکندری که به بقای سلولهای سرطانی در برابر فشار مکانیکی کمک میکند
سلولهای سرطانی هنگام فشرده شدن فیزیکی، انفجار سریعی از انرژی آزاد میکنند؛ این واکنش باعث میشود میتوکندریها بهسرعت اطراف هسته جمع شده و ATP اضافی را مستقیم به آن تحویل دهند. این مکانیسم تازهکشفشده که هم در آزمایشهای آزمایشگاهی و هم در نمونههای بیوپسی بیماران مشاهده شده، به بازتوانی آسیبهای DNA و بقا در شرایط استرس شدید کمک میکند.
مطالعهای که در Nature Communications منتشر شده و حاصل کار مرکز تنظیم ژنوم (CRG) در بارسلوناست، نشان میدهد که محدودیت مکانیکی باعث افزایش فوری ATP هسته میشود که از سوی میتوکندریها تأمین میگردد. این پاسخ سریع ظاهراً از ژنوم محافظت میکند وقتی سلولها تحت تغییر شکل مکانیکی قرار میگیرند — برای مثال هنگام عبور از فضاهای تنگ در میکروژئوفاصله تومور یا ورود به عروق خونی — و ممکن است نقش پنهانی در استقامت و تهاجم سلولهای سرطانی ایفا کند.
روش تجربی و مشاهدات کلیدی
محققان از سامانه میکروسکوپی زندهنمای سفارشی استفاده کردند که بهطور فیزیکی سلولهای منفرد را تا عرض تقریبی سه میکرون فشرده میکند، یعنی حدود یکسیامین قطر موی انسان. در این شرایط محدود، تیم بازآرایی چشمگیری از میتوکندریها در سلولهای سرطانی HeLa کشتشده مشاهده کرد: اندامکها بهسمت هسته حرکت کرده و حتی در هسته فرو رفتگیهایی ایجاد کردند و حلقهای محکم را شکل دادند که نویسندگان آن را میتوکندریهای وابسته به هسته (NAMs) نامیدند.
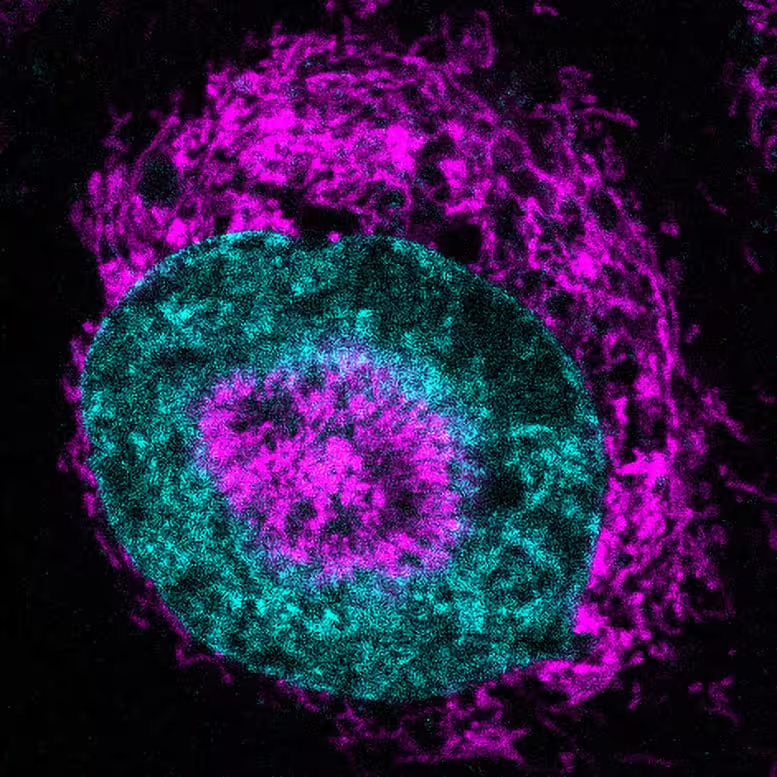
یک سلول سرطانی محدودشده که میتوکندریها (به رنگ ماژنتا) در محیط پیرامون هسته تجمع کرده و در فرو رفتگیها (حفرههای هستهای) دیده میشوند؛ هسته به رنگ فیروزهای نمایش داده شده است. اعتبار تصویر: Rito Ghose and Fabio Pezzano/Centro de Regulación Genómica
برای بررسی اینکه آیا این بازآرایی سطح انرژی هسته را تغییر میدهد یا نه، تیم از حسگر فلورسانس ATP که بهطور اختصاصی به هسته هدفگذاری شده بود استفاده کرد. ظرف چند ثانیه پس از فشردهسازی، سیگنال ATP هسته تقریباً ۶۰ درصد افزایش یافت. این افزایش در بیش از ۸۰ درصد از سلولهای HeLa محدودشده دیده شد، اما در سلولهای معلق و غیرفشرده عملاً وجود نداشت؛ نشانهای از پاسخ متابولیک سریع و تحریکشده توسط مکانیک.
اهمیت ATP هستهای
تغییر شکل مکانیکی هسته فشار فیزیکی بر کروماتین و DNA وارد میآورد. شکستگیهای دو رشتهای DNA و تنشهای توپولوژیکال نیازمند ماشینآلات تعمیر وابسته به ATP هستند — یعنی آنزیمها و بازسازیکنندههای کروماتین که برای دسترسی و دوبارهبستن DNA خراب انرژی نیاز دارند. این مطالعه نشان داد سلولهایی که افزایش ATP ناشی از NAM را تجربه کردند، ضایعات DNA را ظرف چند ساعت ترمیم کرده و به تقسیم ادامه دادند؛ در حالی که سلولهایی که این پاسخ در آنها تضعیف شده بود، نتوانستند آسیب را برطرف کنند و تکثیر آنها مختل شد.
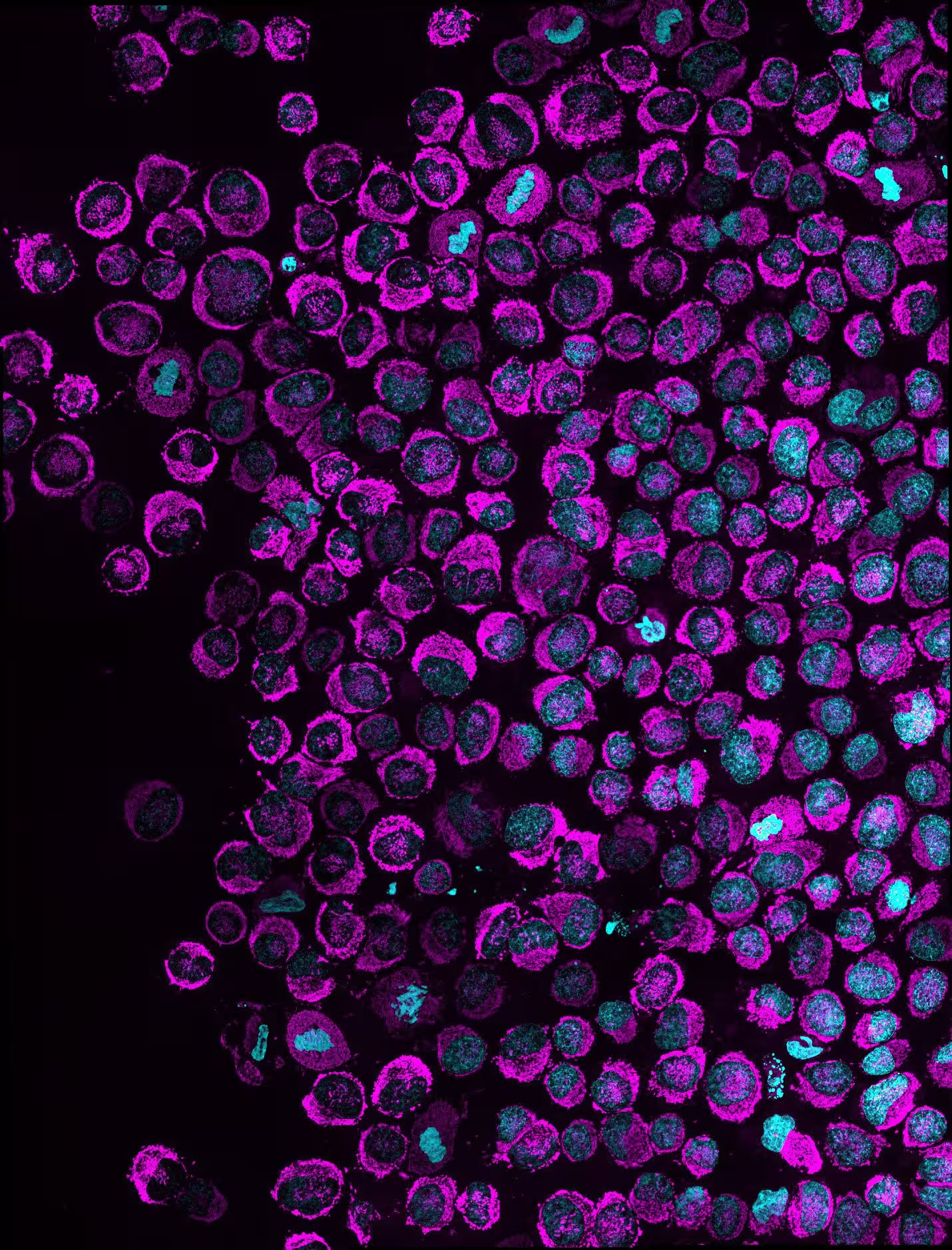
نمای کلی از چند سلول سرطانی محدودشده که میتوکندریها (ماژنتا) و هسته (فیروزهای) را نشان میدهد. سلولهایی که تجمع میتوکندری درون هسته را نشان میدهند، پدیده NAM را نمایان میسازند. در سلولهای HeLa (نمایش دادهشده در تصویر) نفوذپذیری این فنوتیپ در شرایط درونکشتگاهی ۸۳.۶٪ گزارش شد. اعتبار تصویر: Rito Ghose and Fabio Pezzano/Centro de Regulación Genómica
اسکافولد سلولی که NAMها را شکل میدهد و آزمونهای دارویی
نویسندگان ساختارهای سیتوپلاسمی و غشایی را که امکان تجمع میتوکندریها در اطراف هسته را فراهم میکنند، نقشهبرداری کردند. رشتههای اکتین در مجاورت غلاف هسته فشرده شدند، در حالی که شبکهای از آندوپلاسمیک رتیکولوم (ER) یک توری ساخت که در کنار هم میتوکندریها را در سطح هسته محبوس کرد. با اختلال در اکتین با استفاده از لاترانکولین A، این اسکافولد از هم پاشید، شکلگیری NAM متوقف شد و جهش ATP از بین رفت؛ که نشان میدهد شبکه سیتواسکلتال و تماسهای ER–میتوکندری در این فرآیند نقش کلیدی دارند.
این بینش مکانیکی یک احتمال درمانی را مطرح میکند: بهجای مهار کلی عملکرد میتوکندری (که با آسیب به بافتهای سالم همراه خواهد بود)، داروهایی که بهصورت انتخابی اسکافولد یا اتصالدهندههای میتوکندری را مختل میکنند و شکلگیری NAM را مهار میسازند میتوانند تابآوری سلولهای سرطانی در برابر استرس مکانیکی را کاهش داده و تهاجم آنها را محدود کنند. این رویکرد میتواند سمیت سیستمیک ناشی از مهار عمومی میتوکندری را کاهش دهد و در نتیجه چارچوبی برای ضد متاستازهای کمخطرتر فراهم آورد.
شواهدی از نمونههای بیمار و اهمیت بیماریزایی
برای بررسی ارتباط بالینی، تیم بیوپسیهای تومور سینه از ۱۷ بیمار را تحلیل کرد. حلقههای میتوکندری شبیه NAM در جبهههای تهاجمی تومور (۵.۴٪ هستهها) بیشتر از هسته متراکم مرکز تومور (۱.۸٪) دیده شد؛ تقریباً سه برابر غنیسازی که با نقش آنها در تسهیل تهاجم همخوانی دارد. هرچند سهم کلی هستههای مثبت در بافت کم است، غنای فضایی در مرزهای تهاجمی از این ایده پشتیبانی میکند که NAMها در مناطقی فعال میشوند که چالشهای مکانیکی بیشینه است.
نویسندگان تأکید میکنند که این مکانیسم لزوماً منحصر به سرطان نیست. انواع سلولهای متعددی با محدودیتهای مکانیکی مواجهاند — از سلولهای ایمنی که از گرههای لنفوئیدی عبور میکنند تا نورونهای مهاجر یا سلولهایی که در شکلگیری جنین نقش دارند — و ممکن است از تحویل ATP موضعی مشابه برای حفظ یکپارچگی ژنوم تحت فشار استفاده کنند. بهعنوان مثال، سلولهای ایمنی در حین تلمبار و عبور از فضاهای بینبافتی نیازمند انرژی موضعی برای بازسازی کروماتین و حفظ عملکردهای تطبیقی هستند؛ NAMها یا مکانیسمهای مشابه میتوانند پاسخ سریعی فراهم آورند.
پیامدها برای متاستاز و درمان سرطان
این کشف دیدگاه ما را درباره میتوکندری تغییر میدهد؛ آنها بهعنوان پاسخدهندههای پویا که میتوانند سریعاً به نقاط با بیشترین نیاز منتقل شوند شناخته میشوند، نه صرفاً باتریهای ایستا سلول. در زمینه انکولوژی، پیامدها دوگانهاند: اول، پالسهای ATP ناشی از NAM ممکن است به بقای سلولهای سرطانی در حال گردش یا مهاجم کمک کنند تا سختیهای مکانیکی متاستاز را تحمل کنند؛ دوم، ماشینآلات مولکولی که NAMها را ایجاد میکنند میتوانند بهعنوان نقطه ضعف بالقوه شناخته شوند. هدفگیری اسکافولدهای اکتینی، محلهای تماس ER–میتوکندری یا مسیرهای سیگنالی که جابجایی میتوکندری را تحریک میکنند، ممکن است شایستگی متاستاتیک را کاهش دهد و در عین حال سمیت کمتری نسبت به مهارکنندههای عمومی میتوکندری داشته باشد.
نویسندگان اصلی و همکاران این تغییر مفهومی را برجسته کردند. «این یافته ما را وادار میکند نقش میتوکندریها در بدن انسان را بازاندیشی کنیم. آنها دیگر باتریهای ساکن نیستند؛ بلکه مانند امدادگران چابکاند که در موقعیتهای اضطراری فراخوانده میشوند، وقتی سلولها عملاً تحت فشار تا حد نهایی قرار میگیرند»، دکتر سارا اسدلچی، یکی از نویسندگان مسئول، گفت. دکتر فابیو پزانو، همنویسنده اول، افزود: «این نشانه روشنی است که سلولها به فشار سازگار میشوند و متابولیسم خود را بازهایندی میکنند.»
دکتر ریتوبراتا (ریتو) غوشه، همنویسنده اول، اشاره کرد که وجود NAMها در بیوپسیهای بیماران اهمیت بالینی یافته را تقویت کرد: مشاهده نشانواره خارج از محیط آزمایشگاهی تیم را قانع کرد که این پدیده در تومورها معنای واقعی دارد. دکتر ورنا روپرهشت، یکی از نویسندگان مسئول، پیشنهاد داد که پاسخهای ناشی از استرس مکانیکی یک آسیبپذیری کمتر بررسیشده در زیستشناسی سرطان هستند که میتوانند راههای درمانی جدیدی را بگشایند.
دیدگاه کارشناسی
«این کار بهطور هنرمندانهای نیروهای مکانیکی را به بازتوزیع انرژی زیرسلولی و تعمیر DNA پیوند میزند»، میگوید دکتر ایلاین مورگان، زیستشناس سلولی (کارشناس ساختگی) که روی مکانیک سیتواسکلتال مطالعه میکند. «اگر بتوانیم تترهای مولکولی را که میتوکندریها را هنگام محدودیت فشرده نگه میدارد تعریف کنیم، ممکن است بتوان مولکولهای کوچک یا بیولوژیکهایی طراحی کرد که بهطور انتخابی آن جابجایی را در سلولهای توموری مسدود کنند بدون اینکه متابولیسم سیستمیک را مختل سازند. این میتواند پیشرفت بزرگی در درمان ضدمتاستاز باشد.»
نتیجهگیری
کشف میتوکندریهای وابسته به هسته (NAMها) و تحویل سریع ATP در شرایط محدودیت مکانیکی، لایه جدیدی از سازگاری سلولی را نمایان میسازد. با تأمین مستقیم انرژی به هسته، میتوکندریها به حفظ یکپارچگی ژنوم در طول استرس فیزیکی کمک میکنند — قابلیتی که سلولهای سرطانی از آن برای بقا و تهاجم بهره میبرند. نقشهبرداری از اجزا ساختاری و سیگنالی این پاسخ، اهداف نامزدشدهای برای محدودسازی متاستاز معرفی میکند در حالی که بافت طبیعی حفظ شود. پژوهشهای بعدی لازم است تا گستردگی شکلگیری NAM در انواع سلولی مختلف تعیین شود و مشخص گردد آیا مهارکنندههای گزینشی قابلتوسعهاند که این سوئیچ بقا تحت فشار مکانیکی را در سرطان بهصورت ایمن مسدود کنند یا خیر. همچنین شایان ذکر است که مطالعه دقیقتر مسیرهای سیگنالینگیِ فعالکننده انتقال میتوکندری به هسته میتواند بینشهای درمانی بیشتری فراهم آورد، از جمله ترکیب احتمالی با داروهای ترمیمکننده DNA یا مهارکنندههای نقاط تماس ER–میتوکندری برای اثربخشی دارویی برتر و عوارض جانبی کمتر.
منبع: scitechdaily

ارسال نظر