9 دقیقه
یک تحلیل بازنگر بزرگ روی نزدیک به نیم میلیون پرونده پزشکی که در سال ۲۰۲۳ منتشر شد، بار دیگر رابطه تکرارشونده بین عفونتهای ویروسی شدید و افزایش خطر ابتلا به بیماریهای تحلیلبرنده عصبی مانند آلزایمر و پارکینسون را نشان داد. محققان پس از بررسی سوابق چندین گروه همگن، ۲۲ ارتباط قابل تکرار بین مواجهه ویروسی قبلی و بروز بعدی زوال عصبی شناسایی کردند. این نتایج بر این ایده تأکید میکند که برخی بیماریهای ویروسی و التهاب ناشی از آنها در سیستم عصبی ممکن است عوامل خطری قابلتغییر برای زوال عقل و اختلالات مرتبط باشند.
طراحی مطالعه و نتایج کلیدی که باید بدانیم
محققان از یک رویکرد اپیدمیولوژیک و دادهمحور برای جستجو در پروندههای پزشکی بهدنبال پیوند بین تشخیصهای ویروسی و شش بیماری عمده تحلیلبرنده عصبی استفاده کردند. در فاز کشف اولیه، حدود ۳۵٬۰۰۰ بیمار فنلاندی مبتلا به زوال عصبی با ۳۱۰٬۰۰۰ کنترل همسان مقایسه شدند. این تحلیل اولیه ۴۵ همبستگی نامزد تولید کرد که سپس در مجموعهای مستقل از دادهها—بانک زیستی بریتانیا (UK Biobank) با نزدیک به ۱۰۰٬۰۰۰ پرونده—آزمون و سرانجام به ۲۲ پیوند قوی محدود شدند.
برخی از یافتههای برجسته عبارت بودند از ارتباط چشمگیر بین انسفالیت ویروسی (التهاب مغز ناشی از عفونت ویروسی) و بروز بعدی آلزایمر: بیمارانی که سابقه انسفالیت ویروسی داشتند، شانس قابلتوجهی برای توسعه بیماری آلزایمر در سالهای بعد نشان دادند. همچنین عفونتهای شدید تنفسی مانند پنومونی پس از آنفلوآنزا با افزایش خطر آلزایمر، زوال عقل، پارکینسون و اسکلروز جانبی آمیوتروفیک (ALS) همراه بودند. عفونتهای ویروسی رودهای، مننژیت ویروسی و بازفعالسازی ویروس واریسلا-زوستر (عامل زونا) نیز با چند خروجی نورودژنراتیو در ارتباط بودند.
نکته مهم دیگر این است که برخی از این همبستگیها تا ۱۵ سال پس از وقوع عفونت پابرجا ماندند. جالب آنکه در هیچیک از نمونهها شواهدی نیافتند که نشان دهد مواجهه ویروسی قبلی خطر زوال عصبی را کاهش میدهد.
چرا برخی ویروسها برای مغز خطرناکترند؟
حدود ۸۰٪ ویروسهایی که در این تحلیل دخیل شناخته شدند، نوروتروپیک بهحساب میآیند—یعنی توانایی عبور از سد خونی-مغزی یا تأثیر مستقیم یا غیرمستقیم روی بافت عصبی را دارند. التهاب عصبی (نوروانفلاسیون) به عنوان عاملی شناختهشده در پاتوژنز آلزایمر، پارکینسون و سایر اختلالات تحلیلبرنده است. ویروسها میتوانند فرآیندهای پاتولوژیک را آغاز یا تسریع کنند؛ برای مثال با القای شکست در تا شدن پروتئینها، فعالسازی مزمن ایمنی یا از دست رفتن نورونها. البته طراحی مشاهدهای مطالعه قادر به اثبات رابطه علی نیست، اما سازوکارهای محتمل بیولوژیک چندگانه وجود دارد:
- عبور از سد خونی-مغزی و ورود مستقیم: برخی ویروسها مستقیماً به سیستم عصبی مرکزی نفوذ کرده و التهاب موضعی ایجاد میکنند.
- فعالسازی میکروگلیا و التهاب مزمن: پاسخ ایمنی قوی میتواند میکروگلیا را برای مدت طولانی فعال نگه دارد و به آسیب نورونی کمک کند.
- خطا در تا شدن پروتئینها: التهاب و استرس اکسیدی ممکن است فرآیندهای همیواستاتیک پروتئین مانند تا شدن صحیح تاو و آلفا-سینوکلئین را مختل کند.
- واکنش متقاطع ایمنی (Molecular mimicry): برخی قطعات ویروسی ممکن است شباهتی به ساختارهای عصبی داشته باشند و منجر به پاسخ خودایمنی شوند.
- بازفعالسازی ویروسهای نهفته: ویروسهایی مثل واریسلا-زوستر در حالت نهفته میمانند و بازفعالسازی آنها میتواند التهاب موضعی یا سیستمی ایجاد کند که به مغز آسیب میزند.
مثالهای بالینی و مکانیک مولکولی
تصور کنید یک بیمار مسن پس از یک دوره شدید پنومونی ناشی از آنفلوآنزا چند ماه بعد دچار کندی شناختی و فراموشی میشود؛ آیا رابطهای علت-معلولی وجود دارد؟ ممکن است. پنومونی یا سپسیس میتواند پاسخ التهابی سیستمی را فعال کند که ورود سیتوکینها را به مغز تشدید و سد خونی-مغزی را تضعیف کند. در مغز، میکروگلیا فعال شده تولید عوامل التهابی میکند که موجب آسیب سیناپسی و تسریع تجمع پروتئینهای نامعمول میشود. این سیکل میتواند به تدریج توانایی شناختی را کاهش دهد و در افراد مستعد، بیماریهایی مانند آلزایمر یا پارکینسون را زودتر بروز دهد.
شواهد قبلی و دادههای مکمل
نتایج این تحلیل بزرگ با کارهای قبلی همخوانی دارد. برای نمونه، یک مطالعه در سال ۲۰۲۲ ارتباط بین عفونت Epstein–Barr و افزایش خطر ابتلا به بیماری مولتیپل اسکلروزیس (MS) را گزارش کرد. همچنین مطالعاتی روی فصلپذیری شیوع بیماریهای نورودژنراتیو، شواهدی از نقش عفونتهای دورهای و واکنشهای ایمنی در طولانیمدت ارائه دادهاند. چنین مدارک جمعی، الگوی گستردهتری را پیشنهاد میکند که در آن مواجهات شایع ویروسی ممکن است در افراد آسیبپذیر پیامدهای عصبی بلندمدت داشته باشند.
چه چیزهایی این مطالعات را تکمیل میکند؟
- تحقیقات مکانیکال در مدلهای حیوانی برای اثبات مسیرهای علیتی (مثلاً نشان دادن اینکه یک ویروس خاص سبب تجمع پروتئین تاو یا آلفا-سینوکلئین میشود).
- مطالعات طولی بالینی با نمونهگیری از مایع مغزی-نخاعی (CSF)، تصویرسازی مغزی و بیومارکرهای ایمنی پیش از و پس از عفونت.
- آزمونهای تصادفی کنترلشده برای ارزیابی اثربخشی اقدامات پیشگیرانه مثل واکسیناسیون یا درمان ضدویروسی در کاهش خطر نورودژنراسیون.
- تحلیلهای جمعیتی بیشتر برای کنترل عوامل مزاحم (confounders) و کاهش سوگیری تشخیصی.
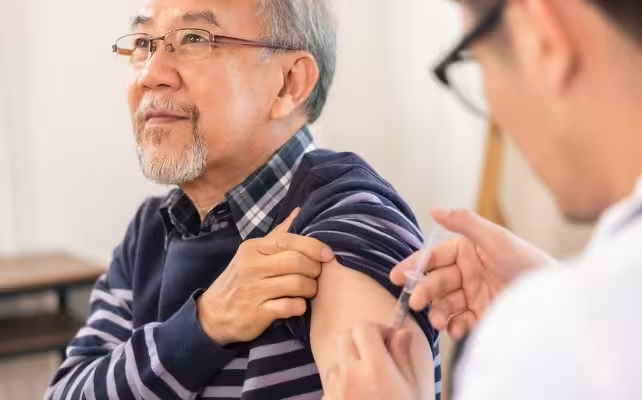
پیامدهای بهداشت عمومی؛ واکسیناسیون، پیشگیری و اولویتها
نویسندگان مطالعه تأکید میکنند که برای چندین پاتوژن مورد اشاره واکسن موجود است—از جمله واکسنهای آنفلوآنزا، پنوموکوک و واریسلا-زوستر—و واکسیناسیون میتواند بستری شدن و بیماری شدید را کاهش دهد. اگرچه واکسنها همه عفونتها را از بین نمیبرند، کاهش شدت بیماریهای ویروسی و التهاب سیستمیک و عصبی میتواند بهصورت محتملی خطر زوال عصبی بعدی را در سطح جمعیت کاهش دهد.
اقدامات عملی برای سیستم بهداشت و مراقبتهای اولیه
- افزایش پوشش واکسیناسیون در جمعیتهای پرخطر مانند سالمندان و افراد مبتلا به بیماریهای مزمن.
- بهبود شناسایی و مدیریت سریع عفونتهای جدی برای کاهش مدت و شدت التهاب سیستمی.
- گنجاندن تاریخچه عفونتهای شدید یا بستریشدنهای ویروسی در ارزیابی ریسک شناختی بیماران.
- تقویت مطالعات نظارتی طولی برای پیگیری پیامدهای شناختی در بیماران پس از عفونت شدید.
محدودیتها و نقد روششناسی که باید در نظر گرفت
مطالعه مورد بحث با اینکه بزرگ و چندمجموعهای است، اما محدودیتهای ذاتی طراحیهای بازنگر و مشاهدهای را دارد. مهمترین نکات انتقادی عبارتاند از:
- عدم توانایی در اثبات علیت: همبستگی لزوماً به معنای علتومعلول نیست؛ ممکن است عوامل مشترکی ریسک هر دو را افزایش دهند.
- اختلاف در دسترسی به مراقبتهای بهداشتی و کدگذاری تشخیصی: تفاوت در نحوه ثبت بیماریها و دسترسی به تشخیص ممکن است باعث سوگیری شود.
- سوگیری تشخیصی (Detection bias): افرادی که به دلایل دیگر بیشتر تحت مراقبت هستند ممکن است هم عفونتها و هم زوال عصبی را بهتر تشخیص دهند.
- پوشش ناقص عوامل مخدوشکننده: اطلاعات کامل از سبک زندگی، سن، وضعیت اجتماعی-اقتصادی یا سایر عوامل خطر شاید در تمام پایگاهها در دسترس نبوده است.
- بازگشتپذیری و حافظه تاریخی: اتکا به پروندههای پزشکی به معنی احتمال از دست رفتن موارد بدون ثبت رسمی یا عفونتهای بیعلامت است.
بههمین دلایل، محققان خواستار مطالعات آتی با طراحی پیشرو (prospective)، مطالعات مکانیکی در سطح سلولی و حیوانی و آزمونهای تصادفی شده برای تعیین اینکه آیا مداخلههای هدفمند میتوانند خطر را کاهش دهند، شدهاند.
چه سؤالات پژوهشی بعدی باید پرسیده شود؟
- آیا جلوگیری از بستری یا کاهش شدت عفونت (مثلاً با واکسن یا ضدویروس) به طرز قابلتوجهی خطر زوال عصبی را کاهش میدهد؟
- کدام ویروسها بیشترین نقش را دارند و در کدام زیرگروههای جمعیتی؟
- چه بیومارکرهایی میتوانند نشاندهنده آسیب التهابی مغز پس از عفونت باشند؟
- آیا ترکیب عوامل ژنتیکی و محیطی تعیینکننده حساسیت به پیامدهای نورودژنراتیو پس از عفونت است؟
پیشنهاداتی برای مطالعات آینده
ترکیب رویکردهای مختلف میتواند تصویر روشنتری ارائه کند: مطالعات کوهورت طولی با نمونهبرداری دورهای مایع مغزی-نخاعی و تصویرسازی، آزمایشهای حیوانی برای تعیین مسیرهای مولکولی، تحلیلهای ژنتیکی مانند Mendelian randomization برای کاهش اثر مخدوشکننده، و در نهایت کارآزماییهای بالینی برای ارزیابی اثر واکسیناسیون یا درمانهای ضدویروسی بر پیامدهای شناختی بلندمدت.
در سطح عملی، توجه بیشتر به پیشگیری از عفونتهای شدید و بهبود مدیریت آنها در واحدهای مراقبتهای اولیه و بیمارستانی معقول به نظر میرسد. این رویکرد نه تنها میتواند مرگومیر و بستری را کاهش دهد، بلکه ممکن است بار بیماریهای مزمن نورولوژیک را در دهههای آتی کم کند.
در پایان، این مطالعه بزرگ و تحلیلِ گسترده پروندههای پزشکی به ما یادآوری میکند که مغز ما تحت تأثیر تاریخچه عفونتهای زندگی قرار دارد و پیشگیری از بیماریهای ویروسی—همراه با پژوهشهای دقیقتر—میتواند نقش مهمی در محافظت از عملکرد شناختی جمعیتها داشته باشد. شواهد موجود کافی نیست تا نتیجه قطعی بگیریم، اما مسیر تحقیق روشن است: بررسیهای بلندمدت، آزمونهای مکانیکی و مداخلات پیشگیرانه میتواند پاسخهای روشنتری فراهم آورد و راهنمای سیاستگذاریهای بهداشتی آینده باشد.
منبع: sciencealert

ارسال نظر