7 دقیقه
بازاندیشی در آلزایمر: خطای ایمنی در مغز
بیماری آلزایمر را میتوان فراتر از یک اختلالِ تجمع پروتئینی (proteinopathy) دید و بهعنوان وضعیتی که تا حدی توسط پاسخ ایمنیِ درونِ مغز هدایت میشود نیز تبیین کرد. در این دیدگاه در حال ظهور، سلولهای ایمنیِ ساکنِ مغز اجزای سلولهای عصبی را بهاشتباه با عوامل بیگانه یکسانسازی میکنند و واکنش دفاعی مزمنی را آغاز میکنند که بهتدریج عملکرد نورونها را تضعیف کرده و به زوال شناختی منجر میشود. این فعالیت ایمنی مزمن، با گذشت زمان، باعث افت تدریجی حافظه، کاهش توان استدلال و ضعف در انجام امور روزمره میشود که از نشانههای اصلی زوال عقل به شمار میآیند.
نقش دوگانهٔ پروتئین بتا-آمیلوئید در این چشمانداز اهمیت ویژهای دارد. بتا-آمیلوئید که سالها بهعنوان جزء اصلی پلاکهای آمیلوئیدی مورد مطالعه قرار گرفته، ممکن است نقشهای ضد میکروبی یا تقویتی در پاسخ ایمنی ذاتی ایفا کند: بهعنوان یکی از مولفههایی که میتواند میکروبها را خنثی کند و دفاعهای ذاتی را تقویت نماید. متأسفانه، زمانی که بتا-آمیلوئید تجمع مییابد یا تنظیمِ آن مختل میشود، میتواند فعالسازی ایمنی را تشدید کند و حملهای خودمحور به بافت مغزی را پایدار نماید. این فرایند شبیه به واکنشهای خودایمنی میتواند توضیح دهد که چرا درمانهای سرکوبکنندهٔ ایمنی سیستمیک کلاسیکی مانند کورتیکواستروئیدها که در بیماریهایی مثل روماتیسم مفصلی مؤثرند، در آلزایمر اثربخشی محدودی نشان دادهاند — زیرا محیط ایمنیِ مغز و عوامل تنظیمکنندهٔ آن ماهیتی ویژه و متفاوت دارند.
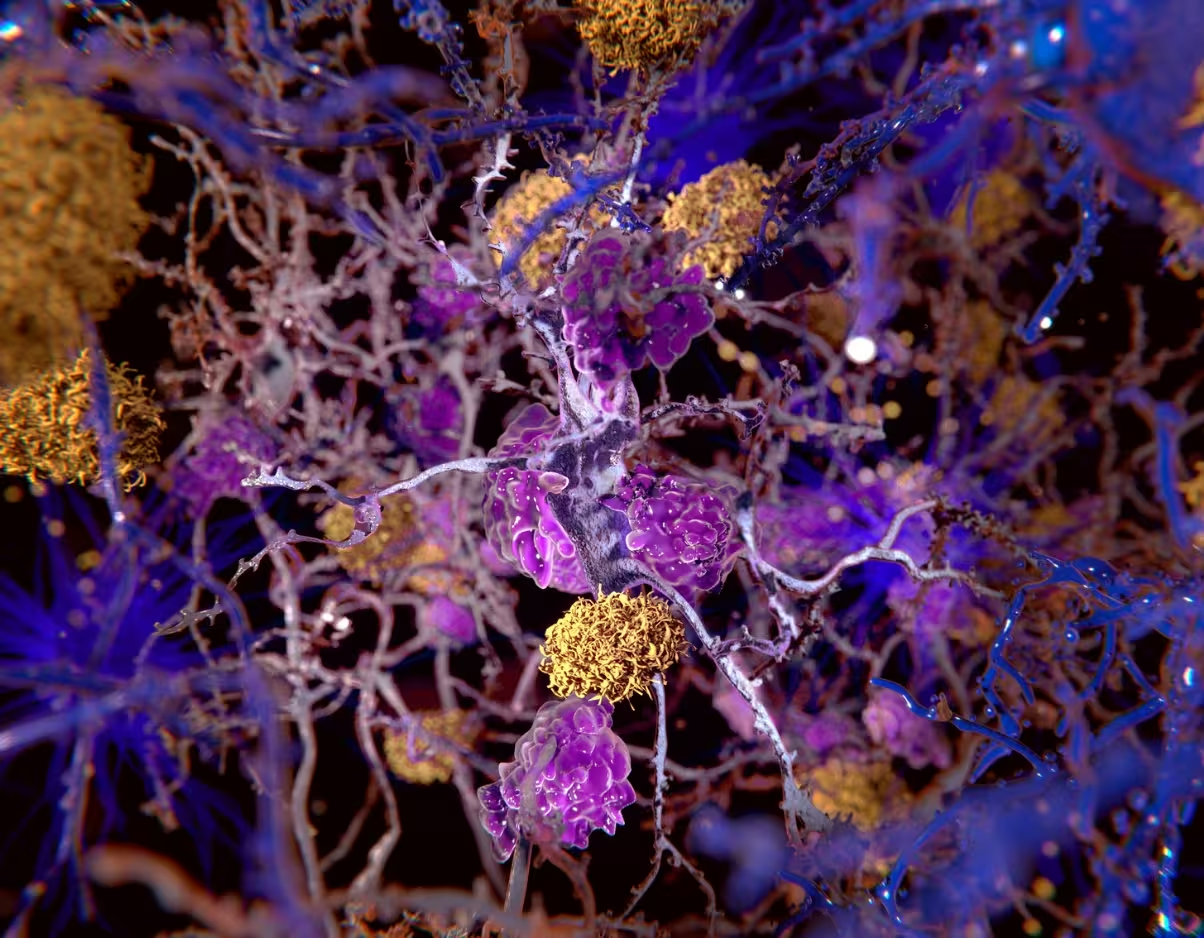
تصویری از پلاکهای بتا-آمیلوئید (زرد) در میان نورونها.
پیشزمینهٔ علمی و فرضیههای جایگزین
تحقیقات مدرن فراتر از یک توضیح یگانه برای آلزایمر پیش میروند و نظریههای مختلف و گاه مکملی مطرح شدهاند که هر یک از زاویهای متفاوت به مکانیسمهای آسیب عصبی میپردازند. برخی از این فرضیهها عبارتند از:
- اختلال میتوکندریایی: میتوکندریها نیروگاهِ سلول هستند که اکسیژن و گلوکز را به انرژی قابل استفاده تبدیل میکنند. اگر عملکرد میتوکندری در نورونها کاهش یابد، کمبود انرژیِ حاصل میتواند پردازش شناختی و ثبات حافظه را تضعیف کند و به فرایندهای نورودژنراتیو کمک نماید. پژوهشهای زیستشناسی سلولی و متابولیسم نورونها نشان دادهاند که نقصهای تولید انرژی و افزایش استرس اکسیداتیو میتواند زمینهساز تجمع پروتئینهای سمی و آسیب سیناپسی باشد.
- عفونت مزمن: برخی از پژوهشگران مطرح کردهاند که عفونتهای مکرر یا پایدار — از جمله مهاجرت باکتریهای دهانی به مغز — میتوانند آبشاری از التهاب را فعال کنند که در نهایت به زوال عقل منجر شود. دادههایی وجود دارد که نشان میدهد پاسخ ایمنی به پاتوژنها ممکن است تولید بتا-آمیلوئید را تحریک کند و این پاسخ محافظتی اولیه، در صورت ادامه یا تبدیل به پاسخ التهابی مزمن، زیانبار شود.
- عدم تعادل فلزات: اختلال در مدیریت فلزات ضروری مانند روی، مس یا آهن ممکن است بیوشیمی نورونها را دگرگون و تجمع پروتئینهای سمی را تسهیل کند. فلزات میتوانند در فرایندِ تشکیل پلاکهای آمیلوئیدی و همچنین در واکنشهای اکسیداتیو مشارکت داشته باشند؛ بنابراین بیثباتی هومئوستاز فلزی یکی از مسیرهای مکانیکی محتمل در آسیب عصبی است.
این نظریهها لزوماً در تضاد با هم نیستند و میتوانند با یکدیگر تداخل یا همافزایی داشته باشند. برای مثال، یک عفونت میتواند تولید بتا-آمیلوئید را بهعنوان یک پاسخ حفاظتی تحریک کند؛ اما در افراد آسیبپذیر، تجمعِ طولانیمدت آن ممکن است به التهابی مضر تبدیل شود که چرخهای خودتقویتی از آسیب و پاسخ ایمنی را راهاندازی میکند. به همین دلیل، تحلیل دقیقِ تعاملات میان میکروگلیا، بتا-آمیلوئید، میتوکندری و فلزات ضروری برای درک کاملِ پاتوفیزیولوژی آلزایمر حیاتی است.
پیامدها برای درمان و پژوهش
اگر اشتباههدایتشدنِ پاسخ ایمنی در سیستم عصبی مرکزی نقش مهمی در آلزایمر داشته باشد، راهبردهای درمانی باید به مسیرهای ایمنی اختصاصیِ مغز هدفگیری شوند. این رویکرد نیازمند تمرکز بر مولفههای بیولوژیکِ منحصر به سیستم عصبی مرکزی است، از جمله تنظیم عملکرد میکروگلیا (سلولهای ایمنی مقیم مغز)، توسعهٔ داروهای ضدالتهابی هدفمند که توان عبور از سد خونی-مغزی (blood-brain barrier) را دارند، و روشهایی که دینامیک سالمِ بتا-آمیلوئید را بدون حذف نقشهای حفاظتی آن بازسازی میکنند. توسعهٔ نشانگرهای زیستی (biomarkers) که بتوانند پاسخهای ضد میکروبیِ مفید را از خودایمنیِ پاتولوژیک متمایز کنند، برای هدایت درمانهای دقیق و شخصیسازیشده ضروری خواهد بود.
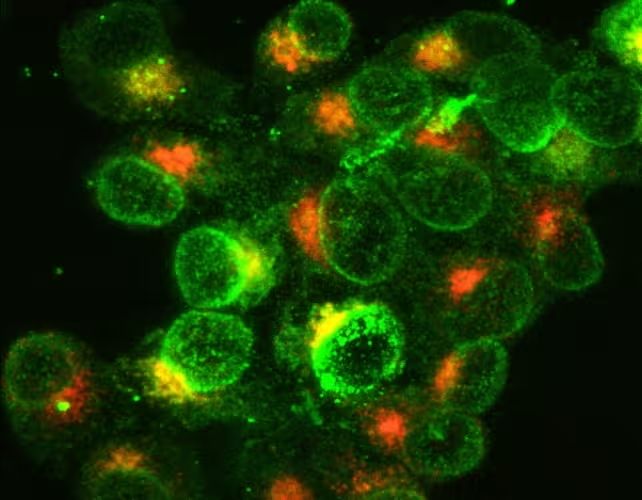
گلبولهای سفید دستگاه ایمنی که برای مقابله با عفونت باکتریایی فعال شدهاند. رنگ سبز بیان مولکولها روی سطح سلول را نشان میدهد و رنگ نارنجی بیان مولکولهای درون سلولی را نشان میدهد.
حد و اندازهٔ پیامدهای جمعیتی (public-health) بسیار گسترده است: زوال عقل بیش از 50 میلیون نفر را در سراسر جهان تحت تأثیر قرار میدهد و هر چند ثانیه یک تشخیص جدید ثبت میشود. فراتر از هزینهٔ انسانی برای بیماران و خانوادهها، بار اقتصادیِ بر سیستمهای بهداشتی و مراقبت بلندمدت نیازمند راهحلهای نوآورانه با مبنای مکانیکی قوی است. بهعنوان نمونه، تشخیص بهموقع بر اساس بیومارکرهای ایمونولوژیک یا تصویربرداریِ نفوذپذیرتر به مغز میتواند هزینههای بلندمدت مراقبت را کاهش دهد و کیفیت زندگی را بهبود بخشد.
اولویتهای پژوهشی و چشمانداز آینده
پیشرفت در این حوزه مستلزم همکاریهای بینرشتهای است که عصبشناسی، ایمنولوژی، بیماریهای عفونی و شیمی زیستنافلزی (bioinorganic chemistry) را به هم پیوند دهد. مطالعات طولی در مقیاس بزرگ که سیر زمانیِ تغییرات مولکولی و سلولی را دنبال میکنند، توسعهٔ عوامل تصویربرداری که بهتر از سد خونی-مغزی عبور کنند، و کارآزماییهای درمانی که بهطور مشخص سیگنالینگ نورواِمنی (neuroimmune signaling) را دستکاری میکنند از اولویتهای کلیدی به شمار میروند. علاوه بر این، طراحی مدلهای آزمایشگاهی و حیوانی که تعاملات میان میکروارگانیسمها، پاسخ ایمنی، متابولیسم میتوکندریایی و هومئوستاز فلزی را بهتر بازتولید کنند، برای آزمونِ فرضیههای چندوجهی حیاتی است.
صرفنظر از اینکه در نهایت آلزایمر عمدتاً خودایمنی، عفونی، متابولیک یا ترکیبی از این مکانیسمها شناخته شود، بازتعریف بیماری حول محورِ تنظیم ایمنیِ مغزی مسیرهای جدیدی برای تشخیصهای زودهنگام، نشانگرهای دقیقتر، و درمانهای هدفمند باز میکند. این رویکرد میتواند منجر به استراتژیهایی شود که نه تنها تجمع پلاکها را هدف قرار میدهند، بلکه فرایندهای التهابی مزمن، اختلالات متابولیک نورونی و عوامل زیستمحیطی-میکروبی را نیز اصلاح میکنند.

نتیجهگیری
دیدن آلزایمر از منظرِ تمرکز بر ایمنیِ مغزی، فروتنانه بسیاری از مفروضات قدیمی را بازاندیشی میکند و اهداف جدیدی برای مداخله ارائه میدهد. ادامهٔ پژوهش در مورد چگونگی تعامل بتا-آمیلوئید، میکروگلیا، میتوکندری، پاتوژنها و فلزات در مغز پیرییافته برای پیشگیری و درمان این بحران سلامت جهانی ضروری است. بهعلاوه، ترکیب بینشهای مولکولی با دادههای بالینی و اپیدمیولوژیک میتواند به تولید درمانهای دقیقتری منجر شود که هم ایمنیِ مغز را تعدیل کنند و هم نقشهای حفاظتی مولکولهایی مانند بتا-آمیلوئید را حفظ نمایند.
منبع: sciencealert
نظرات
مهدی
من خودم سالها تو بیمارستان کار کردم، التهاب مزمن واقعا مغز رو خسته میکنه، این رویکرد ایمنی منطقیه ولی عملی کردنش خیلی پیچیده است، امیدوارم مدلهای بهتر بیاد
لابکور
اگه آمیلوئید واقعاً نقش ضد میکروبی داشته باشه یعنی درمانها باید خیلی دقیقتر باشن... اما شواهد انسانی هنوز متناقضن، آیا اینطور نیست؟

ارسال نظر