9 دقیقه
دانشمندان مرکز پزشکی بیمارستان کودکان سینسیناتی، در همکاری با شرکت Roche، یک پلتفرم مینیاتوری کبد انسان ساختهاند که قادر است واکنشهای دارویی ناشی از سیستم ایمنی را که تنها در برخی بیماران دیده میشود، مدلسازی کند. با ترکیب سلولهای بنیادی مشتق از بیمار با سلولهای ایمنی خود او، تیم تحقیقاتی نوع نادری از آسیب کبدی ناشی از دارو را در آزمایشگاه بازتولید کرد — پیشرفتی که میتواند روشهای آزمایش ایمنی داروها را متحول سازد.
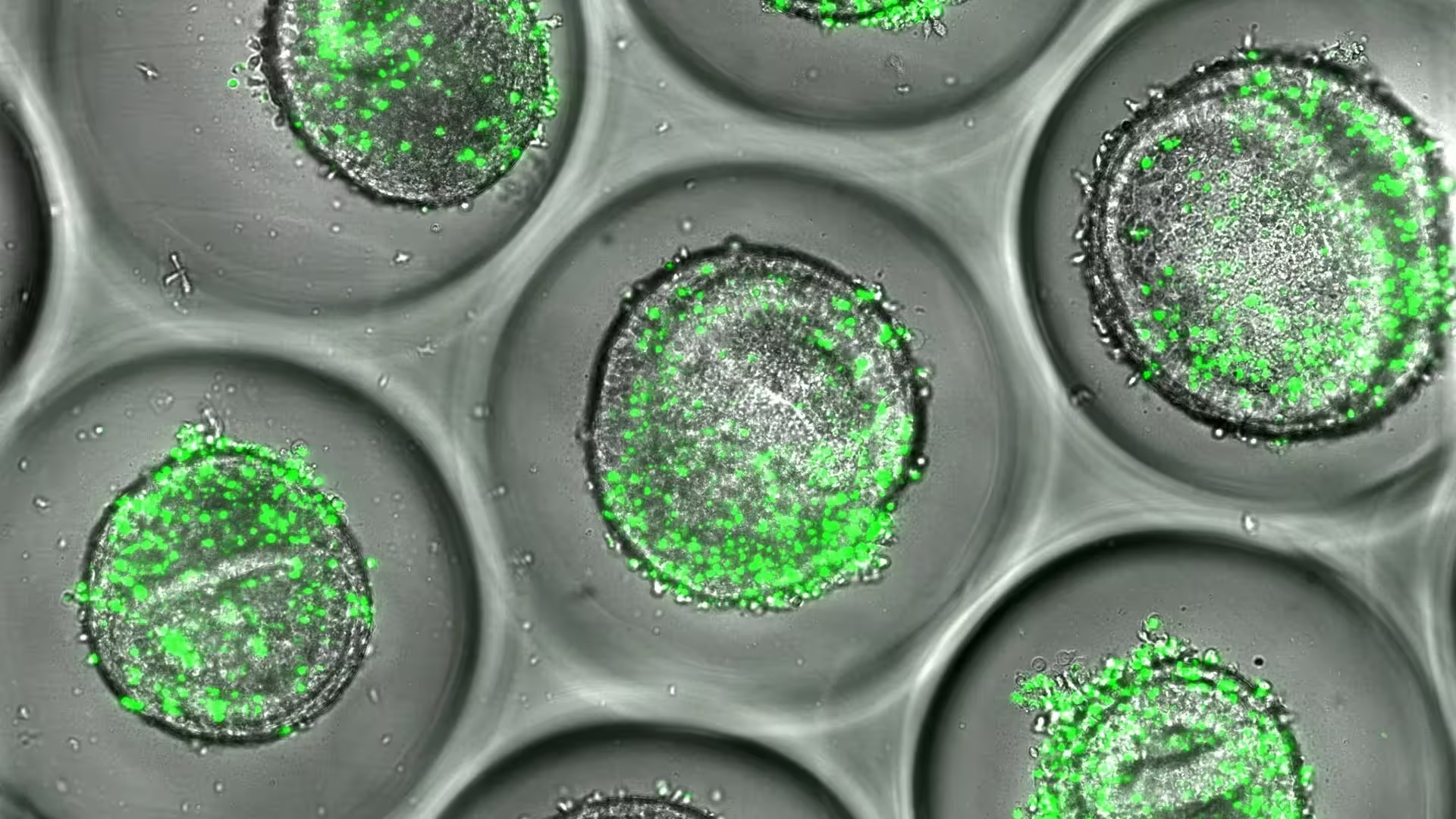
نمونهای از ارگانوئیدهای کبدی انسانی که همراه با سلولهای CD8 خودی (به رنگ سبز) همکشت شدهاند. بر اساس پژوهش تازه منتشرشده توسط متخصصان مرکز کودکان سینسیناتی، این بافتهای کوچک میتوانند در فرایند توسعه دارو برای پیشبینی سمیت کبدی مورد استفاده قرار گیرند.
کبد کشتشده در آزمایشگاه که سابقه ژنتیکی بیمار را بازتولید میکند
آسیب کبدی ناشی از دارو (DILI) یکی از علل اصلی نارسایی حاد کبدی و از دلایل شایع جمعآوری داروها از بازار است. بسیاری از آزمونهای پیشبالینی قادر به پیشبینی انواع نادری از DILI نیستند که توسط سیستم ایمنی و بر پایه ویژگیهای ژنتیکی فرد رخ میدهد — که به آن DILI ایدیوپاتیک یا idiosyncratic DILI (iDILI) گفته میشود. پلتفرم جدید این نقطهکوری را با ایجاد مدلی انسانی و دارای توان ایمنی که پیشینه ژنتیکی بیمار را در خود دارد، جبران میکند.
در این سامانه، از سلولهای بنیادی پرتوان القا شده (iPSCs) که از اهداکنندگان مشتق شدهاند، برای رشد ارگانوئیدهای سهبعدی کبدی استفاده میشود. این بافتهای مینیاتوری سپس با سلولهای CD8+ همان اهداکننده جفت میشوند — سلولهای ایمنی که در صورت شناسایی الگوهای مولکولی مرتبط با دارو، ممکن است به اشتباه به سلولهای کبدی حمله کنند. این میکروآرایه حاصل، هویت ژنتیکی و ایمنی فرد را حفظ میکند و به پژوهشگران اجازه میدهد تا مشاهده کنند چگونه ترکیبهای خاص ژنتیکی و ایمنی موجب التهاب، آزادسازی سایتوکاینها و آسیب سلولی میشوند.
این رویکرد، با دربرگرفتن تفاوتهای فردی نظیر انواع آللهای HLA، وضعیت بیان ژن و پاسخ سلولی-T، امکان بررسی مکانیسمهای مولکولی و ایمنی که در آزمایشات حیوانی یا فرهنگهای سلولی ساده قابل مشاهده نیستند را فراهم میآورد. بهعلاوه، استفاده از iPSCها امکان ایجاد آرشیو اهداکنندگان با پروفایلهای ژنتیکی مختلف را میدهد که برای سمشناسی دقیق و پزشکی دقیق ضروری است.
چگونه میکروآرایه ارگانوئید، آسیب واقعی دارویی را بازتولید میکند
به عنوان اثبات مفهوم، تیم پژوهشی داروی فلُکلُکساسیلین (flucloxacillin) را آزمود؛ آنتیبیوتیکی که شناخته شده تنها در افرادی که حامل آلل HLA-B*57:01 هستند میتواند باعث آسیب کبدی شود. مدلهای سنتی بهندرت این اثر را نشان میدهند، اما همکشت ارگانوئید و سلول ایمنی، نشانههای کلاسیک آسیب کبدی واسطهشده توسط ایمنی را تولید کرد: فعال شدن سلولهای CD8+، افزایش سیگنالینگ التهابی و آسیب سنجشپذیر هپاتوسیتها. این تطابق نزدیک با مشاهدات بالینی، وعدهدهنده بودن این روش را برای سمشناسی پیشبینانه تقویت میکند.
در سطح مولکولی، مکانیزم ممکن است شامل تشکیل هپتن یا تغییرات مولکولی در حضور دارو باشد که توسط مولکولهای HLA ارائه شده و باعث تحریک پاسخ سلولهای T خاص میشوند. در آزمایشها، تیم از مجموعهای از ارزیابیها شامل سنجش آنزیمهای کبدی (ALT/AST)، آزمایشات آزادسازی LDH، پانلهای سایتوکاین مانند IFN-γ و TNF-α، آنالیز جریانشناسی (flow cytometry) برای اندازهگیری نشانگرهای فعالشدن CD8، و تصویربرداری با وضوح بالا برای دنبال کردن مرگ سلولی استفاده کرد. ترکیب این شاخصها به تعیین اینکه آیا واکنش مشاهدهشده واقعاً ایمنیواسطه و مرتبط با پروفایل ژنتیکی است کمک کرد.
نویسندگان اصلی، Fadoua El Abdellaoui Soussi, PhD و Magdalena Kasendra, PhD، توضیح میدهند که اضافه کردن سلولهای ایمنی اختصاصی بیمار، عنصر مفقوده برای بازتولید واکنشهای ایدیوپاتیک بوده است. کازندرا، مدیر تحقیق و توسعه در مرکز سلولهای بنیادی و داروی ارگانوئیدی (CuSTOM) در بیمارستان کودکان سینسیناتی، تأکید میکند که هدف، ثبت زیستشناسی انسانی در قالبی قابل گسترش و قابل تکرار است تا فرایند توسعه داروها زودتر و قابل اعتمادتر اطلاعرسانی شود.
از روش تا درمان: پیشرفتهای فنی کلیدی
این پلتفرم بر پایه نوآوریهای پیشین در حوزه ارگانوئید ساخته شده و از فناوری میکروآرایه بدون ماتریکس (matrix-free microarray) و اصلاحاتی که در آزمایشگاههای باتجربه در تولید ارگانوئیدهای قوی کبدی از iPSCها توسعه یافته، بهره میبرد. این ترکیب امکان پردازش بالاتر (high throughput) نسبت به کشتهای ارگانوئیدی سنتی فراهم میکند در حالی که ویژگیهای کلیدی پاسخ ایمنی انسانی را حفظ مینماید. مشارکت با Roche عامل بحرانی در این پروژه بود، چرا که تخصص و منابع در زمینه سمشناسی ترجمهای (translational toxicology) را فراهم آورد تا توسعه و اعتبارسنجی تسریع شود.
علاوه بر بازتولید یک تعامل ژن-دارو، پژوهشگران در حال خودکارسازی آزمایشها و گسترش بانک اهداکنندگان برای پوشش تنوع ژنتیکی وسیعتر هستند. هدف، ایجاد یک سامانه غربالگری است که بتواند خطرات احتمالی سمیت ایمنیمحور را در سطح جمعیت قبل از ورود داروها به آزمایشهای بالینی شناسایی کند. چنین قابلیتی میتواند ریسک برای بیماران را در مراحل بعدی کاهش دهد و از شکستهای پرهزینه در مراحل نهایی توسعه دارو جلوگیری کند.
از منظر فنی، مجموعهای از روشها برای افزایش مقیاسپذیری و حفظ وفاداری زیستی به کار گرفته میشوند: تایپینگ HLA دقیق برای هر اهداکننده، استفاده از تکنیکهای تکسلولی مانند single-cell RNA-seq برای درک پاسخهای سلولی، ادغام دستگاههای تصویربرداری اتوماتیک و الگوریتمهای تحلیل داده برای استخراج نشانگرهای پیشبینیکننده، و پیادهسازی کنترل کیفی استاندارد برای تضمین تکرارپذیری نتایج بین آزمایشگاهها.
پیامدها برای بیماران و توسعهدهندگان دارو
برای بیماران، این پلتفرم چشماندازی به سوی آیندهای فراهم میکند که در آن آزمایشهای ایمنی، ریسک ژنتیکی فردی را مدنظر قرار میدهند. تصور کنید دارویی در مرحله پیشبالینی باشد و مورد آزمایش با مجموعهای از زوجهای ارگانوئید-ایمنی قرار گیرد که نماینده هزاران پروفایل ژنتیکی متفاوت هستند. توسعهدهندگان میتوانند زیردستههای آسیبپذیر را زود شناسایی کنند و برای حفاظت از این بیماران، طراحی آزمایشها یا تشخیصهای همراه (companion diagnostics) را در نظر بگیرند.
برای صنعت داروسازی، مدلهای انسانی مقیاسپذیر که سمیت ایمنیمحور را آشکار میکنند میتوانند نرخ خروج محصول از خط توسعه را پایین بیاورند، فرایند تصمیمگیری را تسریع کنند و در نهایت هزینههایی را که با شکستهای دیرهنگام مرتبط است کاهش دهند. این کار همچنین پزشکی بازساختی و سمشناسی دقیق (precision toxicology) را تقویت میکند، زیرا علم سلولهای بنیادی را با آزمایشهای ایمنی کاربردی پیوند میزند — یک ادغام که چندین شریک بیوتک و سازنده ابزار، از جمله Molecular Devices و Danaher، از آن پشتیبانی میکنند.
دیدگاه کارشناسی
«این یک گام محوری به سوی سمشناسی واقعاً پیشبینانه است،» دکتر النا مورا، فارماکولوژیست بالینی در دانشگاه آکسفورد (نقلقول برای زمینه ارائه شده است)، میگوید. «با مدلسازی تعامل سیستم ایمنی بیمار با بافت کبدی خودش، پژوهشگران میتوانند الگوهایی را کشف کنند که آزمونهای حیوانی یا کشتهای سلولی منفرد از آن غافل میمانند. این روش جایگزین آزمایشهای بالینی نخواهد شد، اما آنها را هوشمندتر و امنتر میکند.»
چالشها و مسیر پیش رو
علیرغم نویدبخشی، چالشهایی باقی است. افزایش تولید ارگانوئیدها در مقیاس بالا در حالی که وفاداری زیستی را حفظ میکند، کار سادهای نیست و تضمین تکرارپذیری آزمایشها در آزمایشگاههای مختلف نیازمند استانداردسازی گسترده است. علاوه بر این، واکنشهای ایمنیمحور چندعاملی هستند: محرکهای محیطی، داروهای همراه (co-medications)، بیماریهای مزمن و حتی وضعیت متابولیک یا میکروبیوم ممکن است خطر را فراتر از ژنتیک و رفتار سلولهای CD8 تغییر دهند. تیم تحقیقاتی این محدودیتها را میپذیرد و در تلاش است تا با اتوماسیون و نمونهبرداری گستردهتر از اهداکنندگان، بخش بیشتری از آن پیچیدگیها را پوشش دهد.
مسائل نظارتی نیز مهماند: برای ادغام این پلتفرمهای ارگانوئیدی در خطوط ایمنی دارویی، نهادهای تنظیمی باید معیارهای اعتبارسنجی، محدوده پذیرش و نحوه گزارش نتایج را تعیین کنند. این مسئله نیازمند همکاری نزدیک بین پژوهشگران، صنعت، و ناظران است تا استانداردهایی ایجاد شود که نتایج قابلاعتماد و قابلپذیرش را تضمین کند.
ملاحظات اخلاقی و مدیریتی درباره جمعآوری نمونههای انسانی، رضایت آگاهانه، و حفظ حریم خصوصی ژنتیکی نیز باید بهخوبی حل شوند. علاوه بر این، هزینههای اولیه راهاندازی و نگهداری بانکهای iPSC و زیرساختهای خودکار ممکن است برای برخی سازمانها سنگین باشد، اگرچه در بلندمدت و در صورت کاهش شکستهای کلان در مراحل بالینی، صرفهجویی قابلتوجهی را میتوان انتظار داشت.
این مطالعه که در مجله Advanced Science در 26 سپتامبر 2025 منتشر شد، موقعیت شتابدهنده CuSTOM بیمارستان کودکان سینسیناتی را به عنوان یکی از پیشگامان ترجمه علم ارگانوئید به ابزارهای عملی تقویت میکند. به گفته نویسندگان، این تلاش حرکتی ابتدایی اما مهم در جهت شخصیسازی ارزیابی ایمنی دارویی است — تغییری که میتواند از آسیب دیدن گروه کوچکی از افراد که در معرض خطر آسیب کبدی ایمنیمحور هستند جلوگیری کند.
با بالغتر شدن پلتفرمهای ارگانوئیدی، نیاز است که مراجع نظارتی، صنعت و پژوهشگران بالینی با همافزایی کار کنند تا این سیستمها را اعتبارسنجی و وارد چرخههای ارزیابی ایمنی کنند. اگر این فرایند موفق شود، نسل بعدی آزمایشهای پیشبالینی انسانیتر، پیشبینانهتر و بهتر در محافظت از بیماران در برابر عوارض دارویی نادر اما شدید عمل خواهد کرد.
منبع: sciencedaily

ارسال نظر