9 دقیقه
دانشمندان از درمانی مبتنی بر نانوذرات جدید استفاده کردهاند تا یک مسیر حملونقل حیاتی در سد خونی‑مغزی (BBB) را در موشها بازسازی کنند و در نتیجه رسوبات سمی آمیلوئید‑بتا مرتبط با بیماری آلزایمر در عرض چند ساعت پاک شوند. پس از سه تزریق، حیواناتی که پیشتر کاهش شناختی نشان داده بودند، عملکردی شبیه به گروه کنترل سالم از خود بروز دادند و این فواید برای ماهها پایدار ماند.
اصلاح دروازه بهجای عبور از آن
برای دههها پژوهشگران سد خونی‑مغزی را بهعنوان مانعی برای تحویل داروها در نظر گرفتهاند — یک دیوارهٔ سلولی فشرده که خیلی از داروها را از ورود به بافت مغز بازمیدارد. گروههای مختلف تلاش کردهاند داروها را با نانوذرات پوشش دهند یا با امواج فراصوت بهطور موقت این سد را باز کنند تا درمانها عبور کنند. اما همکاری بینالمللی به سرپرستی موسسهٔ مهندسی زیستی کاتالونیا (IBEC) و بیمارستان غربی چین دانشگاه سیچوان (WCHSU) دید دیگری را مطرح میکند: ممکن است خودِ BBB در آلزایمر دچار اختلال شده باشد و تعمیر ماشینآلات حملونقل آن بتواند مغز را قادر سازد دوباره زبالههای سمی را دفع کند.
نحوهٔ انجام آزمایش
پژوهشگران نانوذراتی طراحی کردند که صرفاً حامل دارو نیستند؛ بلکه قادرند رفتار سلولی در سطح سد خونی‑مغزی را فعالانه تغییر دهند. هدف مولکولی آنها گیرندهٔ اندوتلیالی LRP1 بود، الگویی از گیرنده که در سطح رو به خون رگهای مغزی بیان میشود و به انتقال آمیلوئید‑بتا از مغز به خون کمک میکند. در مدلهای موشی با ژنتیک شبیه آلزایمر، سه تزریق از این نانوذرات وانگیزشی از رویدادهای مولکولی را القا کرد که مسیر پاکسازی آمیلوئید را بازیابی نمود.
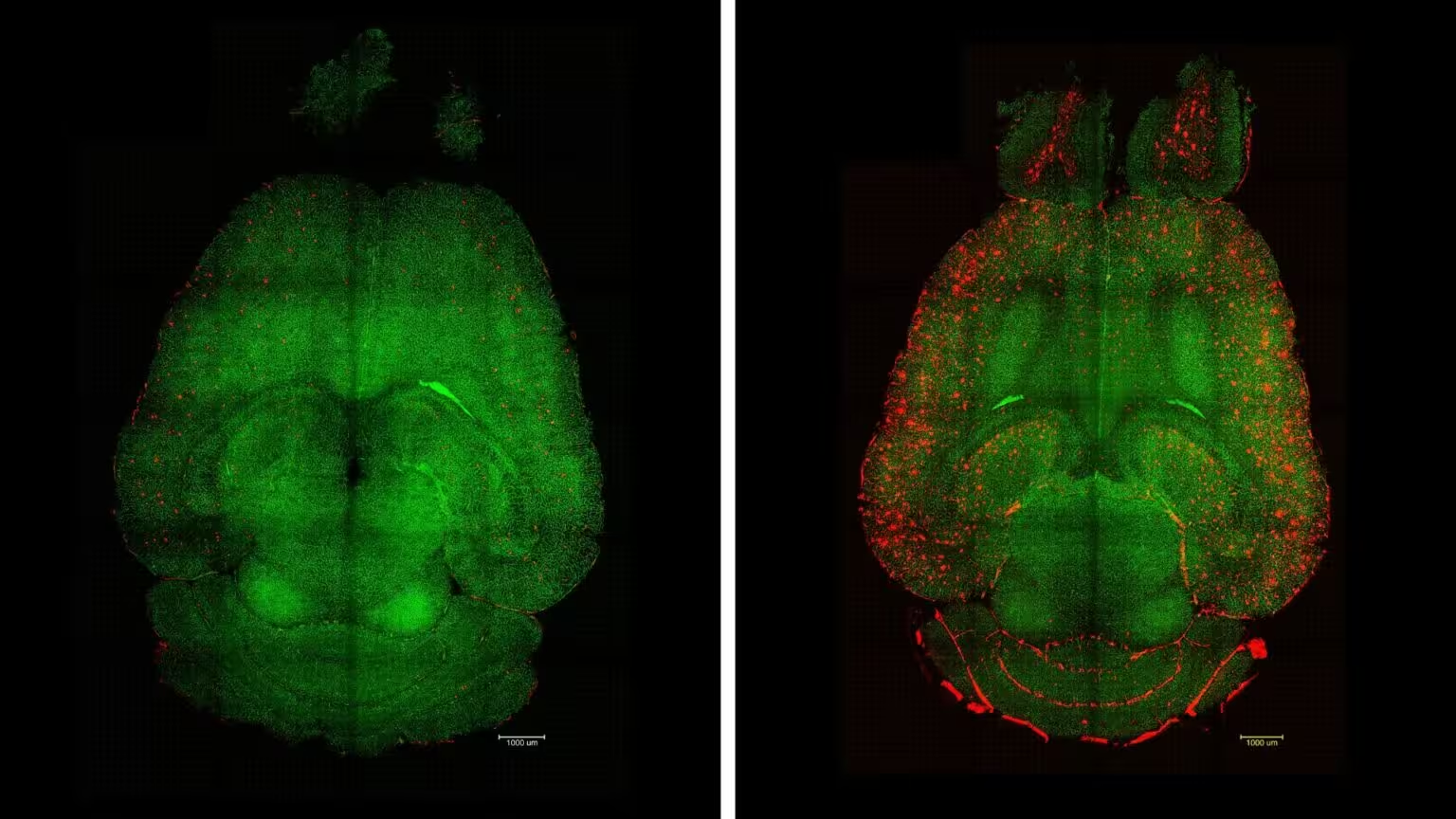
پلاکهای آمیلوئید‑بتا (به رنگ قرمز) از مغز موشهای درمانشده (سمت چپ) پاک شده بود اما در گروه کنترل بدون درمان (سمت راست) باقی مانده بود. رگهای سد خونی‑مغزی به رنگ سبز نشان داده شدهاند. (IBEC)
در عرض چند ساعت از اولین تجویز، بار پلاکهای آمیلوئید‑بتا تقریباً ۴۵ درصد کاهش یافت. پس از تکمیل دورهٔ درمانی، حیوانات درمانشده توانایی یادگیری فضایی و حافظهٔ خود را بهمیزان قابلمقایسهای با همتایان سالم بازیافتند. نکتهٔ کلیدی این است که بهبودهای شناختی حداقل شش ماه ادامه داشت، که نشاندهندهٔ بازنشانی پایدار عملکرد پاکسازی بهجای تغییر زودگذر علائم است. این دوامِ تاثیر برای سوالهای ترجمهپذیری به انسان و برنامهریزی آزمایشهای بلندمدت اهمیت دارد.
چرا این موضوع اهمیت دارد: تغییر تمرکز به بازسازی عروقی
اکثر داروهای فعلی آلزایمر هدفشان حذف یا خنثیسازی پلاکها و درهمپیچیدگیها درون بافت عصبی است. داروهایی مانند لکانماب و دونانماب کند شدن پیشرفت علائم را نشان میدهند اما بیماری را باز نمیگردانند. تیم IBEC–WCHSU استدلال میکند که تمرکز صرف روی تجمعات درونعصبی مرزهای مغز را نادیده میگیرد — جایی که نقص در حملونقل و اختلال عملکرد عروقی میتواند شروعکننده یا تسریعکنندهٔ نورودژنراسیون باشد. بازسازی عملکرد عروقی ممکن است نهتنها آمیلوئید‑بتا، بلکه طیف وسیعتری از مولکولهای سمی را از بافت عصبی بیرون ببرد و تعادل هموستاتیک مغز را بازیابی کند.
«پیامدهای درمانی عمیقاند»، پژوهشگران مینویسند و پیشنهاد میکنند که بازگرداندن ترافیک عبوری سد خونی‑مغزی میتواند مغز را قادر سازد تا پاکسازی نهفقط آمیلوئید‑بتا بلکه دیگر مولکولهای مضر را از سرگیرد. جوزپه باتالاگیا، مهندس زیستی در IBEC، توضیح میدهد: «ما فکر میکنیم که این روند مانند یک آبشاری عمل میکند: وقتی گونههای سمی مثل آمیلوئید‑بتا تجمع پیدا میکنند، بیماری پیشرفت میکند. اما زمانی که عروق قادر به عملکرد دوباره شوند، شروع به پاکسازی آمیلوئید‑بتا و سایر مولکولهای زیانآور میکنند و به کل سیستم اجازه میدهند تعادل خود را بازیابد.» این دیدگاه بر اهمیت سلامت عروقی و نقش لایههای مختلف سلولی — از اندوتلیوم تا پریسایتها و پایانههای آستروسیت — تاکید دارد.
جزئیات تجربی و محدودیتها
تاثیرات گزارششده از مطالعات پیشبالینی روی موشها بهدست آمده که یک ژنوتیپ خاص مرتبط با زوال عقل را هدف قرار میدهند. در این رویکرد، نانوذرات بهعنوان عوامل فعال یا «مهندسان کوچک» در سطح مولکولی عمل میکنند و با تعدیل فعالیت گیرنده و مسیرهای سیگنالدهی سلولی امکان بازفعالسازی خروج آمیلوئید از طریق BBB را فراهم میسازند. پژوهشگران از روشهای بافتشناسی (هیستولوژی) و آزمونهای رفتاری برای کمیسازی کاهش پلاک و بازیابی حافظه استفاده کردند، و از ابزارهای تصویربرداری و نشانگرهای زیستی برای اندازهگیری دینامیک پاکسازی بهره بردند.
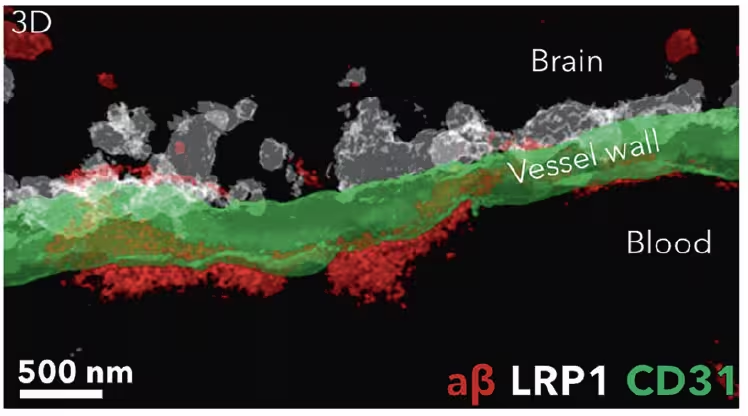
پس از درمان با نانوذرات (سفید)، رسوبات آمیلوئید‑بتا (قرمز) از سمت مغزِ سد خونی‑مغزی (سبز) پاک شده و در خون منتقل شدند. (Chen et al., STTT, 2025)
با این حال، احتیاط ضروری است. بین موش و انسان تفاوتهایی در معماری عروق مغزی، بیان گیرندهها، پاسخ ایمنی و فرایندهای پیری وجود دارد که میتواند کارایی و ایمنی این رویکرد را در انسان تحتتأثیر قرار دهد. کارشناسان مستقل تأکید میکنند که موفقیت در جوندگان گامی امیدوارکننده است اما تضمینی برای کارآیی بالینی در انسان نیست. مطالعهٔ موردنظر تعداد محدودی حیوان و یک زیرنوع بیماریی خاص را بررسی کرد؛ آزمایشهای گستردهتر برای سنجش ایمنی طولانیمدت، تعیین دامنهٔ دوز، تکرارپذیری نتایج و ارزیابی امکان بازیابی مسیرهای مشابه در مغزهای سالمند انسانی لازم است.
از منظر مکانیزمی، سؤالات باز متعددی وجود دارد: آیا نانوذرات باعث افزایش بیان LRP1 میشوند یا روشهایی مانند کاهش بریدهشدن پروتئولیتیک (shedding) گیرنده و تغییر مسیرهای آندوکیتوز را القاء میکنند؟ آیا التهاب موضعی یا سیستمیک را کاهش میدهند که خود میتواند عملکرد LRP1 و دیگر ناقلها را بهبود بخشد؟ پاسخ به این پرسشها برای طراحی نسخههای بالینی و نشانگرهای زیستی پیگیری درمان حیاتی است.
پیامدهای بالقوه برای درمانهای آلزایمر
بازسازی حملونقل از طریق سد خونی‑مغزی ممکن است تکمیلکنندهٔ درمانهای موجود باشد تا جایگزین آنها؛ اگر عملکرد عروقی بازیابی شود، سایر درمانها — از آنتیبادیها گرفته تا مولکولهای کوچک و مداخلات سبکزندگی — میتوانند مؤثرتر عمل کنند زیرا مغز بار دیگر قادر به دفع پسماند خواهد بود. این مفهوم فضای هدفهای دارویی را گسترش میدهد: بهجای طراحی صرف داروهایی که باید وارد مغز شوند، توسعهدهندگان میتوانند عاملانی بسازند که سیستمهای پاکسازی درونزا را دوباره فعال کنند یا مسیرهای انتقالی را تقویت نمایند.
از جنبهٔ توسعهٔ درمان، این رویکرد چند مزیت نظری دارد: احتمال کاهش نیاز به غلظتهای بالای دارو در مغز، ظرفیت کمتری برای عوارض جانبی ناشی از تجمع دارو در بافت عصبی، و امکان ارتقای ایمنی با هدفگذاری غیرتهاجمیتر. با این حال، خطرات و سوالات جدیدی هم مطرح میشود؛ برای مثال، فعالسازی مسیرهای پاکسازی میتواند همراه با تغییر در انتقال سایر مولکولهای حیاتی یا داروهای همزمان باشد، و پتانسیل ایجاد پاسخ ایمنی علیه نانوذرات یا اجزای آن باید با دقت بررسی شود.
تجربهٔ کارشناسان
دکتر لورا مندز، عصبشناس متخصص زیستشناسی نورواَسکولار در مؤسسهٔ جهانی مغز، اظهار داشت: «این مقاله مسئله را از زاویهٔ دیگری مطرح میکند. بهجای اجبار داروها به عبور از یک دروازهٔ شکسته، پیشنهاد میکند لولهکشی را تعمیر کنیم — مکانیزمهایی که بهطور طبیعی مغز را پاک نگه میدارند. ترجمهٔ این ایده به انسان چالشبرانگیز خواهد بود، اما بازگرداندن مسیرهای پاکسازی درونزا ایدهای هیجانانگیز است و با شواهد فزایندهای همخوانی دارد که سلامت عروقی نقش مرکزی در خطر زوال عقل ایفا میکند.»
جولیا دادلی از سازمان Alzheimer’s Research UK، که در این مطالعه مشارکت نداشت، با خوشبینی محتاطانه گفت: نتایج «به شواهد فزایندهای اضافه میکند که تعمیر خود سد خونی‑مغزی میتواند راه تازهای برای درمان آلزایمر ارائه دهد»، در حالی که به فاصلهٔ موجود بین مدلهای موشی و بیماری انسانی اشاره میکند. کارشناسان دیگر نیز بر نیاز به نشانههای زیستی قابل اعتماد (biomarkers) برای پایش کارآیی پاکسازی، از جمله PET آمیلوئید، پروتئینهای حلشونده در مایع مغزی‑نخاعی و نشانگرهای خونمحور تأکید میکنند.
گام بعدی چیست؟
تیم قصد دارد آزمایشهای پیشبالینی بیشتری انجام دهد تا ایمنی طولانیمدت، دامنهٔ دوزهای مؤثر و اثربخشی در مدلهای مختلف را ارزیابی کند. تحقیق موازی لازم است تا مشخص شود آیا مسیرهای مبتنی بر LRP1 را میتوان بهطور ایمن در انسانها تعدیل کرد و آیا پلتفرمهای نانوذرات قابل مقیاسشدن و تولید تحت استانداردهای کلینیکی هستند یا خیر. چالشهای تولید شامل تضمین یکنواختی ذرات، کنترل ترکیب شیمیایی سطحی برای هدفگیری دقیق، و تضمین ثبات فرمولاسیون در شرایط نگهداری و توزیع است.
در سطح طراحی کارآزمایی بالینی، سوالاتی مطرح است: چه گروه سنی و کدام مرحلهٔ بیماری باید در نخستین آزمایشهای انسانی هدف قرار گیرد؟ آیا لازم است درمان با نشانگرهای زیستی خروجی تنظیم شود یا با شواهد تصویربرداری PET همراه گردد؟ چگونه میتوان پتانسیل تداخل با درمانهای همزمان مانند آنتیبادیهای ضد آمیلوئید را ارزیابی کرد؟ پاسخ به این پرسشها نیازمند همکاری میان زیستپزشکها، مهندسان نانو، داروسازان، و تنظیمکنندههای سلامت است.
اگر نتایج در مطالعات بالینی تکرار و گسترش یابد، این استراتژیِ بازسازی عروقی میتواند یک خط جدید تهاجم علیه بیماری آلزایمر باز کند: رویکردی که از سیستمهای پاکسازی خود مغز بهره میگیرد تا بار سمی را کاهش دهد بهجای تکیهٔ صرف بر عوامل بیرونی برای برداشتن این بار. چنین تغییری در پارادایم درمانی میتواند بر طراحی داروها، اهداف پژوهشی و اولویتهای بالینی در دههٔ آینده تأثیر بگذارد.
منبع: sciencealert

ارسال نظر