9 دقیقه
پژوهشگران Johns Hopkins Medicine کانالهای میکروسکوپی نانوتیوبی بین نورونها را شناسایی کردهاند که قادر به انتقال مولکولهای سمی هستند — کشفی که لایهای پیشتر ناشناخته از اتصالپذیری مغز را نشان میدهد و میتواند در توضیح چگونگی گسترش پاتولوژی بیماری آلزایمر نقش داشته باشد. با استفاده از تصویربرداری با وضوح بالا در موشها و بررسی مجموعهدادههای میکروسکوپ الکترونی انسانی، تیم مشاهده کرد که نانوتیوبهای درختچهای بلند و باریک آمیلوئید-بتا و سایر مولکولهای سمی کوچک را بین سلولها جابهجا میکنند، که این مشاهده هدف جدیدی برای درمانهای آینده پیشنهاد میدهد.
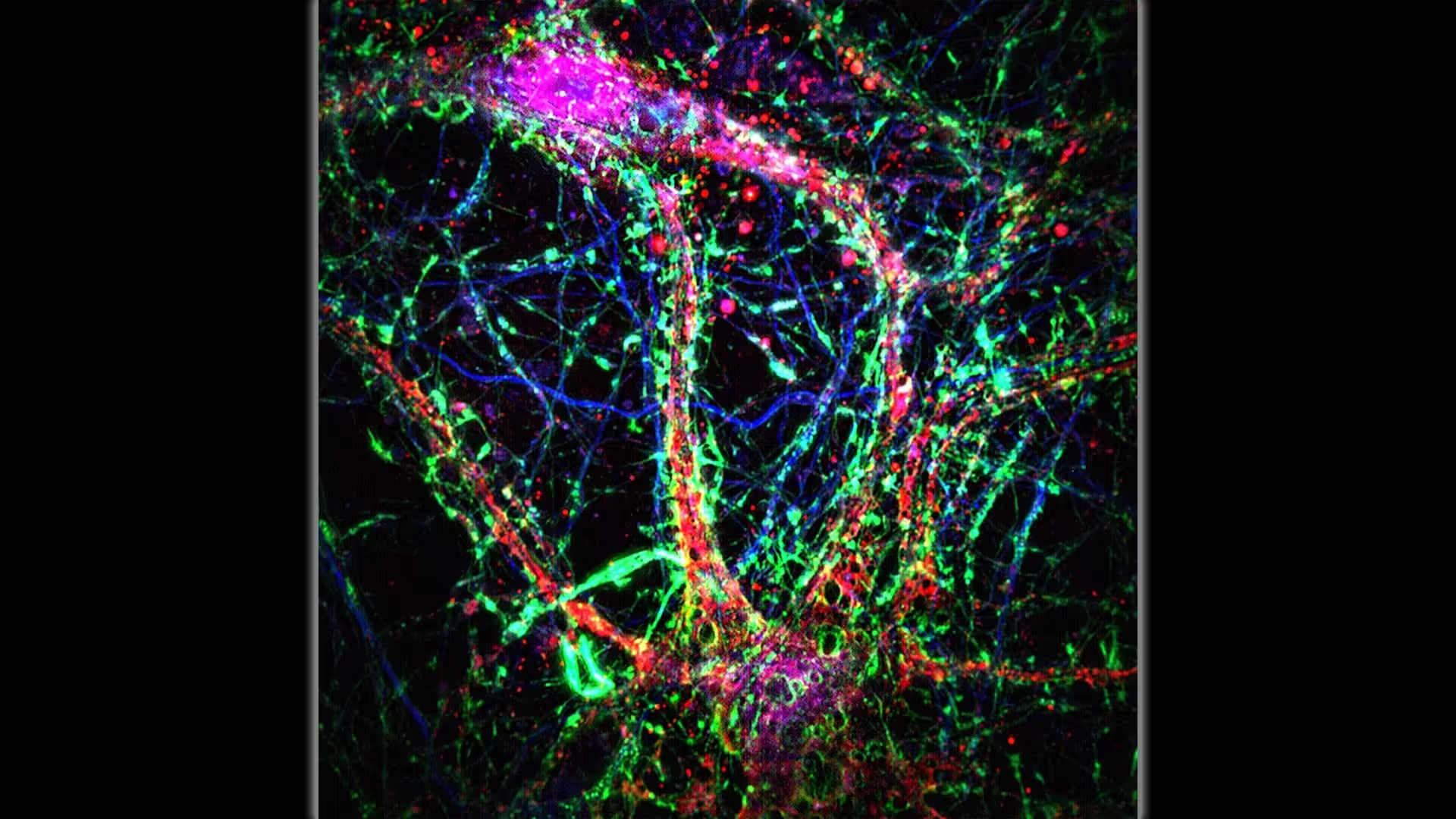
دانشمندان Johns Hopkins Medicine میگویند نانوتیوبهای بینسلولی (اتصالات نازک و شبیه پل که غالباً رنگ سبز را نشان میدهند) به یک لایه اضافی از ارتباط در شبکهٔ نورونی کمک میکنند. Credit: Minhyeok Chang, Ph.D.
یافتههای تیم و اهمیت آن
تصور کنید نورونها نه تنها از طریق سیناپسها با هم «صحبت» میکنند، بلکه بستههای کوچکی را از راه پلهای لولهای شکل به هم میفرستند. این تصویر پایهای است که از مطالعهای که در روز 2 اکتبر در مجله Science منتشر شد، بیرون آمده است؛ در این مطالعه پژوهشگران از وجود یک «لایهٔ اتصال نانوتوبولی» در مغز پستانداران گزارش دادند. این نانوتیوبها — کانالهای بسیار نازک غشایی که دندریتهای نورونهای همسایه را به هم متصل میکنند — به نظر میرسد که قادر به انتقال یونها، کلسیم و مولکولهای سمی کوچک مانند آمیلوئید-بتا از سلولی به سلول دیگر باشند.
به گفتهٔ هیونگبائه کوون، دانشیار علوم اعصاب در دانشکدهٔ پزشکی دانشگاه Johns Hopkins و نویسندهٔ مسئول مقاله: «سلولها باید مولکولهای سمی را دفع کنند، و با ایجاد یک نانوتیوب میتوانند این مولکول سمی را به سلول همسایه منتقل کنند. متأسفانه این فرایند میتواند منجر به انتشار پروتئینهای مضر به نواحی دیگر مغز شود.»
طبیعت دوگانهٔ نانوتیوبها — بهعنوان مکانیزمی برای پاکسازی ضایعات که همزمان میتواند محمولهٔ سمی را منتشر کند — چارچوب جدیدی برای فهم نورودژنراسیون در مراحل ابتدایی فراهم میآورد. شبیهسازیهای رایانهای انجامشده توسط تیم الگوهای تجمع زودهنگام آمیلوئید را که در موشهای مدل آلزایمر دیده میشود، بازتولید کردند و این امر ایدهٔ دخالت انتقال میانسلولی نانوتیوبمحور در تسریع بذرگذاری محلی پروتئینهای پاتولوژیک را تقویت میکند.
این یافته باعث میشود پژوهشگران به بازنگری در مدلهای پراکنش پاتولوژی آلزایمر بپردازند؛ بهویژه این که گسترش بیماری ممکن است نه صرفاً از طریق پراکندگی ساکنِ پلاکها، بلکه از طریق شبکهای دینامیک از کانالهای ریز میان نورونها رخ دهد. این بینش میتواند استراتژیهای تشخیصی و درمانی زودهنگام را تحت تأثیر قرار دهد.
چگونه این کشف بهدست آمد: روشها و شواهد
پژوهشگران مدلهای ژنتیکی موشیای را که به تجمع آمیلوئید مستعد بودند با میکروسکوپهای زندهنمایی با وضوح بسیار بالا ترکیب کردند تا تشکیل نانوتیوبها را در برشهای مغزی مشاهده کنند. آنها برآمدگیهای بلند و ستونیشکل را که دندریتها را میپوشاند ثبت کردند و حرکت مولکولهای نشاندارشده با فلورسانس را مستقیماً از طریق این کانالها دنبال نمودند. برای اعتبارسنجی اهمیت انسانی، مجموعهدادههای عمومی میکروسکوپ الکترونی انسان را بررسی کردند و نانوتیوبهایی با مورفولوژی مشابه که نورونهای انسانی را به هم متصل میکردند یافتند.
در موشهایی که برای توسعهٔ پلاکهای آمیلوئیدی مشابه آلزایمر برنامهریزی شده بودند، تعداد نانوتیوبها در سه ماهگی افزایش یافته بود — دورهای که حیوانات هنوز علائم ظاهری بیماری را نشان نمیدهند. در شش ماهگی، زمانی که پاتولوژی پلاکی واضحتر میشود، شمار نانوتیوبها بین موشهای ترانسژنیک و کنترل همگرا شد. این پویایی زمانی نشان میدهد که تکثیر نانوتیوبها ممکن است در مراحل اولیه و پیشنشاندار بیماری فعالتر باشد.
برای اطمینان از روایی دادهها، تیم از تکنیکهای تصویربرداری چندجانبه بهره برد: تصویربرداری لیزری با وضوح بالا برای دیدن دینامیک در زمان واقعی، میکروسکوپ الکترونی برای مشاهدهٔ ساختار ریزسکوپی، و برچسبگذاری مولکولی برای ردیابی محمولههایی مثل آمیلوئید-بتا و موتیفهای پروتئینی دیگر. ترکیب این روشها امکان ارتباطدهی بین ساختار و عملکرد را فراهم ساخت.
همچنین تحلیلهای آماری و مدلسازی ریاضی کمک کردند تا سرعت و الگوی انتقال مولکولها در شبکهٔ نانوتیوبی شبیهسازی و با الگوهای مشاهدهشده در دادههای تجربی همخوانی داده شود. این نوع ارزیابیها برای نفی احتمالاتی مانند انتقال غیرمستقیم از طریق ریزفضاهای بینسلولی یا اثرات ناشی از فرایندهای آزمایشی اهمیت داشت.
تیم پشتیبان و منابع مالی
این پروژه توسط کوون هدایت شد و مشارکتهایی از مینهیوک چانگ، سارا کروسل، جوهیون کیم، دانیل لی، آلک مِرودیو و جِییانگ کوون در Johns Hopkins و همکارانی مانند لاکس می کومار پاراجولی و شیگِئو اوکابه در دانشگاه توکیو داشت. بودجه از موسسات ملی بهداشت (National Institutes of Health) تحت گرنتهای DP1MH119428 و R01NS138176 تأمین شد.
حمایت مالی و همکاریهای بینالمللی در پروژههایی از این نوع اهمیت دارد، زیرا ترکیب تخصصها — از تصویربرداری و زیستشناسی مولکولی تا مدلسازی محاسباتی — برای بازتولید و تعمیم نتایج لازم است. اطلاعرسانی دربارهٔ منابع مالی همچنین به شفافیت در اعتبارسنجی نتایج و قابلیت بازتولید پروژه کمک میکند.
پیامدها برای پژوهش آلزایمر و روشهای درمانی بالقوه
این یافتهها چندین مسیر ترجمانی را باز میکنند. اگر نانوتیوبهای دندریتیک مسیر پخش آمیلوئید-بتا باشند، تنظیم تشکیل این نانوتیوبها — یا سرکوب آنها برای محدود کردن گسترش، یا تقویت موقتی آنها برای بهبود پاکسازی مولکولهای سمی — میتواند به عنوان راهبردی درمانی مطرح شود. کوون و همکاران پیشنهاد میکنند آزمایشهایی در آینده صورت گیرد تا بهطور عمدی نانوتیوبها را ایجاد یا مسدود کنند و بررسی کنند این دستکاری چگونه بر سلامت نورونها، تجمع پروتئینی و نتایج شناختی در مدلهای حیوانی تأثیر میگذارد.
علاوه بر آلزایمر، شبکههای نانوتیوب ممکن است در سایر بیماریهای نورودژنراتیو که در آنها پروتئینهای بدشکل از سلولی به سلول دیگر منتشر میشوند، نقش ایفا کنند؛ مانند بیماری پارکینسون یا ALS. ویژگیهای ساختاری و عملکردی این نانوتیوبها — از جمله طول، قطر، و انتخابپذیری نسبت به محمولههای مولکولی خاص — جزئیات حیاتی برای توسعهدهندگان دارو و دانشمندان اعصاب خواهند بود که میکوشند مداخله کنند.
در سطح داروشناسی، مداخله ممکن است شامل مولکولهای کوچک، آنتیبادیهای ویژه، یا زیستداروهای مهندسیشده باشد که بهطور انتخابی پویایی غشایی، پیوند پروتئین به کانالها یا مسیرهای سیگنالدهی مؤثر بر تشکیل نانوتیوب را هدف میگیرند. چالش کلیدی در توسعه چنین رویکردهایی، تمایز بین نقش مفید نانوتیوبها در پاکسازی ضایعات و نقش مضر آنها در انتشار پروتئینهای پاتولوژیک است.
هرگونه درمان پیشنهادی باید اثرات جانبی احتمالی روی هموستاز سلولی، انتقال سیناپسی و دیگر فرایندهای حیاتی نورونی را مورد بررسی دقیق قرار دهد. به علاوه، توسعهٔ نشانگرهای زیستی (بیومارکرها) که فعالیت نانوتیوبها یا انتقال آمیلوئید را نشان میدهند، میتواند به ارزیابی اثربخشی درمانها و تشخیص زودهنگام کمک کند.
بینش کارشناسانه
«این کشف لایهٔ جدیدی به نقشهٔ ارتباط نورونی ما اضافه میکند،» دکتر النا وارگاس (نوروبیولوژیست فرضی و مروج علمی) گفت. «این کشف طرز فکر ما را در مورد دفع زبالههای سلولی و پیامدهای ناخواستهٔ آن تغییر میدهد. هدفگیری دینامیک نانوتیوبها میتواند راهی هوشمندانه برای مداخله در مراحل اولیه پیشرفت بیماری باشد، اما نیاز به مطالعات دقیق برای جلوگیری از مختلسازی مسیرهای پاکسازی مفید دارد.»
تیم Johns Hopkins برنامهریزی کرده است که گامهای بعدی شامل نقشهبرداری شبکههای نانوتیوب در انواع مختلف سلولهای مغزی، مهندسی تشکیل کنترلشدهٔ نانوتیوبها در شرایط آزمایشگاهی (in vitro)، و آزمون اینکه آیا تغییر فراوانی نانوتیوبها دورهٔ آمیلوئیدوز را در مدلهای حیوانی تغییر میدهد یا خیر، باشد. اگر این خطوط پژوهشی موفق شوند، میتوانند به اهداف دارویی یا زیستداروهایی اشاره کنند که بهطور انتخابی فعالیت نانوتیوبهای بینسلولی را تنظیم میکنند.
تحقیقات آینده باید همچنین به تفاوتهای منطقهای در مغز، متأثر از سن و نوع سلول (برای مثال نورونها، آستروسیتها و میکروگلیا) توجه کند؛ چرا که ممکن است الگوهای تشکیل و کارکرد نانوتیوبها در هیپوکامپ نسبت به قشر یا سایر نواحی تفاوت داشته باشند. شناخت این تفاوتها برای طراحی درمانهای منطقهای یا هدفمند اهمیت دارد.
برای اکنون، این کشف نگرش ما را به پاتولوژی زودهنگام آلزایمر تغییر میدهد: نه تنها به صورت شکلگیری پلاکهای موضعی، بلکه به عنوان فرایندی دینامیک که تحت تأثیر کانالهای میکروسکوپی قرار دارد که جوامع نورونی را به هم پیوند میدهند. این دیدگاه جدید میتواند شیوهٔ جستجوی نشانگرهای زیستی و طراحی مداخلات زودهنگام برای کند کردن یا متوقف کردن گسترش بیماری را دگرگون کند.
در کنار ضرورت مطالعات تکمیلی، مهم است که این یافتهها در زمینهٔ گستردهتر پژوهشهای نورودژنراتیو قرار گیرند: بررسی اینکه آیا انتقال میانسلولی از طریق نانوتیوب یک مکانیسم عمومی در انتشار پروتئینهای پاتولوژیک است یا پدیدهای خاص در برخی از انواع بیماریها، به درک بهتر مسیرهای مولکولی و توسعهٔ درمانهای متناسب کمک خواهد کرد.
منبع: sciencedaily

ارسال نظر