7 دقیقه
یک مطالعه جدید از دانشگاه کالیفرنیا، برکلی گزارش میدهد که ترکیب دو دارو که مسیرهای پیری متفاوتی را هدف میگیرد، بهطور چشمگیری طول عمر موشهای مسن و ناتوان نر را افزایش داده است. این افزایش طول عمر — تا ۷۳٪ از زمان شروع درمان — هم نوید زیستشناسی ضدپیری امیدوارکننده را میدهد و هم پیچیدگیهای پاسخهای وابسته به جنسیت را نشان میدهد.
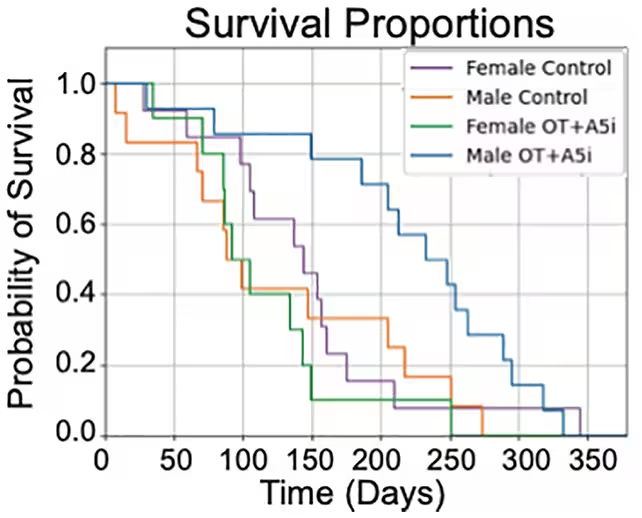
موشهای نر تحت درمان نسبت به گروه کنترل طول عمر بیشتری داشتند، در حالی که تأثیر مشابهی در موشهای ماده مشاهده نشد.
رویکرد دو سویه: اکسیتوسین در برابر مهارکننده Alk5
در این درمان، اکسیتوسین (OT) که هورمونی طبیعی و ناقل عصبی مرتبط با پیوندهای اجتماعی، تولیدمثل، ترمیم عضلات و بازسازی بافتها است، با یک مهارکننده Alk5 (A5i) ترکیب شد. مهارکننده Alk5 فعالیت مسیر سیگنالدهی فاکتور رشد تبدیلشونده بتا (TGF-beta) را کاهش میدهد. مسیر TGF-beta در سنین بالا تمایل به فعال شدن بیش از حد دارد و در التهاب مزمن و تحلیل بافتی نقش دارد؛ بنابراین هدفگیری همزمان بازسازی و کاهش سیگنالهای التهابی یک استراتژی منطقی در زیستشناسی پیری است.
محققان این ترکیب را بر روی موشهای ۲۵ ماهه آزمایش کردند — که در حدود معادل انسانِ ۷۵ ساله در نظر گرفته میشود — و حیواناتی که نشانههای ضعف و ناتوانی ناشی از پیری را نشان میدادند انتخاب شدند. موشهای نری که هر دو دارو را دریافت کردند نه تنها بهطور معناداری طول عمر بیشتری نسبت به گروه کنترل نشان دادند، بلکه بهبودهای قابلسنجی در عملکرد فیزیکی، نشانگرهای پروتئینی خون و آزمونهای حافظه کوتاهمدت نیز داشتند. این تغییرات نشاندهنده افزایش سلامتپای (healthspan) به موازات طول عمر است: یعنی موشها نه فقط زنده ماندند، بلکه توانایی عملکردی بهتری نیز حفظ کردند.
چرا تنها نرها پاسخ دادند: معمای تفاوت جنسی
نکته جالب این است که افزایش طول عمر و بهبود عملکرد عمدتاً محدود به موشهای نر بود. موشهای ماده افزایش طول عمر مشابهی نشان ندادند، گرچه پژوهشگران یک اثر جالب در باروری مشاهده کردند: درمان OT+A5i در سنین اواخر میانسالی ظاهراً باروری موشهای ماده را تا حدی جوانسازی کرد. این مشاهده نشاندهنده زیستشناسی وابسته به جنس است — تفاوت در هورمونها، پاسخهای ایمنی و سیگنالدهی تولیدمثلی — که میتواند نحوه واکنش مسیرهای پیری به مداخلات را تغییر دهد.
تفاوتهای جنسی در پژوهشهای ضدپیری پدیده تازهای نیست: بسیاری از درمانهای طول عمر در گونهها و شرایط مختلف واکنشهای متفاوتی بین نر و ماده نشان میدهند. تیم برکلی پیشنهاد میکند که تحقیقات آینده موشهای ماده را در سنین جوانتر بررسی کنند و پارامترهای دوز و زمانبندی را تغییر دهند تا دلایل نتایج متفاوت روشنتر شود. بهعنوان مثال، ممکن است حساسیت گیرندهها، سطح هورمونهای جنسی یا وضعیت التهابی پایهای در مادهها باعث واکنش متفاوت شود.
زمینهٔ علمی و جزئیات تجربی
این مطالعه همزمان دو مکانیسم وابسته به سن را هدف گرفت: حمایت از فرایندهای بازسازی از طریق اکسیتوسین و مسدود کردن سیگنالدهی بیشازحد TGF-beta با استفاده از مهارکننده Alk5. اکسیتوسین قبلاً در بالین برای القای زایمان و مدیریت آن کاربرد داشته و از این رو فایل ایمنی آن در آن زمینه نسبتاً شناختهشده است. مهارکنندههای Alk5 نیز در پژوهشهای سرطانشناسی بررسی میشوند که این امر میتواند فرآیندهای ارزیابی ایمنی و سمیت را هنگام استفاده مجدد از این مولکولها در پژوهشهای پیری تسریع کند.
یادداشتهای کلیدی آزمایشگاهی و طراحی مطالعه را میتوان اینگونه خلاصه کرد:
- زمرهٔ مورد مطالعه: موشهای نژاد C57BL/6، ۲۵ ماهه، که مشخصات ضعیف و پیری پیشرفته را نشان میدادند.
- طرح درمانی: ترکیب OT و A5i پس از ظهور علائم آسیبپذیری وابسته به سن در حیوانات تجویز شد؛ یعنی درمان در مرحلهٔ ناتوانی آغاز شد، نه قبل از آن.
- شاخصهای اندازهگیریشده: بقا/طول عمر از زمان شروع درمان، آزمونهای فیزیکی (عملکرد عضلانی، توانایی حرکتی)، نشانگرهای پروتئینی خون (بیومارکرهای التهابی و ترمیمی) و آزمونهای حافظهٔ کوتاهمدت.
- نتایج کمی: در موشهای نر تا ۷۳٪ افزایش طول عمر از زمان شروع درمان گزارش شد و در کل دستهٔ مطالعه، افزایش میانهٔ طول عمر حدود ۱۴٪ بهدست آمد. دادههای عملکردی نیز بهبودهای معناداری را نشان میدادند که بازتاب افزایش سلامتپای بودند.
پیامدها برای درمانهای انسانی پیری
این یافتهها مدرک مفهومی (proof of principle) ارائه میدهند که تنظیم همزمان فرایندهای بازسازی و سیگنالدهیهای پروالتهابی میتواند در پستانداران مسن عملکرد را بازگرداند و طول عمر را افزایش دهد. با این حال ترجمهٔ این نتایج به انسان با موانع مهمی روبهرو است: عوارض جانبی بالقوه، تعیین دوز مناسب، ارزیابی ایمنی بلندمدت و پاسخهای وابسته به جنسیت که در موشها دیده شد.
تغییر مسیرهای پیری میتواند با ایجاد معاملههای زیستی همراه باشد. کاهش یک فرآیند مضر ممکن است تعادل یک عملکرد مفید را مختل کند؛ برای مثال، کاهش سیگنال التهابی مزمن میتواند توانایی سیستم ایمنی در پاسخگویی به عفونتها را تحت تأثیر قرار دهد یا تداخلهایی با فرایندهای ترمیمی دیگر ایجاد کند. بدینخاطر تنظیمکنندگان به ارزیابی دقیق پیامدهای نامطلوب نیاز خواهند داشت قبل از آنکه بتوان درباره آزمایشهای بالینی متمرکز بر طول عمر یا سلامتپای تصمیمگیری کرد.
یک مزیت عملی برای پژوهشگران این است که اکسیتوسین کاربرد بالینی شناختهشدهای دارد و مهارکنندههای Alk5 در تحقیقات سرطان حضور دارند؛ بنابراین ممکن است مسیر ارزیابی ایمنی و سمیت برای بازکاربردی کردن این مولکولها (drug repurposing) سریعتر طی شود. با این حال پل زدن از موش به انسان هم از نظر بیولوژیکی و هم اخلاقی فاصله بزرگی دارد و نیازمند مطالعات تدریجی، کنترلشده و دقیق است که شامل ارزیابیهای دوز-پاسخ، مدلهای پیشبالینی متنوع و مطالعات فاز اولیهٔ انسانی خواهد بود.
این مطالعه چه افزودهای به پژوهشهای پیری دارد
علاوه بر نتیجهٔ کلی، مقالهٔ مورد بحث بر چند اولویت کلیدی در علم پیری (geroscience) تاکید میکند: ترکیب مداخلات که هرکدام روی ویژگیهای متفاوت پیری اثر میگذارند، طراحی پروتکلهای مخصوص جنسیت و اندازهگیری همزمان طول عمر و شاخصهای سلامتپای عملکردی. مطالعه همچنین چند نشانگر بیولوژیک و آزمونهای رفتاری نامزد معرفی میکند که میتواند در آزمایشهای آینده برای ارزیابی اثربخشی مداخلات ضدپیری به کار رود.
بینش متخصصان
«این کار نمونهٔ قانعکنندهای از گرِروساینس ترکیبی و هدفمند است،» میگوید دکتر النا مورالس، زیستشناس سالمندی و مروج علمی (نقشی ساختگی). «نشان میدهد که همزمان تنظیم دو محور — حمایت از فرایندهای ترمیمی و محدودسازی سیگنالهای التهابی مزمن — میتواند تابآوری را در حیوانات بسیار پیر بازگرداند. اما اثر بقا که تنها در نرها دیده شد هشدار میدهد که درمانهای تکدانهای و یکسان برای همه غیرواقعبینانهاند. برای ترجمه به انسان به استراتژیهای دقیق و آگاه از تفاوتهای جنسی نیاز داریم.»
با افزایش جمعیت سالمندان در سراسر جهان، مطالعاتی از این دست نقشههای راه ارزشمندی ارائه میدهند: اهداف امیدوارکننده را مشخص میکنند، پیچیدگیهای زیستی را روشن میسازند و یادآوری میکنند که پزشکی طول عمر مؤثر هم نیازمند دقت بالا و هم احتیاط است. پژوهشهای آینده باید بر تعیین نشانگرهای قابلاعتماد برای سلامتپای، طراحی مداخلات ترکیبی و توسعه چارچوبهای بالینی حساس به جنسیت تمرکز کنند تا انتقال نتایج پیشبالینی به کاربردهای بالینی با ریسک کمتر و اثربخشی بیشتر انجام شود.
منبع: sciencealert
نظرات
نووا_اکس
خیلی خوشبینانه ارائه شده؛ دادهها امیدوارکننده ان اما نمونه محدود و نگرانیهای ایمنی و طولانیمدت هست، باید ادامه بدن.
پمپزون
تو کارهای بافتی دیدم TGF-beta واکنش متفاوته بین جنسها... این نابرابری جنسیتی رو باید جدی گرفت، جذابه ولی پیچیده.
آرمین
این واقعیه یا فقط نتیجهٔ شرایط خاص آزمایشگاهه؟ واقعا ترجمه به انسان کلی پیچیدگی و ریسک داره، یعنی هنوز زوده؟
بیونیکس
معقول بهنظر میاد، اما دوز و عوارض مسئلهس، نباید عجله کرد.
دیتاپالس
وااای، افزایش ۷۳٪؟! واقعا چشمگیره ولی چرا فقط نرها جواب دادند؟ کلی سوال تو سرم مونده...


ارسال نظر