10 دقیقه
پژوهشگرانی از اسپانیا، چین و بریتانیا گزارش دادهاند که یک نانوتکنولوژی نوین توانسته علائم شبیه آلزایمر در موشها را معکوس کند؛ اما نه با هدفگیری مستقیم نورونها، بلکه با تعمیر سازوکار پاکسازی عروقی مغز—یعنی ترمیم سد خونی–مغزی (BBB). این درمان از نانوذراتی مهندسیشده استفاده میکند که خود بهعنوان عامل درمانی عمل میکنند و بهعنوان «داروهای فوقمولکولی» عملکرد پاکسازی عروقی پروتئینهای سمی را بازیابی کرده و عملکرد شناختی را در مدلهای حیوانی بهبود میبخشند.
بازاندیشی در آلزایمر: لولهکشی مغز را تعمیر کنید، نه فقط نورونها
برای دههها پژوهشهای مربوط به آلزایمر عمدتاً بر نورونها و سیناپسها متمرکز بودهاند: جلوگیری از مرگ نورونی، مهار شکلگیری آمیلوئید یا پاکسازی گرههای تاو. این مطالعه اما راهبرد متفاوتی را پیش گرفته است. بهجای تحویل بار دارویی به نورونها، تیم پژوهشی نانوذراتی طراحی کرده که خود بهطور فعال با گیرندههای عروقی تعامل میکنند و ماشینآلات پاکسازی زبالههای مغزی را بازتنظیم میکنند. نتیجه: حذف سریع آمیلوئید‑β (Aβ) و بهبود بلندمدت رفتارهای شناختی در موشهای درمانشده.
چرا باید رگها هدف قرار گیرند؟ شبکه عروقی مغز و رابط محافظ آن—سد خونی–مغزی (BBB)—برای سلامت مغز ضروریاند. BBB کنترل میکند چه چیزی وارد و چه چیزی از مغز خارج میشود و از پاکسازی فعال ضایعات متابولیک پشتیبانی میکند. هنگامی که این سامانه دچار اختلال شود، پروتئینهای سمی مانند آمیلوئید‑β تجمع پیدا میکنند، التهاب ایجاد میشود و مدارهای نورونی تحلیل میروند. تعمیر BBB عملکرد اساسی پاکسازی را بازیابی میکند و میتواند پیشرفت بیماری را متوقف یا حتی معکوس کند.
عروق مهماند: چگونه مغز خود را پاک نگه میدارد
مغز مصرف انرژی بسیار بالایی دارد. در بزرگسالان تقریباً ۲۰٪ از انرژی کل بدن را مصرف میکند و در کودکان این نسبت حتی بیشتر است. این نیاز توسط شبکهای متراکم از مویرگها تأمین میشود—چنان متراکم که هر نورون عملاً با یک منبع خون کوچک جفت شده است. با نزدیک به یک میلیارد مویرگ، سیستم عروقی مغز هم نورونها را تغذیه میکند و هم ضایعات را پاک میکند. وقتی انتقال عروقی مختل شود، پاکسازی پروتئینهای مضر متوقف شده و نورودژنراسیون تسریع مییابد.
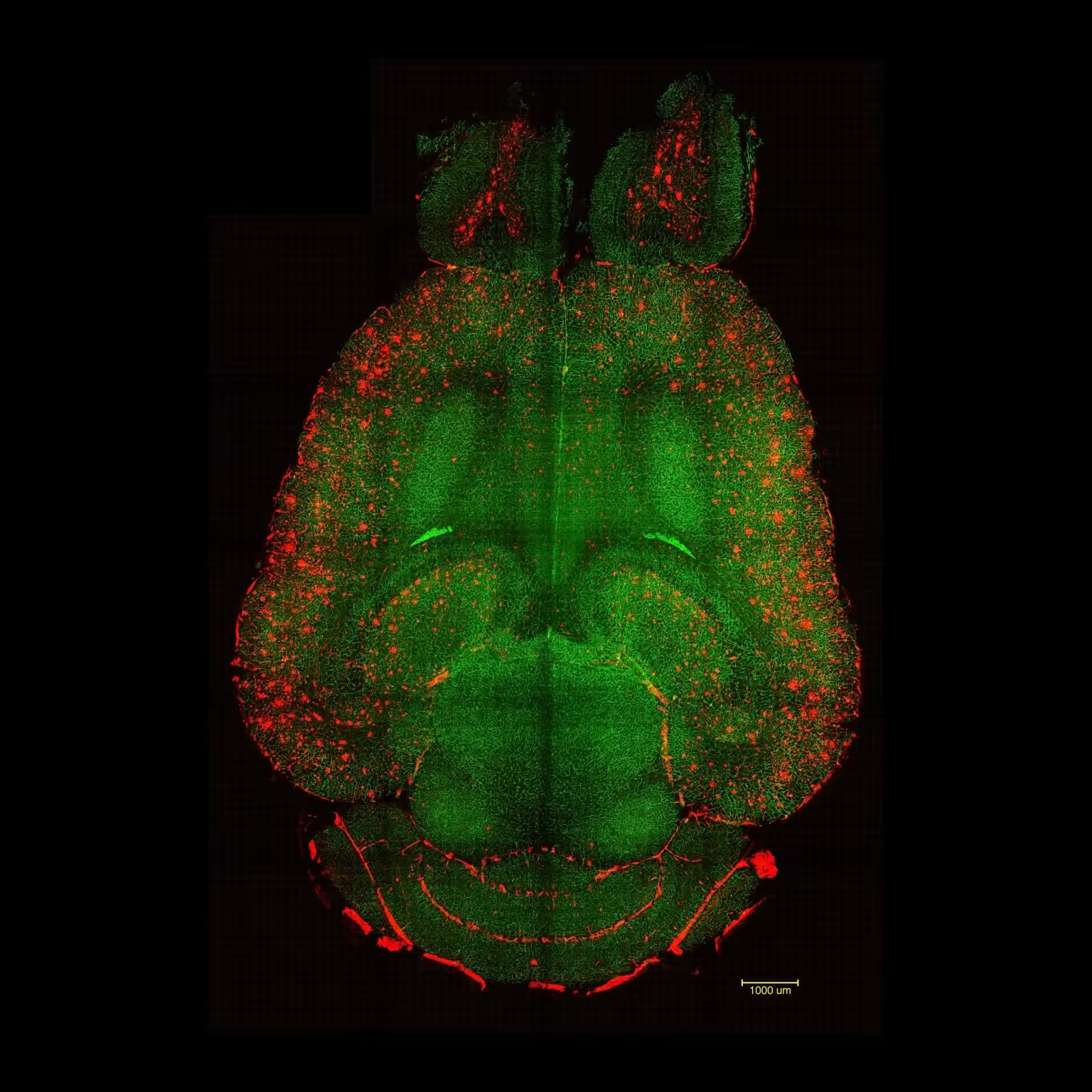
تصاویر میکروسکوپ فلورسانس برشورق نور از مغز موش ۱۲ ساعت پس از عدم درمان با نانوذرات. این مغزها برای سنجش میزان تجمع پلاکهای Aβ تحلیل شدند. قرمز: پلاکهای Aβ. سبز: رگهای مرتبط با سد خونی–مغزی. اعتبار: مؤسسه مهندسی زیستی کاتالونیا (IBEC).
نحوه عملکرد نانوذرات فوقمولکولی
تیم پژوهشی نانوذرات را بهصورت سازههای فوقمولکولی چندارزشی (multivalent) طراحی کردند. این ذرات بهجای عملکردن بهعنوان حاملهای غیرفعال، تعداد مشخصی لیگاند سطحی ارائه میدهند که با گیرندههای خاص روی سلولهای اندوتلیال BBB تعامل میکنند. یکی از مولکولهای کلیدی LRP1 است، گیرندهای که معمولاً Aβ را شناسایی و آن را از بافت مغز به خون منتقل میکند. در شرایط مرتبط با آلزایمر، ترابری و عملکرد LRP1 دچار اختلال میشود—چه بهخاطر اشباع گیرنده و چه بهعلت سیگنالدهی ضعیف—در نتیجه پاکسازی Aβ متوقف میشود.
این نانوذرات مهندسیشده لیگاندهای طبیعی LRP1 را تقلید میکنند و ترابری گیرنده را تعدیل میکنند: آنها به Aβ متصل میشوند، LRP1 را درگیر میکنند و گیرنده را وادار میسازند که بار سمی را از طریق BBB منتقل کند. عملاً نانوذرات مانند یک کلید بیوشیمیایی عمل میکنند که مسیر پاکسازی را بازتنظیم کرده و حذف ضایعات عروقی را فعال میسازند. از آنجا که خود ذرات بهعنوان عوامل درمانی عمل میکنند، این روش مسائل مربوط به بارگذاری دارو و سینتیک آزادسازی که در نانوداروها معمول است را دور میزند.
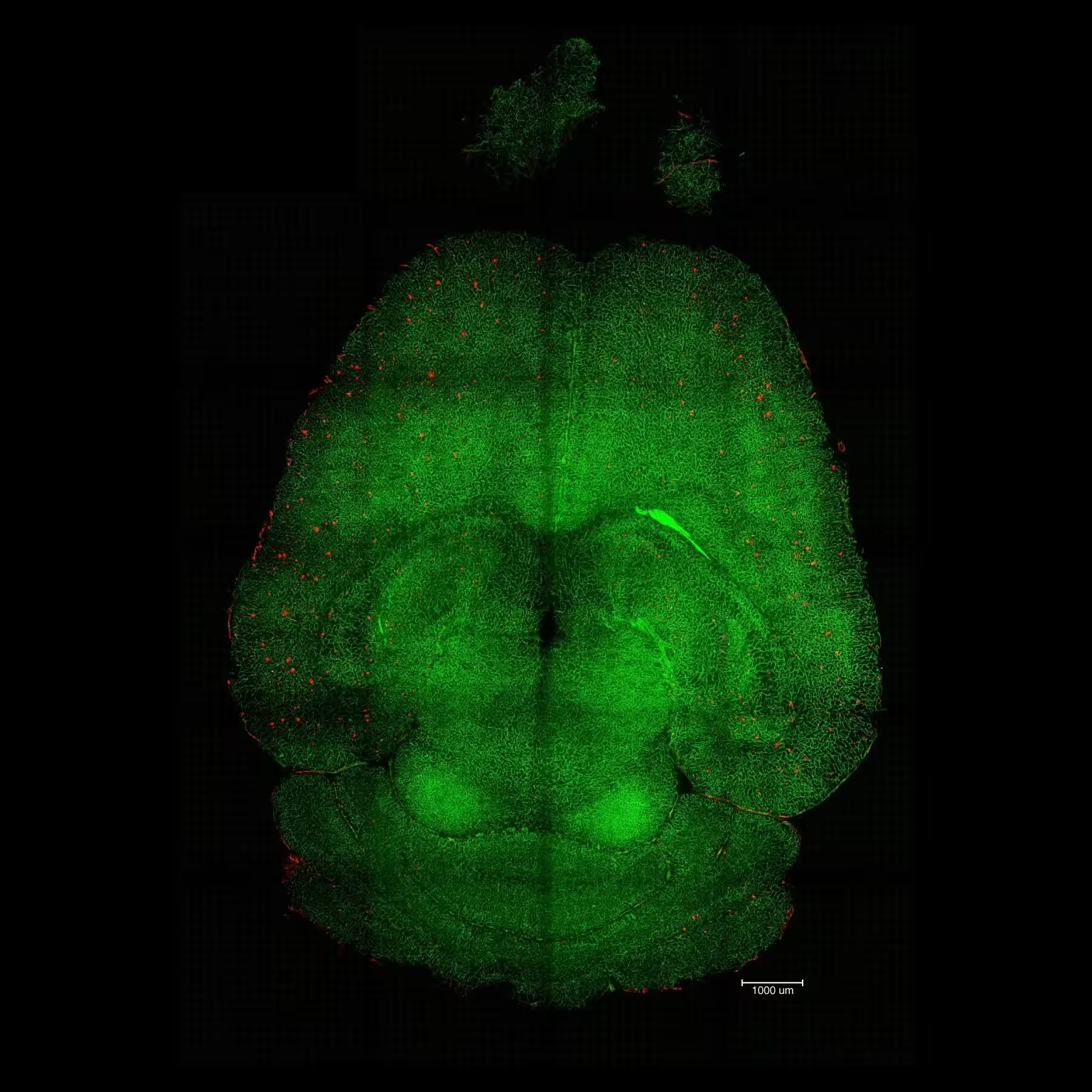
تصویر میکروسکوپ فلورسانس برشورق از مغز موش ۱۲ ساعت پس از درمان با نانوذرات. این مغزها برای بررسی میزان تجمع پلاکهای Aβ تحلیل شدند. قرمز: پلاکهای Aβ. سبز: رگهای سد خونی–مغزی. اعتبار: مؤسسه مهندسی زیستی کاتالونیا (IBEC).
اثرات سریع و پایدار در موشهای مدل آلزایمر
برای ارزیابی اثربخشی، پژوهشگران از موشهای مهندسیشده ژنتیکی استفاده کردند که مقدار زیادی Aβ تولید میکنند و کاهش شناختی پیشروندهای را نشان میدهند. درمان تنها شامل سه تزریق از نانوذرات فوقمولکولی بود. پاکسازی هم سریع و هم عمیق بود: ظرف یک ساعت پس از تزریق، محققان کاهش ۵۰–۶۰٪ در میزان قابلسنجش Aβ داخل مغز را مشاهده کردند.
اما چشمگیرترین نتایج، رفتاری و بلندمدت بودند. حیوانات در مراحل مختلف بیماری و در دورهای طولانی بررسی شدند. در یکی از آزمایشها، یک موش ۱۲ ماهه (تقریباً معادل ۶۰ سال در انسان) نانوذرات را دریافت کرد و شش ماه بعد دوباره مورد آزمون قرار گرفت. حیوان ۱۸ ماهه درمانشده (قابلمقایسه با فرد ۹۰ ساله) رفتاری نشان داد که از نظر کلی قابلتمایز از گروه کنترل سالم نبود. نویسندگان این مزایای پایدار را منتسب به بازگشت عملکرد عروقی میدانند: وقتی مسیرهای پاکسازی ریست میشوند، Aβ و گونههای سمی دیگر بهتدریج حذف شده و سیستم به سمت تعادل بازمیگردد.
«فقط ۱ ساعت پس از تزریق کاهش ۵۰–۶۰٪ در مقدار Aβ داخل مغز را مشاهده کردیم،» گفت ژونیانگ چن، یکی از نویسندگان اول و پژوهشگر بیمارستان غربی دانشگاه سیچوان. تیم تأکید میکند که نانوذرات از طریق تعدیل عروقی و ترابری گیرنده عمل میکنند و نه نجات مستقیم نورونها.

جوزپه باتاگلیا (چپ) و لورنا رویز پرز (راست). اعتبار: مؤسسه مهندسی زیستی کاتالونیا (IBEC).
زمینه علمی: LRP1، ترابری گیرنده و چندارزشی (multivalency)
LRP1 (پروتئین مرتبط با گیرنده لیپوپروتئین با چگالی کم) بهعنوان دروازهبان مولکولی برای Aβ عمل میکند. این گیرنده پپتید را شناسایی میکند، از طریق لیگاندهای جانبی میپیوندد و ترانسسایتوز را از عرض سلولهای اندوتلیال واسطه میشود. ترابری LRP1 نیاز به تعادل ظریفی دارد: پیوند بیش از حد محکم یا تخریب گیرنده میتواند ظرفیت انتقال را کاهش دهد، در حالی که درگیری ضعیف موجب عدم تحریک عبور میشود. نانوذرات فوقمولکولی از این تعادل بهره میبرند و با ارائه چندین نسخه از لیگاند (multivalency) پروفایل درگیری بهینهای ایجاد میکنند که پاکسازی واسطهشده توسط گیرنده را فعال میسازد بدون اینکه سیستم را مسدود کند.
دقت مهندسی اهمیت دارد: با کنترل اندازه ذره و تعداد لیگاندهای سطحی، تیم پژوهشی سکویی ایجاد کرده که رفتار گیرنده را در غشای سلولی تعدیل میکند—که راه جدیدی برای درمان سهم عروقی در دمانس (زوال عقلی) باز میکند.

شیاوه تیان (چپ) و جوزپه باتاگلیا (راست). اعتبار: مؤسسه مهندسی زیستی کاتالونیا (IBEC).
پیامدهای بالینی محتمل و چالشهای پیشرو
این یافتهها محور درمانی متفاوتی برای بیماری آلزایمر پیشنهاد میکنند—محوری که سلامت عروق و پاکسازی ضایعات را هدف میگیرد، بهجای تلاش برای بازسازی مستقیم نورونهای آسیبدیده. بازسازی عملکرد BBB میتواند مکمل راهبردهای دیگر مانند آنتی‑Aβ آنتیبادیها یا درمانهای هدفگیری تاو باشد و ممکن است در مواردی که پاتولوژی ترکیبی است و نقص عروقی نقش بزرگی در علائم دارد، بهویژه مفید واقع شود.
با این حال، انتقال موفقیت در موش به فایده انسانی با موانعی روبهرو است. پروفایلهای ایمنی، اثرات خارج هدف، رژیمهای دوزدهی، توسعه تولید در مقیاس صنعتی و ایمنی ایمنیشناختی طولانیمدت باید مورد بررسی قرار گیرند. BBB در انسان پیچیدهتر است و تغییرپذیری فردی در بیان LRP1 یا پاتولوژی عروقی ممکن است پنجرههای درمانی را تحت تأثیر قرار دهد. مطالعات ایمنی پیشبالینی طراحیشده با دقت و کارآزماییهای بالینی فاز اولیه ضروری خواهند بود.
«اثرات بلندمدت از بازسازی رگهای مغزی ناشی میشود،» گفت لورنا رویز پرز از IBEC و اشاره کرد که بهنظر میرسد نانوذرات مکانیزم بازخوردی را فعال میکنند که مسیرهای پاکسازی طبیعی را از سر میگیرد. هرچند امیدوارکننده، او و همکارانش بر نیاز به کار ترجمهای دقیق و سختگیرانه قبل از استفاده در انسان تأکید میکنند.
فناوریهای مرتبط و چشمانداز آینده
این کار در تقاطع بایونیک مولکولی، شیمی فوقمولکولی و زیستشناسی عصب–عروقی قرار دارد. سازههای چندارزشی مشابه برای ایمنومدولاسیون هدفمند، بازبرنامهریزی گیرنده و بهعنوان لیگاندهای مصنوعی برای هدایت سیگنالدهی سلولی در حال بررسیاند. اگر ایمنی و اثربخشی در انسان منتقل شود، نانوذرات فوقمولکولی میتوانند به سکویی مدولار برای سایر بیماریهای عصبی تبدیل شوند که پاکسازی یا عملکرد عروقی در آنها مختل است، مانند بیماری ریز‑عروقی (small‑vessel disease) یا برخی اشکال دمانس فرونتوتمپورال.
دیدگاه کارشناسان
دکتر مایا تامپسون، نورولوژیست و پژوهشگر زیستشناسی عصب‑عروقی که در این مطالعه شرکت نداشت، اظهار داشت: «هدفگیری سد خونی–مغزی یک چرخش هوشمندانه است. بسیاری از اختلالات نورودژنراتیو دارای مولفه عروقی هستند که کمتر مورد توجه قرار گرفتهاند. این ذرات فوقمولکولی هیجانانگیزند چون روی تیم پاکسازی مغز اثر میگذارند—اگر بتوانیم ایمنی و قابلیت تکرار در مدلهای بزرگتر را اثبات کنیم، این رویکرد میتواند نحوه طراحی درمانها برای دمانس را دگرگون کند.»
این یافتهها چه مفهومی برای بیماران و ارتباط علمی دارد
برای بیماران و خانوادهها، این مطالعه سیگنالی امیدبخش ارائه میدهد: ممکن است بازگشت عملکرد مغز از طریق بازیابی سامانههای طبیعی موجود ممکن باشد، نه با مجبور کردن بازتولید سلولی. برای دانشمندان، این یافتهها اهمیت رویکردهای یکپارچه را که سلامت عروقی–عصبی را در کنار زیستشناسی نورونی در نظر میگیرند، پررنگ میسازد. در عین حال، تاکید بر نیاز به ارتباط شفاف با جامعه بالینی و عمومی درباره مراحل ترجمهای، محدودیتها و انتظارات واقعبینانه بسیار مهم است.
در مجموع، این پژوهش نهتنها نشان میدهد که اصلاح عملکرد BBB میتواند مسیر تازهای برای درمان آلزایمر فراهم کند، بلکه چارچوبی ارائه میدهد برای توسعه نانوداروهای «خودیار» که بهصورت مستقیم گیرندهها و مسیرهای سلولی را هدف میگیرند—رویکردی که ممکن است به درمانهای ترکیبی و شخصیسازیشده در دمانس بینجامد.
منبع: scitechdaily
نظرات
پمپزون
یه خورده احساس اغراق دارم، موشها خوبن اما انسان پیچیدهست... با این حال دلم میخواد نتایج بعدی واقعی باشه 🙂
رضاامیر
نکته مثبت، توجه به رگها نه فقط نورون. ترجمه به بالین طول میکشه ولی مسیر علمی شفاف و امیدوارکنندهست.
بیوانیکس
ما هم رو LRP1 کار کرده بودیم، این ایده نانوذرات خودِ درمانگر جالبه، اگر پروفایل ایمنی ثابت شه واقعا تحولیه.
توربوام
واقعاً فقط سه تزریق؟ ایمنی بلندمدت چی میشه، در موش خوبه ولی آدم یه چیز دیگه س، کسی اطلاعات ایمنی داره؟
کوینپایل
منطق داره به نظرم؛ تمرکز روی عروق شاید بهتر باشه، هزینه کمتر و اثر ترکیبی با درمانهای دیگه میتونه قوی باشه.
رودیکس
وای، اینطوری که میگن میشه سد خونی رو تعمیر کرد و حافظه برگرده؟ نجومیه، امیدوارم زودتر به انسان برسه!


ارسال نظر