10 دقیقه
خاکستری شدن مو ممکن است حامل پیامی پنهان از زیستشناسی بدن باشد: در برخی موارد، از دست رفتن پیگمنت مو کمتر شبیه یک نقص زیبایی و بیشتر شبیه یک واکنش حفاظتی به نظر میرسد. گروهی از پژوهشگران در ژاپن با استفاده از مدلهای موشی نشان دادند که سلولهای بنیادی ملانوسیت — سلولهایی که رنگ مو را تأمین میکنند — میتوانند به آسیبهای DNA بهگونهای پاسخ دهند که یا از سرطان پوست محافظت کند یا آن را ترویج دهد.
نحوه پیوند آسیب DNA، پیگمنت و سرطان
پوست و مو بهعنوان بافتهای مرزی همواره در معرض عوامل مؤثر بر ژنوم قرار دارند: تابش فرابنفش، مواد شیمیایی سرطانزا و انواع اشعه که منجر به آسیب DNA میشوند. این آسیبها میتوانند هم روند پیری را تسریع کنند و هم خطر ابتلا به سرطان را افزایش دهند، اما اینکه چگونه این آسیبها به نشانههای قابلمشاهده مانند خاکستری شدن مو مرتبط میشوند، تا کنون روشن نبوده است.
تحقیق جدید بر ملانوما متمرکز است، یک سرطان خطرناک پوست که از ملانوسیتها — سلولهای تولیدکننده رنگدانه که از سلولهای بنیادی ملانوسیت (McSCs) داخل فولیکول مو منشأ میگیرند — سرچشمه میگیرد. با پروفایلینگ بیان ژنی و پیگیری سرنوشت سلولی در موشها، دانشمندان پاسخهای متمایز McSCها را نسبت به انواع مختلف آسیب DNA نقشهبرداری کردند و مسیرهای مولکولی مرتبط با هر پاسخ را شناسایی نمودند.
Seno-differentiation: trading pigment for safety
وقتی McSCها دچار شکستهای دوتایی رشتهای DNA (double-strand breaks) میشدند — نوعی آسیب جدی که هر دو رشته مارپیچ DNA را قطع میکند — تمایل داشتند به تمایز برگشتناپذیر دست یابند و از جمع سلولهای خودنوساز حذف شوند. این فرایند که نویسندگان آن را تمایز پیریهمراه یا «seno-differentiation» توصیف کردهاند، وابسته به فعال شدن مسیر p53-p21 است؛ تنظیمکنندهای مرکزی در توقف چرخه سلولی و پاسخ به آسیب ژنتیکی. نتیجه قابلرؤیت: مو پیگمنت خود را از دست میدهد و خاکستری میشود.
از منظر عملکردی، این سازوکار زیستشناختی بسیار دقیق است. اجازه دادن به خروج سلولهای بنیادی آسیبدیده از مخزن خودنوساز، خطر بلندمدت تجمع جهشهای بیشتر در یکی از این سلولها و تبدیل شدن به منبع تومور را کاهش میدهد. به عبارت دیگر، کمی خاکستری شدن ممکن است اولویتبندی بدن برای ایمنی ارگانیسم در برابر نگهداری آرایشی باشد.
این مکانیسم حفاظتی به هنگام مواجهه با عوامل سیتوتوکسیک قوی مانند اشعه یونیزان واضحتر است؛ در این حالت فعالسازی p53-p21 سلولها را به سمت از دست دادن ظرفیت خودنوسازی و تمایز دائمی هدایت میکند که شکلی از حذف ایمن سلولهای پرخطر به شمار میآید. چنین پاسخی در بافتهای پوششی مانند پوست اهمیت دارد، زیرا از تشکیل کانونهای سلولی بدخیم جلوگیری میکند.
When damage fails to trigger the fail-safe
تمام ژنوتوکسینها مسیر حفاظتی را فعال نمیکنند. وقتی محققان پوست موشها را در معرض کارسینوژنهایی مانند اشعه فرابنفش B (UVB) و 7,12-دیمتیلبنز(a)آنتراسن (DMBA) — مادهای که اغلب برای القای تومور در مدلهای آزمایشگاهی به کار میرود — قرار دادند، McSCهای آسیبدیده رفتار متفاوتی از خود نشان دادند. به جای خروج از مخزن از طریق seno-differentiation، آنها خودنوسازی را ادامه دادند و به صورت کلونال تکثیر یافتند.
این ادامه خودنوسازی ناشی از سیگنالهایی در میکرومحیط یا niche سلولهای بنیادی بود، بهویژه فاکتور سلول بنیادی (SCF)، یک سایتوکاین که راهنماییکننده ملانوسیتها است و تمایز پیریهمراه را مهار میکند. در محیط مواجههشده با کارسینوژن، SCF و مسیرهای وابسته، از جمله سیگنالینگ KIT و تغییر در متابولیسم اسید آراشیدونیک، اجازه دادند McSCهای آسیبدیده باقی بمانند و تکثیر یابند — مسیری مولکولی که میتواند شکلگیری ملانوما را ترجیح دهد تا از دست رفتن پیگمنت را.
به عبارت دیگر، زمانی که محیط پیرامونی سیگنالهای بقا را فراهم میکند، سلولهای بنیادی آسیبدیده به جای حذف ایمن، زنده میمانند و گسترش مییابند؛ وضعیتی که احتمال تبدیل اصلاحناپذیر به بدخیمی را افزایش میدهد. ارتباط بین متابولیسم لیپیدی مانند اسید آراشیدونیک و التهاب موضعی نیز میتواند زمینهای فراهم کند که محیط را به نفع رشد تومور تغییر دهد.
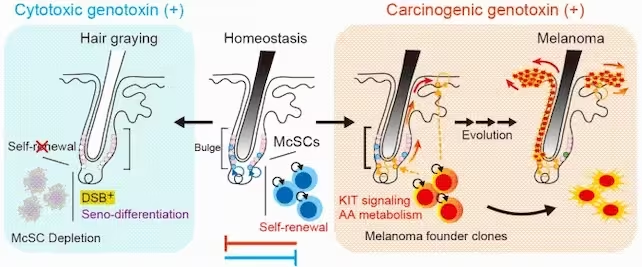
در مواجهه با ژنوتوکسینهای سیتوتوکسیک مانند اشعه ایکس، خودنوسازی McSCها مختل میشود که به کاهش جمعیت آنها و خاکستری شدن مو میانجامد. در وضعیت هموستازی، McSCها تعادل بین خودنوسازی و تولید پیگمنت را حفظ میکنند. اما ژنوتوکسینهای کارسینوژن، مسیرهای KIT را تقویت و متابولیسم اسید آراشیدونیک را تغییر میدهند و میتوانند منجر به شکلگیری ملانوما شوند. (دانشگاه توکیو)
Why this matters for skin aging and melanoma
این مطالعه خاکستری شدن مو و ملانوما را بهعنوان پیامدهای متقابل چگونگی مواجهه سلولهای بنیادی با استرس بازتعریف میکند. اگر جمعیت سلولهای بنیادی مسیر فرسودگی از طریق seno-differentiation را انتخاب کند، بافت پیگمنت خود را از دست میدهد اما ممکن است در برابر شروع تومور محافظت بیشتری بهدست آورد. اگر microenvironment بهجای آن سیگنالهای بقا فراهم آورد، سلولهای بنیادی آسیبدیده ممکن است گسترش یابند و خطر سرطان را افزایش دهند.
مهم است که پژوهشگران با احتیاط اظهار داشتهاند: موهای خاکستری لزوماً در انسان سپر قطعی در برابر سرطان نیستند. این کار با مدلهای موشی انجام شده تا مدارهای مولکولی و مکانیزمهای محتمل را آشکار کند. تأیید وجود همین پویاییها در پوست انسان نیازمند مطالعات بیشتر است که رفتار McSC انسانی، مواجهههای محیطی و سیگنالینگ niche را نسبت به هر دوی از دست رفتن پیگمنت و بروز ملانوما بررسی کنند.
از منظر پیری پوست و اپیدمیولوژی سرطان، این نتایج نشان میدهد که نشانههای ظاهری پیری مانند خاکستری شدن میتواند نشاندهنده فرایندهای محافظتی در سطوح سلولی باشد که همزمان با عوامل خطر سرطان در تعامل است. بنابراین مطالعه تعامل بین ژنتیک، محیط و سیگنالینگ محلی برای درک بهتر ریسک ملانوما ضروری است.
Experimental details and molecular players
تیم تحقیقاتی ترکیبی از پروفایلینگ بیان ژنی، درمانهای هدفمند آسیبرساندن DNA و رهگیری تبار سلولی در موشها را بهکار گرفت. آنها دو بستر کلی آسیب را از هم تفکیک کردند: ژنوتوکسینهای سیتوتوکسیک مانند تابش یونیزان که منجر به فعالسازی p53-p21 و seno-differentiation میشوند؛ و مواجهههای کارسینوژن مانند UVB و DMBA که عوامل niche حمایتکننده رشد را وارد عمل میکنند و مکانیزم تمایز حفاظتی را مسدود میسازند.
مولکولهای کلیدی که مورد توجه قرار گرفتند شامل p53 و p21 (حسگرهای آسیب و تنظیمکنندههای چرخه سلولی)، SCF (فاکتور سلول بنیادی) و سیگنالینگ KIT (نشانههای بقای مشتق از niche)، بهعلاوه تغییرات در متابولیسم اسید آراشیدونیک که به نظر با التهاب ترویجکننده تومور مرتبط است، بودند. این مسیرها پاسخ مولکولی را به نتایج قابلمشاهده مانند خاکستری شدن مو در مقابل توسعه ملانوما پیوند میدهند.
از لحاظ فنی، تحلیلهای RNA-seq تکسلولی و ردیابی لاینهای سلولی (lineage tracing) به پژوهشگران اجازه داد تا تغییرات عبارت ژنها در McSCها را بعد از انواع مختلف آسیب DNA دنبال کنند و مشخص نمایند کدام مجموعه ژنی با تمایز برگشتناپذیر و کدام با حفظ خودنوسازی مرتبط است. آزمایشهای دستکاری ژنتیکی مسیر p53-p21 و بلوک یا فعالسازی SCF/KIT نیز به تعیین علیت کمک کردند.
Implications for prevention and therapy
درک سیگنالهایی که McSCها را بهسوی فرسودگی یا گسترش سوق میدهند، درهای احتمالی مداخله را میگشاید. آیا میتوان با تنظیم سیگنالینگ SCF/KIT یا تغییر محیط التهابی، سلولهای بنیادی آسیبدیده را به سوی حذف ایمن هدایت کرد؟ آیا نشانگرهای زیستی مرتبط با فعالیت niche میتوانند پوستهایی را که در معرض خطر بالاتری برای ملانوما هستند، پیش از ظهور تودهها شناسایی کنند؟
چند نکته عملی و تحقیقاتی که از این یافتهها نشأت میگیرد شامل موارد زیر است:
- پتانسیل توسعه بیومارکرهای پوستی: نشانگرهای بیان ژن مرتبط با فعالسازی KIT یا الگوهای متابولیک اسید آراشیدونیک ممکن است بهعنوان شاخصهای خطر ملانوما استفاده شوند.
- هدفگیری میکرومحیط: داروهایی که SCF/KIT یا سیگنالهای التهابی مرتبط را تعدیل میکنند، ممکن است رشد یا بقا سلولهای بنیادی آسیبدیده را کاهش دهند بدون آنکه بازسازی طبیعی بافت را مختل کنند.
- استراتژیهای پیشگیری: شناسایی مواجهههای محیطی که مسیرهای کارسینوژن را فعال میکنند میتواند راهنمای اقدامات پیشگیرانه مانند محافظت نوری دقیقتر یا اجتناب از عوامل شیمیایی شناختهشده باشد.
احتمالات ترجمهای هنوز در مراحل ابتدایی هستند و نیاز به مطالعات بالینی و آزمایشگاهی بیشتر دارند تا اثرات جانبی و تعادل بین پیشگیری از سرطان و نگهداری عملکرد طبیعی بافت بررسی شود. با این حال، پیشرفت مفهومی واضح است: پیری بافت و سرطان پدیدههای جداگانه نیستند؛ آنها میتوانند پیامدهای متفاوتی از نحوه پاسخ سلولهای بنیادی به استرس ژنوتوکسیک باشند.
Expert Insight
دکتر مایا رینولدز، متخصص پوست و پژوهشگر سلولهای بنیادی (نمونهٔ تخیلی)، زاویهٔ عملی این مطالعه را اینگونه خلاصه میکند: «این کار پیری ظاهری — مانند خاکستری شدن — را به نقاط تصمیمگیری مولکولی عمیق در سلولهای بنیادی پیوند میزند. اگر بتوانیم این تصمیمها را در پوست انسان بخوانیم، ممکن است به نشانگرهای هشداردهنده اولیه برای ریسک ملانوما و راهکارهای پیشگیرانهٔ نوینی دست یابیم که به جای تومور، روی niche سلولهای بنیادی عمل میکنند.»
تحقیقات بعدی باید این مسیرها را در بافتهای انسانی تایید کند، نقشهای از چگونگی تأثیر مواجهههای طول عمر بر سرنوشت McSCها ارائه دهد و بررسی کند که آیا دستکاری سیگنالهای niche میتواند شیوع ملانوما را بدون آسیب زدن به نگهداری طبیعی بافت کاهش دهد یا خیر. علاوه بر مطالعات مولکولی، مطالعات اپیدمیولوژیک که ارتباط بین علائم پیری پوست (از جمله خاکستری شدن مو)، سابقه تابش و قرارگیری در معرض مواد شیمیایی و وقوع ملانوما را ارزیابی میکنند نیز ضروری است.
در پایان، این یافتهها به پزشکان، محققان و عموم میآموزد که نشانههای ظاهری مانند خاکستری شدن مو ممکن است بیش از یک موضوع زیبایی باشند: آنها میتوانند پنجرهای به فرایندهای حفاظتی و پرخطر در سطح سلولی باز کنند. توجه به چنین پیوندهایی میتواند در بلندمدت به بهبود تشخیص زودهنگام، پیشگیری هدفمند و طراحی درمانهایی منجر شود که ریسک ملانوما را با کمترین اختلال در عملکرد طبیعی پوست کاهش دهند.
منبع: sciencealert
نظرات
نوا_x
اگه بشه SCF/KIT رو هدف گرفت ممکنه راه برای پیشگیری باز شه، ولی عوارض و تاثیر روی ترمیم بافت چطور حل میشه؟
آسمانچرخ
خوبه اما یه کم اغراق داره، هنوز کلی فاصله تا ترجمه به درمان وجود داره... ایدهها امیدوارکننده اما واقعگرایانه باشیم
رامین
برداشت متعادلیه، به شرطی که در انسان هم تایید بشه. اما اینکه خاکستری شدن واقعا یه سپر در برابر ملانوما باشه هنوز سوالیه
بیوانیکس
من تو آزمایشگاه دیدم microenvironment خیلی تعیینکنندهست؛ مقاله ایدهی خوبی میده ولی بدون داده انسانی هنوز زوده بخوایم نتیجه بگیریم
توربو
واقعاً این روی انسان هم صدق میکنه؟ مدل موشی خوبه اما خیلی چیزا فرق میکنه، مخصوصا niche و محیط التهابی
بلاک
معقول به نظر میاد، شاید خاکستری مو نشانهای از یه مکانیسم محافظتی باشه نه صرفا پیری، اما هنوز معلوم نیست روی انسان هم صدق کنه
پالس
وااای یعنی خاکستری شدن مو ممکنه آلارم بدن باشه؟ انگار بدن گاهی زیبایی رو فدای ایمنی میکنه... عجیب و در عین حال منطقی


ارسال نظر