10 دقیقه
دانشمندان دانشگاه ویسکانسین-مادیسون یک همکاری مولکولی شگفتانگیز را کشف کردهاند که به حفظ انتهای کروموزومها کمک میکند. این یافته ارتباط یک پروتئین شناختهشده اتصالدهنده به DNA را با فعالیت تلومراز نشان میدهد و نور جدیدی بر علت برخی از اختلالات تهدیدکننده زندگی مرتبط با کوتاهشدن نامشخص تلومرها میتاباند.
چرا تلومرها اهمیت دارند و معمای اولیه از کجا آغاز شد
تلومرها کلاهکهای تکراری از نوکلئوتید و پروتئین هستند که در انتهای کروموزومها قرار دارند و از باز شدن و از بین رفتن اطلاعات ژنتیکی جلوگیری میکنند. در هر بار تقسیم سلولی، تلومرها اندکی کوتاه میشوند؛ این فرایند بخشی طبیعی از فرایند پیری سلولی است. اما وقتی کوتاهشدن بیش از حد شود یا نگهداری تلومرها بهدرستی انجام نشود، پایداری DNA به خطر میافتد و سلولها ممکن است نتوانند تقسیم شوند یا دچار مرگ شوند — پدیدههایی که در پسزمینه سندرمهای پیری زودرس و چندین اختلال شدید خونی قرار دارند.
تحقیقات پیشین بهطور مکرر نقش معیوب بودن تلومراز، آنزیمی که وظیفه بازسازی تلومرها را بر عهده دارد، را با شرایط بالینی مانند کمخونی آپلاستیک، سندروم میلودیسپلاستیک و لوسمی میلوئیدی حاد مرتبط ساختهاند. با اینحال، در بسیاری از بیمارانی که تلومرهای بسیار کوتاهی دارند، هیچ جهشی در خودِ ژنهای تلومراز قابل مشاهده نبود تا بتواند علت بیماری را توضیح دهد. همین شکاف در فهم بیولوژیک و بالینی انگیزه انجام مطالعه جدیدی شد که اکنون نتایج آن گزارش شده است.
درک بهتر مکانیزمهای نگهداری تلومر و عملکرد تلومراز برای تشخیص ژنتیکی، مشاورهٔ خانوادهها و در نهایت طراحی راهکارهای درمانی هدفمند، از اهمیت بالایی برخوردار است. این کشف میتواند به عنوان یک گام مهم در بهبود رویکردهای تشخیصی برای بیماران مبتلا به «کوتاهشدن تلومر» (short-telomere syndromes) شناخته شود.
چگونه یک شریک غیرمنتظره بهصورت برجستهای آشکار شد
تیم تحقیقاتی به سرپرستی پروفسور Ci Ji Lim از دانشگاه ویسکانسین-مادیسون از AlphaFold، یک ابزار یادگیری ماشین برای پیشبینی ساختار و تعاملات پروتئینی، استفاده کردند تا پروتئینهایی را که ممکن است با تلومراز انسانی تعامل داشته باشند شناسایی کنند. غربالگریهای محاسباتی آنها، پروتئین تکرشتهای اتصالدهنده به DNA به نام «پروتئین تکرشتهای تکثیر» یا RPA را بهعنوان یک همکار محتمل تلومراز معرفی کرد؛ پروتئینی که بهطور گسترده در فرایندهای تکثیر و تعمیر DNA شناخته شده است.
پروتئین RPA نقشهای متعددی در تثبیت تکرشتههای DNA، حمایت از ماشینآلات تکثیر و کمک در مسیرهای بازسازی DNA ایفا میکند. پیشنهاد اینکه RPA ممکن است فراتر از این عملکردهای کلاسیک خود نقش مستقیم یا واسطهای در تنظیم تلومراز داشته باشد، مسیر جدیدی برای بررسی مکانیزم مولکولی نگهداری تلومرها گشود. این ایده ارتباط بالقوه بین پروتئینهای اتصالدهنده به DNA و فعالیت آنزیمی تلومراز را در یک چارچوب جدید قرار میدهد.
علاوه بر آن، کشف تعامل احتمالی RPA با تلومراز به ما کمک میکند فرایندهای پیچیده همگامسازی تکثیر DNA، تعمیر و حفظ تلومر را بهتر بفهمیم؛ حوزهای که برای پزشکی ژنتیکی و تحقیقات سرطان اهمیت فزایندهای دارد.
از مدل محاسباتی تا مولکول: تایید تجربی
بر پایه پیشبینیهای AlphaFold، دانشجوی دکتری سوراو آگراوال، پژوهشگر علمی شیوهوا لین و پژوهشگر پسا دکتری Vivek Susvirkar آزمایشهای بیوشیمیایی را انجام دادند که فرضیه محاسباتی را تایید کرد. در سلولهای انسانی، وجود RPA برای تحریک فعالیت تلومراز و کمک به حفظ طول تلومر ضروری بود. به عبارت دیگر، RPA نه تنها به DNA تکرشتهای در طول تکثیر و تعمیر متصل میشود، بلکه به تلومراز نیز کمک میکند تا وظیفهاش را در انتهای کروموزومها انجام دهد.
تأیید تجربی این تعامل شامل مجموعهای از تکنیکهای کلاسیک بیوشیمیایی و سلولی بود که در آنها از روشهایی مانند ایمونواپرسیپیتاسیون مشترک (co-IP)، آزمونهای فعالیت تلومراز (مانند TRAP)، و بررسی تغییرات طول تلومر پس از تداخل یا حذف RPA استفاده شد. این رویکرد چندوجهی بهطرز قویتری نقش RPA را در حمایت از فعالسازی تلومراز نشان داد.
از منظر ساختاری، پیشبینیهای AlphaFold کمک کرد تا نواحی تبادلکننده پتانسیل بین RPA و زیرواحدهای تلومراز شناسایی شوند، که سپس با جهشزایی هدفمند و آزمایشهای عملکردی مورد آزمایش قرار گرفتند. این ترکیب بین محاسبات و آزمایشگاه مرزی میان زیستشناسی محاسباتی و بیوشیمی مولکولی را برجسته میکند.
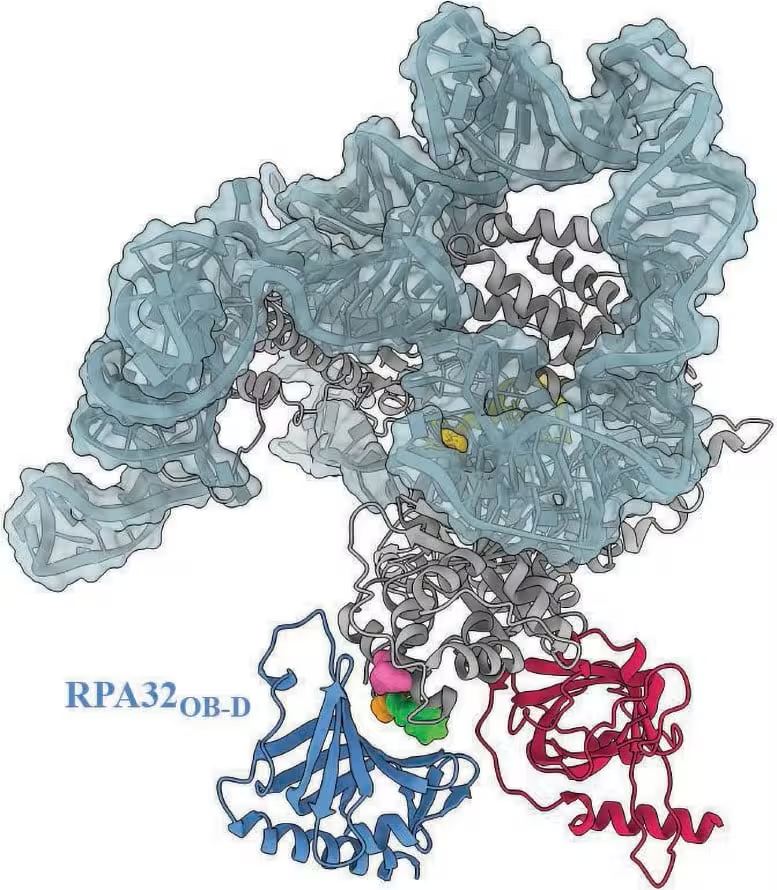
مدلی از کمپلکس تلومراز انسانی نقاطی را که RPA پیشبینی شده در آن لنگر بیندازد برجسته میکند. سه واریانت ساختاری تلومراز که با بیماران مبتلا به بیماریهای مختلف مرتبط شدهاند، درون این ناحیهٔ اتصال قرار میگیرند؛ این امر نشان میدهد که این واریانتها ممکن است تعامل RPA با تلومراز را مختل کنند. اعتبار تصویر: Ci Ji Lim
پیامدهای بالینی: توضیحی گمشده برای بیماریهای کوتاهشدن تلومر
لیم بر اهمیت بالینی یافتهها تأکید کرد: «این خط پژوهش فراتر از درک بیوشیمیایی یک فرایند مولکولی است. این پژوهش درک بالینی بیماریهای تلومری را عمیقتر میکند.» تیم نشان داد که برخی واریانتهای تلومراز مرتبط با بیماری در ناحیهٔ پیشبینیشدهٔ لنگرگاه RPA قرار دارند. این همگامی فضایی نشان میدهد که آن واریانتها ممکن است مانع از تحریک تلومراز توسط RPA شوند و پدیدهٔ کوتاهشدن تلومرِ بدون توضیح بالینی را در برخی بیماران ایجاد کنند.
اهمیت بالینی این یافته چندجانبه است: نخست، این کشف یک هدف جدید برای غربالگری ژنتیکی بیماران با کوتاهشدن ناشناختهٔ تلومر فراهم میکند. بهجای تمرکز صرف بر ژنهای تلومراز، اکنون میتوان واریانتهایی را بررسی کرد که ممکن است تعامل RPA–تلومراز را مختل کنند. دوم، با استفاده از آزمایشهای بیوشیمیایی مشخص میتوان اثر واریانتهای بیماران را بر اتصال RPA یا تحریک تلومراز ارزیابی کرد و در نتیجه مکانیسمهای مولکولی بیماری را بهتر تبیین نمود.
این بینش میتواند نتایج تشخیصی را برای خانوادههایی که با سندرمهای کوتاهشدن تلومر دست به گریبان هستند بهبود بخشد، مشاورهٔ ژنتیکی دقیقتری فراهم آورد و مسیر را برای تحقیق در مورد گزینههای درمانی مبتنی بر بازگرداندن یا شبیهسازی نقش RPA در تحریک تلومراز هموار سازد.
همچنین این یافتهها توجه بالینی را به اهمیت تعامل پروتئینهای کمکی در فعالیت تلومراز جلب میکند؛ یعنی بیماریهای تلومری تنها ناشی از جهش در اجزای اصلی آنزیم نیستند بلکه میتوانند نتیجه صدمه دیدن شبکهٔ تنظیمی اطراف آن نیز باشند.
علاقهمندی جهانی و گامهای بعدی برای آزمایش
این پژوهش تاکنون توجه بینالمللی را جلب کرده است. لیم گزارش داده است که از سوی پزشکان و پژوهشگرانی از کشورهایی از جمله فرانسه، اسرائیل و استرالیا درخواستهایی برای توسعه آزمایشهای بیوشیمیایی دریافت شده است تا بررسی کنند آیا جهشهای بیماران بر اتصال RPA یا تحریک تلومراز تأثیر میگذارد یا خیر.
لیم گفت: «برخی بیماران با اختلالات کوتاهشدن تلومر وجود دارند که با دانش قبلیِ ما قابل توضیح نبودند. اکنون پاسخی برای علت پایهٔ برخی از این جهشهای بیماری کوتاهشدن تلومر داریم: نتیجهٔ ناتوانی RPA در تحریک تلومراز است.» با استفاده از آزمایشهای بیوشیمیایی هدفمند، تیم میتواند واریانتهای بیماران را ارزیابی کند و به پزشکان اطلاعاتی در مورد مکانیسمهای محتمل، پیشآگهی و زوایای درمانی احتمالی ارائه دهد.
در سطح عملی، ساخت پروتکلهای استاندارد برای آزمونهای پیوند پروتئین-پروتئین، آزمونهای فعالیت تلومراز و بررسی طول تلومر در نمونههای بالینی از اولویتها خواهد بود. همچنین توسعه بانک دادهٔ واریانتهای مرتبط با تداخل RPA–تلومراز میتواند به جوامع بالینی و پژوهشی در تفسیر واریانتها کمک کند.
افزون بر این، همکاریهای بینالمللی میتواند به آزمون و اعتبارسنجی یافتهها در جمعیتهای مختلف ژنتیکی کمک کند، زیرا فراوانی و اثر انواع واریانتها میتواند بین جمعیتها تفاوت داشته باشد.
ابزارها و فناوریهایی که این نتیجه را ممکن ساختند
این مطالعه نشان میدهد چگونه ابزارهای مدرن پیشبینی ساختار مانند AlphaFold میتوانند آزمایشهای مرطوب آزمایشگاهی (wet-lab) را هدایت کنند. با اولویتبندی تعاملات نامزد بر پایهٔ محاسبات، پژوهشگران فضای جستجو را محدود کردند و سپس نقش RPA را از طریق آزمونهای بیوشیمیایی کلاسیک تایید نمودند. این روش ترکیبی مسیر از فرضیه تا بینشهای بالینی مرتبط را تسریع میکند و نقش همکاری بین زیستشیمی و زیستشناسی ساختاری محاسباتی را برجسته میسازد.
علاوه بر AlphaFold، تکنیکهایی مانند طیفسنجی جرمی برای شناسایی قطعات کمپلکسهای پروتئینی، تصویربرداری کرایوالکترون میکروسکوپی برای مشاهده ساختارهای بزرگتر و ابزارهای بیوانفورماتیک برای تحلیل واریانتهای ژنتیکی نقشی مکمل ایفا کردند. ترکیب این فناوریها به پژوهشگران اجازه داد تا از سطح پیشبینی به سطح مشاهده و سپس به سطح عملکرد منتقل شوند.
از منظر متدولوژیک، این مطالعه نمونهای از روند جدیدی در زیستشناسی مولکولی است که در آن پیشبینیهای محاسباتی هوزماندهٔ طراحی آزمایشها و شناسایی اهداف را تسهیل میکنند؛ امری که میتواند هزینه و زمان توسعهٔ تحقیق را کاهش دهد و مسیر انتقال پژوهش به کاربردهای بالینی را کوتاهتر کند.
دیدگاه تخصصی
دکتر النا مورالس، ژنتیکمولکولی که با این مطالعه همکاری نداشت، گفت: «ارتباط دادن RPA با تلومراز یک لایهٔ جدید تنظیم برای حفظ تلومر باز میکند. از منظر بالینی، این به توضیح بخشی از بیماران با کوتاهشدن ناشناختهٔ تلومر کمک میکند. از منظر درمانی، بازگرداندن یا شبیهسازی تحریک تلومراز توسط RPA میتواند مسیر امیدوارکنندهای برای پژوهش درمانی باشد.»
با گسترش آزمونها و بررسی واریانتهای بیماران برای اثرات بر تعامل با RPA، ممکن است شاهد تشخیص سریعتر برای خانوادههایی باشیم که تحت تأثیر سندرمهای کوتاهشدن تلومر قرار دارند و در درازمدت، استراتژیهای درمانی مبتنی بر مکانیزم مولکولی شکل گیرد. بهعنوان مثال، در آینده ممکن است درمانهایی بر اساس مولکولهای کوچک یا پروتئینهای مهندسیشده طراحی شود که توانایی RPA در تحریک تلومراز را تقویت یا بازسازی کنند.
در نهایت، این پژوهش نه تنها به پرسشهای بیولوژیک پایه پاسخ میدهد، بلکه دریچههایی را به سوی کاربردهای بالینی و توسعهٔ آزمایشهای تشخیصی دقیقتر و درمانهای هدفمندتر میگشاید. ادامهٔ کار، شامل اعتبارسنجی بالینی گسترده، توسعهٔ پروتکلهای استاندارد آزمایشی و بررسی ایمنی و کارایی رویکردهای درمانی پیشنهادی خواهد بود.
منبع: scitechdaily
نظرات
داونیکس
خوبه اما یه کم هیجانزدهشده به نظر میاد، AlphaFold مسیر باز کرده ولی نباید زود به درمان امیدوار شد 😊، اول باید اعتبارسنجی دقیق انجام بشه
آسمانچرخ
تحلیل متوازن و خوبیه، ترکیب محاسبات و آزمایشگاهی دقیقا راهِ آیندهست، فقط لازم دارن پروتکل استاندارد بسازن و بینالمللی بسنجن
مهران
تو لابراتوار دیدم که پروتئینای کمکی گاهی اثر بزرگ دارن، این یافته میتونه علت بعضی بیماریها رو توضیح بده، اما راه درمان طولانیه
بیونیکس
آیا این قطعیه؟ AlphaFold عالی ولی پیشبینیه، تا وقتی تو نمونههای بالینی تایید نشه نمیشه صددرصد قضاوت کرد، سوالات باقیه
کوینپی
واقعن منطقیه، تمرکز فقط روی ژن تلومراز کم بود، شبکهٔ کمکی پروتئینها خیلی مهمه. میتونه تو تشخیص کمک کنه
دادهپالس
وااای، RPA عملاً تلومراز رو تحریک میکنه؟! یعنی هنوز کلی چیز پشت صحنهست، شگفت انگیزه ولی باید تو بیماران هم دیده بشه...

ارسال نظر