8 دقیقه
سلولهای ایمنی «جوان» ویژهای که از سلولهای بنیادی القایی پرتوان انسانی (iPSCs) ساخته شدهاند، بهنظر میرسد بتوانند بخشی از عملکرد شناختی و سلامت سلولهای مغزی را در موشهای مسن بازیابی کنند، بر اساس مطالعهای جدید از مرکز پزشکی Cedars-Sinai. این پژوهش مسیر سلولی احتمالی برای مقابله با کاهش مرتبط با پیری و برخی ویژگیهای بیماری آلزایمر را نشان میدهد، هرچند محدودیتها و چالشهای مهمی همچنان باقی است.
چرا «پاککنندههای ایمنی» برای مغزِ پیر مهماند
فاگوسیتهای تکهستهای (mononuclear phagocytes) گروهی از سلولهای ایمنی متحرک هستند که در سراسر بدن گشت میزنند و ضایعات و سلولهای مرده را پاک میکنند. در مغز، شکل تخصصیشدهٔ این سلولها — میکروگلیا — نقش مهمی در کنترل التهاب عصبی، حذف پروتئینهای تجمعیافته و تنظیم سیناپسها دارد. با افزایش سن، این پاککنندهها کارآیی خود را از دست میدهند و گرایش بیشتری به ایجاد یا تشدید التهاب نشان میدهند؛ ترکیبی که با کاهش شناختی و بیماریهای نورودژنراتیو مانند آلزایمر مرتبط بوده است. تحقیقات نشان میدهد تغییر در عملکرد میکروگلیا میتواند منجر به افزایش سیتوکینهای التهابی، کاهش پاکسازی آمیلوئید-بتا و اختلال در هموستاز عصبی شود؛ عواملی که در فضای تحقیقاتی پیرامون پیری مغز و بیولوژی آلزایمر اهمیت دارند.
چگونگی ساختن یک سیستم ایمنی «جوانتر» توسط پژوهشگران
بهجای انتقال مستقیم خون جوان، تیمی به رهبری دانشمندان Cedars-Sinai دستههایی از فاگوسیتهای تکهستهای را در آزمایشگاه از سلولهای بنیادی القایی پرتوان انسانی (iPSCs) تولید کردند. iPSCها در واقع سلولهای بالغ بازبرنامهریزیشدهای هستند که میتوان آنها را به طیف وسیعی از انواع سلولی متمایز کرد؛ این ویژگی امکان تأمین منبعی تجدیدپذیر، قابلسفارشیسازی و بالقوهٔ خودی (autologous) برای درمانهای سلولی را فراهم میآورد. پژوهشگران این فاگوسیتهای مهندسیشده و جوان را به موشهای مسن و همچنین به مدلهای موشی دارای پاتولوژی شبیه به آلزایمر تزریق کردند تا بررسی کنند آیا این مداخله میتواند شناخت و سلامت مغز را تغییر دهد یا خیر. در فرایند گزارششده، تیم به جزئیاتی نظیر پروتکلهای تمایز سلولی، معیارهای کیفی تولید سلولی و استانداردهای تولید مطابق با الزامات بالینی اشاره داشتهاند که اهمیت مقیاسپذیری و ایمنی تولید در مسیر ترجمه بالینی را نشان میدهد.
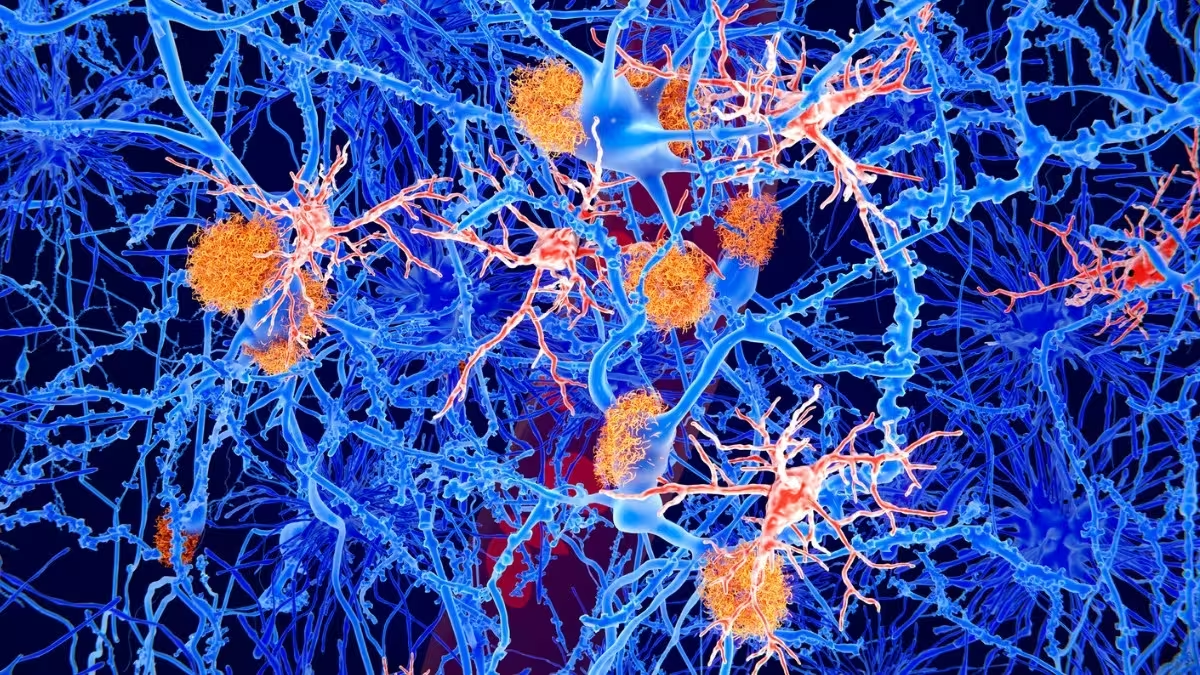
تصویری از پلاکهای آمیلوئید (نارنجی) و سلولهای میکروگلیا (قرمز) در میان نورونها
پیشرفتهای امیدوارکننده — اما نه راهحلی کامل
در آزمونهای رفتاری مانند «کار مکان شیء جدید» (novel object location task) که حافظه فضایی را میسنجد، موشهای مسنی که سلولهای ایمنی تولیدشده در آزمایشگاه (در مطالعه با عنوان «Aging iMP» شناخته شدهاند) دریافت کردند، در سطوح قابل مقایسهای با حیوانات کنترل جوانتر ظاهر شدند. این حیوانات درمانشده همچنین نشانگرهایی از میکروگلیای سالمتر و حفظ سلولهای موسّی — گروهی از نورونهای هیپوکامپ که نقش مهمی در عملکرد حافظه دارند و معمولاً در پیری و آلزایمر کاهش مییابند — را نشان دادند. چنین نشانههایی حاکی از آن است که تغییر در محیط ایمنی پیرامون نورونها میتواند به بقای جمعیتهای حساس عصبی کمک کند و بدیهی است که این مسیر میتواند از منظر درمانی متفاوت از تلاش مستقیم برای حذف همهٔ پلاکها باشد.
نویسندهٔ اصلی مطالعه، الکساندرا موزر، و همکاران گزارش کردهاند که شمار سلولهای موسّی در موشهای تحت درمان کاهش نیافته است که با بهبودهای مشاهدهشده در حافظه ارتباط منطقی دارد. همنویسنده کلایو سروِنسن این استراتژی را بهعنوان جایگزینی عملی برای تزریق خون جوان مطرح کرد: بهجای انتقال پلاسما یا خون کامل، سلولهای ایمنی تولیدشده در آزمایشگاه میتوانند عوامل جوانکنندهٔ مولکولی را منتقل کنند و درعینحال مطابق استانداردهای تولید بالینی ساخته شوند تا مسائل مربوط به همخوانی ایمنی و ایمنی طولانیمدت بهتر مدیریت شود.
در واقع چه چیزی به مغز رسید؟
نکتهٔ قابل توجه این است که بهنظر نمیرسد سلولهای ایمنی تزریقشده مستقیماً به مغز مهاجرت کرده باشند. این امر نشاندهندهٔ مکانیزمی غیرمستقیم است: ممکن است فاگوسیتهای تکهستهای جوان در گردش، پروتئینها یا واکوئلهای بیرونسلولی مفیدی (extracellular vesicles یا exosomes) ترشح کنند که قادر به عبور از سد خونی-مغزی یا تأثیرگذاری از راه دور بر میکروگلیاهای ساکن مغز باشند؛ این مولکولها میتوانند التهاب را کاهش دهند، میکروگلیا را تحریک کنند یا مسیرهای هموستاتیک را بازتنظیم کنند. تعامل سیستمیک-به-مغز و نقش عوامل ناشی از سیستم گردش خون در زیستشناسی پیری مغز، حوزهٔ فعالی در نورواِمونولوژی و تحقیقات پیری است و مطالعات قبلی در زمینهٔ انتقال خون جوان یا پیوند مغز استخوان نشان دادهاند که سیگنالهای محیطی میتوانند تأثیرات قابلتوجهی بر عملکرد شناختی داشته باشند.
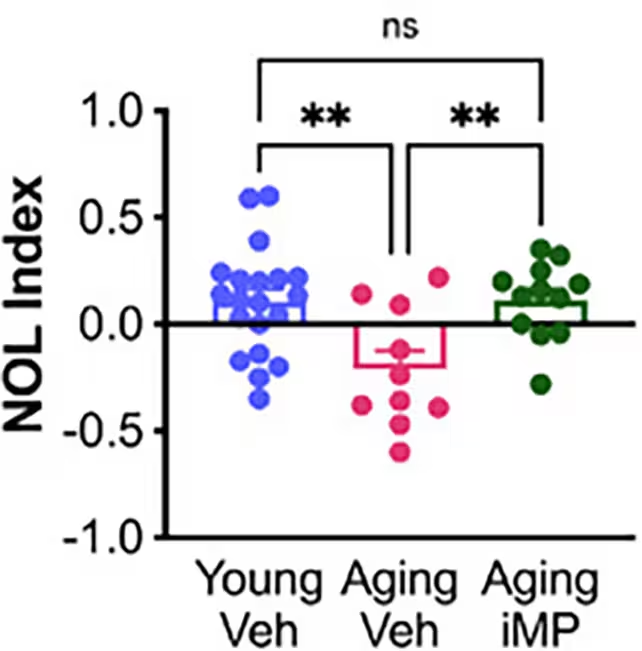
محدودیتها و ملاحظات
فواید مشاهدهشده در این مطالعه در موشهای مسنِ طبیعی برجستهتر بود؛ نتایج در حیوانات مدلِ آلزایمر متواضعتر بودند. آسیبهای مرتبط با آلزایمر — از جمله تجمع آمیلوئید-بتا و دیگر تغییرات پاتولوژیک — بهطور کامل معکوس نشدند. علاوه بر این، نتایج حاصل از مدلهای جوندگان الزاماً قابلتعمیم به انسان نیستند. ترجمهٔ این رویکرد به بالین نیازمند اثبات ایمنی در بلندمدت، تعیین دوز و فرکانس درمان، انتخاب مسیر تحویل بهینه (مثلاً وریدی در مقابل داخلصفحهای یا تزریقهای تخصصی) و نشان دادن پایداری اثرات در مدلهای بزرگتر و مرتبطتر با بالین است. نگرانیهای بالقوهٔ ایمنی شامل پاسخهای ایمنی میزبان، خطر تغییرات نامطلوب در سلولهای مهندسیشده و نیاز به تضمین عدم تشکیل تومور یا ناهنجاریهای بافتی است.
مسیر احتمالی بهسمت درمان و جهتهای آینده
اگر بتوان فاگوسیتهای تکهستهای مشتق از iPSC را از سلولهای خود بیمار تولید کرد، این رویکرد ممکن است برخی از عوارض انتقال پلاسما یا پیوند مغز استخوان را کاهش دهد، ازجمله مشکلات مربوط به ناسازگاری ایمنی و نیاز به سرکوب ایمنی مزمن. تیم تحقیق پیشنهاد میکند که درمان سیستمیک کوتاهمدت ممکن است برای بازتنظیم سیگنالدهی ایمنی و بهبود شناخت کافی باشد؛ اگر این فرض ثابت شود، مسیرهایی برای درمانهای متمرکز بر سلول یا درمانهای مبتنی بر وزیکولهای خارجسلولی بدون نیاز به پیوند سلولی کامل باز میشود. علاوه بر این، گسترش تولید تحت شرایط GMP، تحلیل پروتئومیک و ترنسکریپتومیک برای شناسایی فاکتورهای فعال، و توسعهٔ راهکارهای تحویل هدفمند (مانند وزیکولهای خارجسلولی مهندسیشده یا ناقلهای بیولوژیک) از گامهای مهم بعدی در جهت تبدیل این یافتهها به گزینههای درمانی بالقوه خواهند بود.
دیدگاه کارشناسی
«این مطالعه سامانهٔ ایمنی را بهعنوان یک اهرم برای جوانسازی مغز برجسته میکند،» میگوید نِوروایمونولوژیست خیالی، دکتر لنا اورتیز از مؤسسهٔ بهداشت مغز. «حتی بدون ورود مستقیم سلولها به مغز، سلولهای ایمنی محیطی میتوانند پیامهای مولکولی ارسال کنند که التهاب را بازشکل میدهند و شبکههای نورونی را حمایت میکنند. چالش کنونی این است که آن پیامهای مولکولی را به درمانی قابلتکرار، اثربخش و ایمن برای انسان تبدیل کنیم.» این دیدگاه بر نیاز به مطالعات مکانیزمی، شناسایی عوامل مؤثر و ارزیابی مخاطرات و مزایا در مدلهای پیشبالینی تأکید دارد.
جایگاه این پژوهش در تصویر کلیتر
این یافتهها به مجموعه شواهد فزایندهای اضافه میکنند که عوامل سیستمیک — پروتئینهای موجود در خون، سلولهای ایمنی و وزیکولهای خارجسلولی — نقش مهمی در پیری مغز بازی میکنند. در مطالعات گذشته، دریافت خون یا مغز استخوان جوان نشان داده که میتواند به بهبود عملکرد شناختی در حیوانات مسن منجر شود؛ مطالعهٔ حاضر فاگوسیتهای تکهستهای را بهعنوان میانجیای محتمل مشخص میکند و راهی قابلتولید برای بازتولید آن اثر پیشنهاد میدهد. در ادامهٔ مسیر پژوهشی، نگاشت مولکولهای فعال آزادشده توسط سلولهای مهندسیشده، بررسی وزیکولهای خارجسلولی بهعنوان درمان بدون سلول و انجام مطالعات ایمنی پیشبالینی اهمیت دارد. اگر میانجیهای مولکولی شناسایی شوند، میتوانند اهدافی برای داروها یا بیولوژیکهایی باشند که سیگنال جوانکننده را بدون نیاز به پیوند سلولی تقلید کنند.
همچنین این رویکرد مفهومی متفاوتی را پیشنهاد میکند: بهجای تمرکز صرف بر حذف هر پلاکِ آمیلوئیدی، تقویت محیط ایمنی مغز و سلولهای پشتیبان نورونی ممکن است عملکرد را حفظ کرده و روند زوال شناختی را به تعویق بیندازد. این فکر با تغییرات اخیر در استراتژیهای درمانی آلزایمر همسو است که بیش از پیش به نقش عوامل نور ایمنی و هموستاز بافتی توجه میکنند.
در مجموع، اگرچه این تحقیق هنوز فاصلهٔ قابلتوجهی تا درمانهای انسانی دارد، اما نشان میدهد که مداخله در سطح سیستمیک ایمنی میتواند مسیر جدیدی برای پیشگیری یا کاهش کاهش شناختی مرتبط با سن و برخی جنبههای آلزایمر فراهم کند و بحثهای آینده را به سمت ترکیب درمانهای سلولی، وزیکولی و مولکولی برای حفظ سلامت مغز سوق دهد.
منبع: sciencealert
نظرات
توربوک
کمی اغراق داره، نتایج امیدوارکننده اما نه درمان قطعی. خیلی کار مونده؛ ایمنی و احتمال تشکیل تومور بزرگه.
پمپزون
دیدگاه جالبیه؛ تاکید روی تاثیرات سیستمیک منطقیه. با این حال موش صرفا یه شروعه، نتیجهگیری زودیه.
اتو_آر
تو آزمایشگاه کار نکردم ولی دیدن این راهکار سریع و سیستمیک یادم آورد پروژه وزیکول که باهاش کار کردیم، امیدوارم انسان هم جواب بده
آرمین
واقعیه؟ یعنی این سلولها اصلا وارد مغز نمیشن و از دور تاثیر میذارن؟ اگه اینطوره پس چی منتقل میشه دقیقا
بیونیکس
معقول به نظر میاد ولی ترجمه به انسان داستانش جداست. دوزها و ایمنی و پایداری چطور مشخص میشه؟
روداکس
واقعا شگفتانگیزه، فکرش رو نمیکردم که سلولهای iPSC بتونن حافظهی موشِ پیرو تا این حد بهتر کنن... امیدواری ولی هنوز خیلی سوالا هست 😯


ارسال نظر