8 دقیقه
جمعیت بسیار کوچکی از نورونها که نسبت به استرس حساساند و در لایههای عمیق قشر مغز قرار دارند، ممکن است جریان خون و فعالیت الکتریکی سراسر مغز را هماهنگ کنند. آزمایشهای جدید در موشها نشان میدهد که این سلولهای نادر — که بهعنوان نورونهای nNOS نوع I شناخته میشوند — نقش بسیار برجستهای در ریتمهای خواب، پاکسازی ضایعات متابولیک و احتمالاً مراحل ابتدایی بیماریهای نورودژنراتیو ایفا میکنند. شواهد نشان میدهد که این نورونها میتوانند بر واسموشن (نوسانات عروقی)، موجهای کند دلتا و سینکِ همزمانی نیمکرهها تأثیر بگذارند و از این طریق بر سلامت شناختی و پاکسازی بینابینی مغز نقش داشته باشند.
چگونه چند سلول میتوانند کل مغز را تحت تاثیر قرار دهند
نورونهای nNOS نوع I پراکندگی بسیار کمی دارند و عمدتاً در لایههای عمیق قشر پنهاناند، اما به نظر میرسد که تأثیر آنها نسبت به شمارشان بسیار بزرگ است. پژوهشگران دانشگاه ایالتی پنسیلوانیا از روشهای هدفمند برای حذف این نوع سلولها در موش استفاده کردند و سپس تغییرات جریان خون مغزی، نوسانات آهسته عروقی که به آنها واسموشن گفته میشود، و کلیت فعالیت عصبی را زیر نظر گرفتند. این رویکردِ سلول-محور (cell-specific ablation) امکان جداسازی نقش مستقیم این نورونها را بدون وارد آوردن آسیب گسترده به بافتهای اطراف فراهم کرد.
نتایج چشمگیر بودند. حیواناتی که نورونهای nNOS نوع I را نداشتند کاهش جریان خون سراسری مغزی، واسموشن ضعیفتر و کاهش در نرخ شلیک نورونها را نشان دادند. امواج کند دلتا — ریتمهای مغزی مرتبط با خواب عمیق و تثبیت حافظه — در دامنهٔ خود کاهش یافتند و هماهنگی طبیعی بین نیمکرهٔ چپ و راست ضعیف شد. این مجموعه تغییرات نشان میدهد که حذف همین جمعیت اندک میتواند بر تعامل میان شبکههای عصبی و عروق تأثیر گذاشته و کارایی عملکردهای شبانهٔ پاکسازی مغز را کاهش دهد.
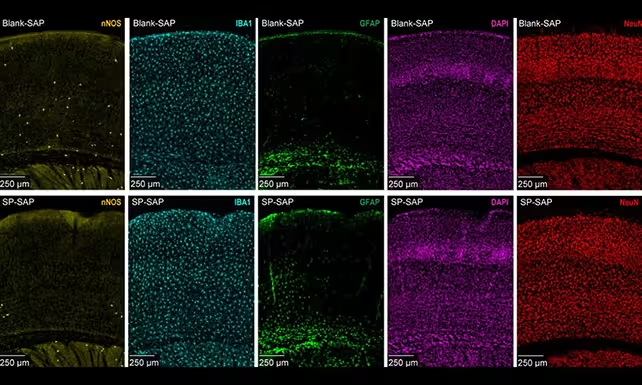
نورونهای nNOS نوع I (به رنگ زرد) بسیار کمتر از انواع دیگر هستند و پژوهشگران این سلولها را بهصورت انتخابی حذف کردند.
چرا واسموشن و موجهای کند اهمیت دارند
واسموشن به انبساط و انقباض ریتمیک خودبهخودی شریانها، رگها و مویرگهای مغزی هر چند ثانیه اشاره دارد. این نوسان پیوسته به حرکت مایعات بینابینی و مایع مغزی-نخاعی از میان بافت مغز کمک میکند، فرآیندی که پاکسازی ضایعات متابولیک را تسهیل میکند. ضعف در واسموشن میتواند تخلیهٔ پروتئینهای سمی — مانند پروتئینهای درگیر در بیماری آلزایمر — را دچار اختلال کند و در بلندمدت به تجمع مواد مضری منجر شود که با خطر نورودژنراسیون مرتبطاند.
گروه پن استیت دریافت که کاهش جریان خون و فعالیت عصبی در طول خواب شدت بیشتری داشت، زمانی که امواج دلتا بهطور طبیعی غالباند. این ارتباط یک احتمال مهم را مطرح میکند: اگر نورونهای nNOS نوع I آسیب ببینند یا تعدادشان کاهش یابد، ساختار خواب (sleep architecture) و عملکرد شبانهٔ پاکسازی مغز میتواند مختل شود. با گذشت زمان، این اختلالات ترکیبی ممکن است در مسیرهای شناختی اختلال ایجاد کرده و به کاهش توانمندیهای حافظه و دیگر جنبههای شناختی منتهی شوند.
جزئیات آزمایشی و پیامدها
با استفاده از حذف سلول-ویژه در موشها، محققان توانستند نقش نورونهای nNOS نوع I را بدون وارد آوردن آسیب گسترده به بافت اطراف مشخص کنند. این مداخله دامنهٔ نوسانات عروقی خودبهخود را کاهش داد و فعالیت موج-کند مغز را تضعیف کرد. این تغییرات همراه در دینامیک عروقی و عصبی نشان میدهد که این نورونهای هدفگیرنده ممکن است بهعنوان یک هاب مرکزی عمل کنند که جریان خون را با الگوهای شبکهای عصبی هماهنگ میسازد؛ یعنی آنها نه تنها تنظیم محلی عروقی را انجام میدهند، بلکه در سطح شبکهای نیز زمانبندی و همگامسازی را تنظیم میکنند.
مهندس زیستپزشکی پاتریک درو، که آزمایشگاه او پیشتر نقشهٔ تنظیم جریان خون مرتبط با nNOS را ترسیم کرده است، نوسان خودبهخود را بهعنوان مکانیسمی توصیف میکند که مغز از طریق انبساط و انقباض دورهایِ رگها هر چند ثانیه یکبار برای جابجایی مایعات بهره میبرد. او و همکارانش معتقدند که از دست رفتن نورونهایی که به زمانبندی و تنظیم این نوسانات کمک میکنند میتواند باعث یک آبشارهٔ معیوب شود که خواب، پاکسازی ضایعات و سلامت مغزی در بلندمدت را تضعیف میکند. به بیان دیگر، اختلال در این جمعیت نادر ممکن است یک نقطهٔ کلیدی در زنجیرهای از رویدادهای پاتوفیزیولوژیک باشد که نهایتاً ریسک بیماریهای نورودژنراتیو را افزایش میدهد.
از موش تا انسان: چه چیزی محتمل است؟
این یافتهها از مدلهای موشی بهدست آمدهاند و ترجمهٔ مستقیم آنها به مغز انسان نیازمند مطالعات بیشتر و تأییدات فراوان است. با این حال، بسیاری از فرایندهای اساسی عروقی و عصبی بین پستانداران محافظتشدهاند، بنابراین این ایده که یک جمعیت نورونی کوچک و حساس به استرس بتواند دینامیک کل مغز را تحتتأثیر قرار دهد، از نظر زیستشناختی معقول بهنظر میرسد. اگر سلولهای مشابهی در انسان وجود داشته و رفتار مشابهی نشان دهند، از دست رفتن آنها در اثر استرس مزمن، پیرشدن یا بیماری میتواند محرکی کمتر بررسیشده برای آغاز یا تشدید فرایندهای نورودژنراتیو باشد.
کاهش جریان خون مغزی قبلاً بهعنوان یکی از عوامل مؤثر در افت شناختی و دمانس شناخته شده است. دادههای جدید با نشان دادن یک نوع سلولی مشخص که لحن عروقی، خواب موج-کند و هماهنگی بیننیمکرهای را به هم پیوند میدهد، ظرافت بیشتری به این تصویر میافزایند. این پیوند میان عروق، امواج کند دلتا و سینکِ همزمانی میتواند توضیح دهد که چرا برخی اختلالات خواب یا مشکلات عروقی زودهنگام با افزایش ریسک افت شناختی همراهاند.
چه چیزهایی را پژوهشگران در آینده بررسی خواهند کرد
آزمایشهای آینده باید تأیید کنند که آیا مغز انسان به یک جمعیت معادل از نورونهای nNOS نوع I وابسته است یا خیر. دانشمندان همچنین خواهند کاوید که چگونه استرس، التهاب یا پیری بهطور انتخابی این سلولها را آسیب میزنند و آیا این آسیبدیدگی پیش از بروز علائم قابلاندازهگیری شناختی بروز میکند یا خیر. مطالعات بیشتر میتواند مکانیزمهای مولکولی و ارتباط نورونی-عروقی درگیر را روشن سازد؛ برای مثال بررسی نقش اکسید نیتریک (NO) تولیدشده توسط nNOS در تنظیم تون عروق و تعامل با سلولهای گلایال و اندوتلیال میتواند بینشهای مهمی فراهم آورد.
اگر این ارتباط تأیید شود، محافظت یا بازسازی این جمعیت نورونی میتواند هدفی برای درمانها شود که با بهبود کیفیت خواب، تقویت واسموشن و حفظ جریان خون مغزی سعی در کند کردن روند نورودژنراسیون دارند. مداخلاتی شامل کاهش استرس مزمن، کنترل التهاب سیستمیک، درمانهای عروقی-محافظتی و رویکردهای نوین نورومدولاسیون (مانند تحریک هدفمند یا درمانهای دارویی سلولمحور) ممکن است در آینده بهعنوان راهکارهایی برای ارتقای سلامت مغز و کاهش ریسک دمانس مطرح شوند.
دیدگاه کارشناسان
دکتر کلر مندوزا، پژوهشگر حوزهٔ نوروواِسکولار که در این مطالعه مشارکت نداشت، میگوید: "ایدهٔ اینکه یک نوع سلولی نادر میتواند ریتمهای عروقی را در سراسر مغز هماهنگ کند، بسیار هیجانانگیز است. این دیدگاه نحوهٔ تفکر ما دربارهٔ تنظیم جریان خون را بازتعریف میکند — نه تنها بهعنوان یک پاسخ محلی به فعالیت، بلکه بهعنوان یک فرایند شبکهای که از خواب و پاکسازی حمایت میکند. بررسی مقاومت و آسیبپذیری این نورونها میتواند راهبردهای پیشگیرانهٔ جدیدی برای دمانس باز کند."
فهمیدن اینکه چگونه استرس این نورونها را تحتتأثیر قرار میدهد نیز پیامدهای سلامت عمومی دارد. استرس مزمن در زندگی مدرن شایع است؛ اگر ثابت شود که استرس بهطور انتخابی سلولهایی را که جریان خون مغزی را تنظیم میکنند تضعیف میکند، آنگاه کاهش استرس و مداخلات محافظتکنندهٔ عروقی ممکن است راهی برای حفظ سلامت مغز در طول پیری فراهم کنند. علاوه بر این، شناسایی نشانگرهای زیستی پیشبالینی مرتبط با آسیب به این نورونها میتواند امکان غربالگری و مداخلهٔ زودهنگام را افزایش دهد، چیزی که در مقابله با بیماریهای نورودژنراتیو حیاتی است.
منبع: sciencealert
نظرات
نو_وا
تو کلینیک دیدم بیماران با استرس مزمن خوابشون خراب شد، اگه این سلولها آسیب ببینن منطقیه که بعدا شناختی پایین بیاد. امیدوارم درمانی پیدا بشه :(
پمپزون
به نظرم ترکیب عروقی-عصبی این مدل میتونه توضیح بدی برا ارتباط خواب و دمانس باشه. ولی باید مطالعات انسانی و نشانگرهای قابلاعتماد بیاد تا مطمئن بشیم.
آرمین
معقول بهنظر میاد، اما یه خورده اغراق نشده؟ واسموشن و خواب، منطقیه tbh
بیونیکس
آیا این توی انسان هم صدق میکنه؟ اطلاعات موش خوبه، ولی ترجمه به انسان همیشه ساده نیست
رودکس
واگیرم گرفت! فکر نمیکردم چند تا سلول اونقد روی خواب و پاکسازی مغز اثر بذارن... واقعاً شگفتانگیزه

ارسال نظر