9 دقیقه
یک ترکیب شیمیایی کوچک و کمهزینه در یک مدل آزمایشی موشی از بیماری آلزایمر اثرات چشمگیری نشان داده است؛ این ترکیب توانسته اختلالات حافظه را معکوس کند و التهاب مغزی را کاهش دهد. کشف تازه به یک مقصر غیرمنتظره اشاره میکند: تجمع بیشازحد مس در پلاکهای بتا-آمیلوئید. محققان این مطالعه میگویند مولکول مورد نظر در آزمایشهای پیشبالینی ایمن بهنظر میرسد و میتواند وارد فاز آزمایشهای انسانی شود — خبری که امید محتاطانهای برای مسیر درمانی جدید ایجاد کرده است.
تصویر هنری از تجمع پلاکهای آمیلوئید (نارنجی) روی نورونها (آبی)
چرا مس در پژوهشهای آلزایمر اهمیت دارد
بیماری آلزایمر معمولاً با تودهها یا پلاکهای پروتئینی بتا-آمیلوئید در مغز همراه است. اینکه آیا این پلاکها علت اصلی کاهش شناختی هستند یا نتیجهای ثانویه، هنوز مورد بحث است؛ با این حال پلاکها هدفی مداوم برای توسعه دارو بهشمار میآیند. در دهههای اخیر یکی از خطوط بیوشیمیایی مورد توجه، نابهسامانی یونهای فلزی در مغز بوده است—بهخصوص مس که نقشی کلیدی در متابولیسم نورونی و عملکرد آنزیمها دارد.
مس یک فلز همچِند لازم در مقادیر جزئی است که برای کارکرد طبیعی مغز ضروری است. اما هنگامی که هموستاز مس مختل شود—بهخاطر تغییرات ژنتیکی، اختلال در مسیرهای انتقال مس یا پیر شدن بافت—این فلز میتواند در اطراف رسوبات بتا-آمیلوئید تجمع یابد. تجمع بیشازحد مس میتواند به تسریع تشکیل پلاکها، کاتالیز واکنشهای اکسیداتیو و افزایش استرس اکسیداتیو منجر شود؛ پدیدهای که با آسیب سلولی، مرگ نورون و کاهش عملکرد شناختی مرتبط است. در نتیجه، هدفگیری تنظیم فلزی (metal homeostasis) و استفاده از کلاتورهای مس (copper chelators) بهعنوان راهبرد درمانی فزاینده مورد بررسی قرار گرفته است.
درک نقش مس در پاتوفیزیولوژی آلزایمر نیاز به ترکیب شواهد مولکولی، سلولی و رفتاری دارد؛ این مطالعه با تمرکز بر مس و پلاکهای آمیلوئید، رابطه علت و معلولی بین اختلالات متالومیک و دژنراسیون عصبی را مورد بررسی دقیقتری قرار میدهد و میتواند نشان دهد کدام زیرگروههای بیمار مبتلا به آلزایمر از درمانهای مبتنی بر تعادل فلزی بهره میبرند.
از شبیهسازی تا هزارتوی موش: چگونه ترکیبات آزمایش شدند
محققان دانشگاه فدرال ABC در برزیل نه نامزد مولکولی را برای حذف یا کلات کردن مس اضافی از بتا-آمیلوئید غربالگری کردند. هشت ترکیب از خانواده ایمینها (مولکولهای آلی با پیوند دوگانه کربن-نیتروژن) بودند و یک ترکیب مبتنی بر کینولین بود. شبیهسازیهای اولیه در فضای محاسباتی (in silico) سه نامزد امیدوارکننده را شناسایی کردند—که با برچسبهای L09، L10 و L11 معرفی شدند—و بهنظر میرسید توانایی عبور از سد خونی-مغزی (blood-brain barrier) را دارند؛ خصوصیتی ضروری برای هر دارویی که قرار است در مغز عمل کند.
پس از مدلسازی محاسباتی، آزمایشهای سمیّت در سطح سلولی انجام شد. نورونهای موشی کشتشده در شرایط آزمایشگاهی به مدت 24 ساعت در معرض سه ترکیب انتخابشده قرار گرفتند. یکی از نامزدها، L11، استرس اکسیداتیو را افزایش داد و به سلولها آسیب زد و عملاً از ادامه فرایند حذف شد. دو ترکیب ایمین، L09 و L10، سمیت پایینی نشان دادند و از لیپیدها و DNA در برابر آسیب اکسیداتیو محافظت کردند که آنها را به گزینههای ایمنتری برای آزمایشهای حیوانی تبدیل کرد.
گام بعدی، آزمون در یک مدل موشی/رتی کلاسیک آلزایمر بود. پژوهشگران پاتولوژی شبیه آلزایمر را با تزریق استرپتوزوتوسین (streptozotocin) ایجاد کردند تا سیگنالدهی انسولینی در مغز را مختل کنند؛ این روش موجب تجمع بتا-آمیلوئید و اختلالات شناختی میشود و بهعنوان مدلی برای مطالعه مکانیسمهای مولکولی و رفتارشناختی مورد استفاده قرار میگیرد. حیوانات تحت درمان برای سطوح مس در بافتهای مغزی، نشانگرهای التهابی، معیارهای استرس اکسیداتیو و عملکرد در آزمونهای حافظه فضایی مانند هزارتوها مورد ارزیابی قرار گرفتند.
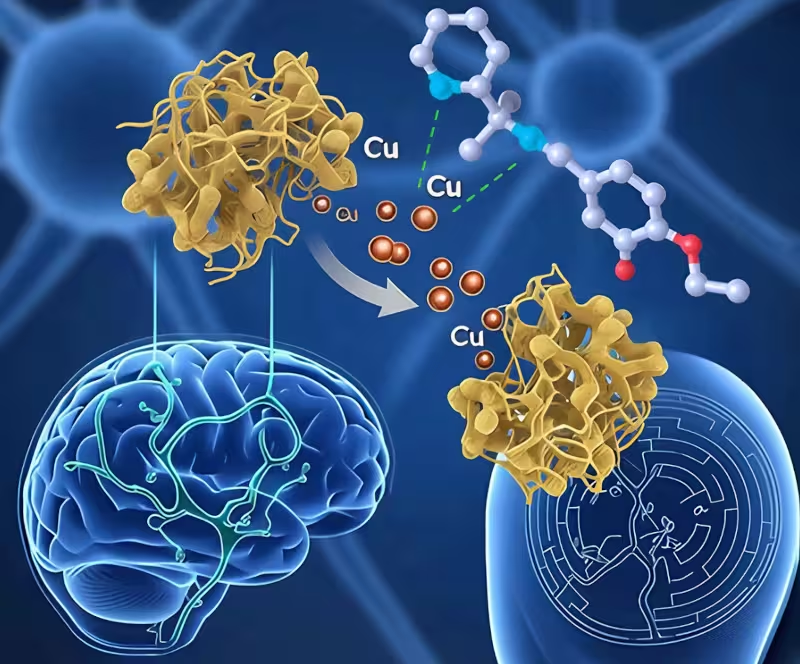
ترکیب جدید میتواند تودههای بتا-آمیلوئید را از مس اضافی پاک کند
کشف کلیدی: L10 تعادل مس و حافظه را بازمیگرداند
از میان سه نامزد، ترکیب L10 بهوضوح برجسته شد. موشهایی که با L10 درمان شدند، غلظت مس در هیپوکامپوس—ناحیهای از مغز که بیشترین ارتباط را با حافظه کوتاهمدت و بلندمدت دارد—را به سطوح نرمال بازگرداندند. این ترکیب همچنین سطح التهاب عصبی و پارامترهای مرتبط با استرس اکسیداتیو را کاهش داد، و حیوانات درمانشده عملکرد بهمراتب بهتری در هزارتوها و آزمونهای حافظه مکانی نسبت به گروههای کنترل نشان دادند.
ترکیب L09 اثرات ضعیفتری در همان اندازهگیریها داشت و L11 در آزمایشهای سلولی همچنان مضر بود. بر اساس این نتایج، نویسندگان L10 را بهعنوان امیدوارترین نامزد برای توسعه بیشتر و احتمالاً ورود به فاز آزمایشهای انسانی معرفی کردند. اهمیت این انتخاب نه تنها در اثربخشی بلکه در ویژگیهای فارماکو-پروتئومیک و ایمنی اولیه دیده میشود؛ یافتههایی که مسیر توسعه دارویی را تسهیل میکنند.
محقق ارشد، جیزل سرچیارو (UFABC)، مزایای عملی این مولکول را برجسته کرد: از لحاظ شیمیایی ساده است و نسبت به بسیاری از داروهای تجربی فعلی ارزانتر تولید میشود. این مقرونبهصرفه بودن میتواند در صورت اثبات اثربخشی در بیماران اهمیت قابلتوجهی داشته باشد، زیرا آلزایمر یک همهگیری جهانی است که تخمین زده میشود حدود 55 میلیون نفر را تحت تأثیر قرار داده است و هزینههای درمانی و مراقبتی سنگینی به جوامع تحمیل میکند.
بهعلاوه، خصوصیات فیزیکوشیمیایی L10—شامل جرم مولکولی مناسب، حلالیت مقبول و پتانسیل عبور از سد خونی-مغزی—نشان میدهد که این ترکیب میتواند فارماکوکینتیک قابلقبولی داشته باشد؛ اما مطالعات داروشناسی دقیقتر (ADME: جذب، توزیع، متابولیسم، دفع) برای تعیین دوز بهینه، زمانبندی درمان و احتمال تداخل با سایر داروها ضروری است.
این یافته چه مفهومی برای استراتژی درمان آلزایمر دارد
بیشتر درمانهای مورد تأیید برای آلزایمر امروز صرفاً علائم را تسکین میدهند و پاتولوژی زیربنایی را بازنمیگردانند. راهبردی که تعادل فلزی در مغز را بازیابی میکند—کاهش تجمع پلاکی تحریکشده توسط مس و آسیب اکسیداتیو—نمایی متفاوت از درمان ارائه میدهد. این مطالعه نشان میدهد که چنین رویکردی ممکن است به زیرگروهی از بیماران که دچار نابهسامانی مس هستند، سود برساند، نه به همه مبتلایان به آلزایمر؛ امری که هتروژنیته بیولوژیک بیماری را برجسته میسازد و ضرورت «پزشکی دقیق» (precision medicine) در نورودژنراسیون را نمایان میکند.
چند نکته فنی و بالینی از این رویکرد قابل ذکر است: اول، نیاز به شناسایی بیومارکرهای قابل اتکا برای تشخیص نابهسامانی مس در بیماران (مثلاً اندازهگیری فلزات در مایع مغزی-نخاعی یا تصویربرداری اختصاصی)؛ دوم، سنجش ترکیب درمانی با سایر داروها از جمله آنتیآمیلوئیدها یا داروهای ضدالتهابی؛ و سوم، توجه به مخاطرات احتمالی ناشی از اختلال بیش از حد در تعادل مس، زیرا مس نیز نقشهای فیزیولوژیک مهمی در مغز و سایر بافتها دارد.
دیدگاه کارشناسان
«هدفگیری هموستاز فلزی یک راهبرد واقعگرایانه و مکانیکی است،» میگوید دکتر آنا مورالس، متخصص نورولوژی و پژوهشگر ترجمهای که در این مطالعه مشارکت نداشت. «این کار امیدوارکننده است زیرا یک فرضیه بیوشیمیایی روشن را با آزمونهای پیشبالینی مرحلهبهمرحله ترکیب میکند—شبیهسازی مولکولی، آزمایشهای سلولی و سنجش رفتار حیوانی. موانع بزرگ بعدی ایمنی و اثربخشی در انسان خواهند بود و اینکه آیا این ترکیب به زیرگروه مناسب بیماران کمک میکند یا خیر.»
نظرات کارشناسان نشان میدهد که برای تقویت اقتدار علمی این مسیر درمانی باید دادههای بیشتری درباره سازوکار مولکولی کلات شدن مس توسط L10، ارتباط مستقیم بین کاهش مس پلاکی و بازیابی عملکرد سیناپسی، و همچنین شواهد سمشناسی سیستمیک در مدلهای بزرگتر فراهم شود. همچنین ارزیابی اثرات در سنین و مدلهای مختلف، از جمله مدلهای ژنتیکی آلزایمر، میتواند دامنه اثربخشی را روشنتر کند.
گامهای بعدی و چشمانداز بالینی
محققان قصد دارند L10 را به فازهای انسانی هدایت کنند تا ایمنی، تحملپذیری و مزایای شناختی بالقوه در انسانها را تعیین کنند. پرسشهای مهم باقیمانده عبارتند از: این ترکیب در جمعیتهای متنوع بیماران چگونه عمل خواهد کرد؟ آیا میتوان آن را با درمانهای دیگر ترکیب کرد؟ و طول مدت بهبودهای شناختی چقدر خواهد بود؟ پاسخ به این سؤالات نیازمند طراحی مطالعههای بالینی دقیق است که با بیومارکرهای تعادل مس و پاتولوژی آمیلوئید هدایت شوند.
برای اکنون، L10 یک نامزد جذاب و کمهزینه است که توجه را به شیمی فلزی در مغز معطوف میکند—حوزهای که میتواند درمانهای هدفمند برای زیرمجموعهای از بیماران آلزایمر تولید کند. همانطور که همواره تاکید میشود، نتایج امیدوارکننده در حیوانات باید در آزمایشهای انسانی مورد تأیید قرار گیرند تا کاربرد بالینی پیدا کنند، اما این مطالعه الگوی روشنی برای حرکت از بینش مولکولی به پتانسیل درمانی ارائه میدهد. از منظر بهداشت جهانی و اقتصاد سلامت، توسعه یک کلاتور مس ارزان و مؤثر میتواند تغییری عمیق در مدیریت بیماری آلزایمر ایجاد کند، بهویژه در کشورهایی با منابع محدود.
منبع: sciencealert
نظرات
چرخداده
احساس میکنم کمی اغراقه، موش خوبه ولی انسان داستانش فرق داره، کلی سوال باقیه، مخصوصا تداخل با داروهای دیگه...
پارسا
یک رویکرد منطقی و هدفمند، اما نیاز به شواهد بیشتر، ADME و مطالعات ایمنی در مدلهای بزرگتر تا واقعاً قابل اعتماد باشه
لابکور
تو آزمایشهای من دیدم فلزات گاهی نقش بزرگی دارن، اما ترکیبهای جدید همیشه تو انتقال به انسان گیر میکنن... امیدوارم L10 فرق کنه
توربو
واقعا پاکسازی مس از پلاک حافظه رو برمیگردونه؟ دادهها اوکیه یا فقط تو مدل خاصی جواب داده؟
کوینپایل
مفهومه، هدفگیری مس میتونه منطقی باشه، فقط بیومارکرها باید قابل اعتماد باشن
دیتاپالس
وای، انتظار نداشتم یک مولکول ارزان چنین اثری داشته باشه... امیدوارم انسانی هم جواب بده، ولی آدم نگران هم میشه

ارسال نظر