9 دقیقه
پژوهشگران در ژاپن گزارش دادهاند که آرژنین خوراکی — یک اسید آمینه که پیشتر در درمان درد سینه و فشار خون استفاده میشود — تجمعهای پروتئینی آمیلوئید-بتا را در موشها و مگسهای میوه پاک کرده است. این یافته که در نشریه Neurochemistry International منتشر شده، نشاندهنده یک نامزد کمهزینه و از نظر بالینی امن برای آزمایشهای بیشتر بر ضد یکی از ویژگیهای مولکولی اصلی بیماری آلزایمر است.
چرا آرژنین میتواند بر تجمعهای پروتئینی هدف بگیرد
پلاکهای آمیلوئید-بتا تجمعهای چسبندهای از پروتئینها هستند که سالها با پاتوژنز آلزایمر مرتبط دانسته شدهاند. این پلاکها بین نورونها تجمع مییابند و با اختلال در سیناپسها و مرگ سلولی در ارتباط هستند. آرژنین بهعنوان یک «چپرون شیمیایی» شناخته میشود — مولکولی کوچک که به تا شدن صحیح پروتئینها کمک کرده یا از تاخوردگی نادرست و بههمچسبیدن آنها جلوگیری میکند.
ویژگی مذکور هسته فرضیه مطالعه جدید است: اگر آرژنین بتواند هم تجمعهای موجود را حل کند و هم از شکلگیری خوشههای جدید جلوگیری نماید، ممکن است یکی از بارزترین نشانگرهای مولکولی آلزایمر را کاهش دهد. نکته حیاتی برای درمانهای مغزی آن است که پژوهشهای قبلی نشان دادهاند آرژنین میتواند از سد خونی-مغزی عبور کند، که یکی از موانع اصلی برای داروهای نورواکتیو به شمار میآید.
علاوه بر نقش چپرونی، آرژنین در مسیرهای متابولیکی دیگری نیز مشارکت دارد؛ از جمله پذیرفتهشدن به مسیر تولید نیتریکاکسید که میتواند بر عروق مغزی و پاسخهای التهابی اثر بگذارد. این همپوشانی عملکردی ممکن است باعث شود آرژنین چندوجهی، هم بر تجمع پروتئینی و هم بر فرایندهای التهابی نورونی تأثیر بگذارد.
در سطح مولکولی، تعامل مستقیم آرژنین با دانههای آمیلوئید گاهی از طریق برهمکنشهای یونی و هیدروفیلیک توضیح داده میشود؛ این برهمکنشها میتوانند پیوندهای میان مولکولی را شکسته یا از پیشسازهای فیبری جلوگیری کنند. این مکانیسمها در مطالعات in vitro و در مدلهای سادهتر زیستی که در ادامه بحث شدهاند مورد بررسی قرار گرفتهاند.
چگونگی طراحی مطالعه: حیوانات، دوزها و نتایج
تیمی از دانشگاه Kindai و مؤسسه ملی علوم عصبی ژاپن موشهای نر مهندسیشدهای را پرورش دادند که بهطور ژنتیکی مستعد تجمع آمیلوئید-بتا شبیه به آلزایمر هستند. بهجای تزریق یا روشهای تهاجمی، پژوهشگران آرژنین را به آب آشامیدنی حیوانات افزودند — مسیری خوراکی که مشابه راهی است که بیماران در آینده ممکن است دارو را دریافت کنند.
در کنار آزمایشهای موشی، محققان تستهای مکملی را در مگسهای میوه و آزمایشات in vitro انجام دادند تا تأثیرات آرژنین بر تجمع آمیلوئید-بتا را بهصورت مستقیمتر نقشهبرداری کنند. این رویکردهای موازی کمک کرد تا اثرات سیستمیک (مانند تغییرات در التهاب) از عملکردهای مستقیم روی خوشههای پروتئینی تفکیک شود.
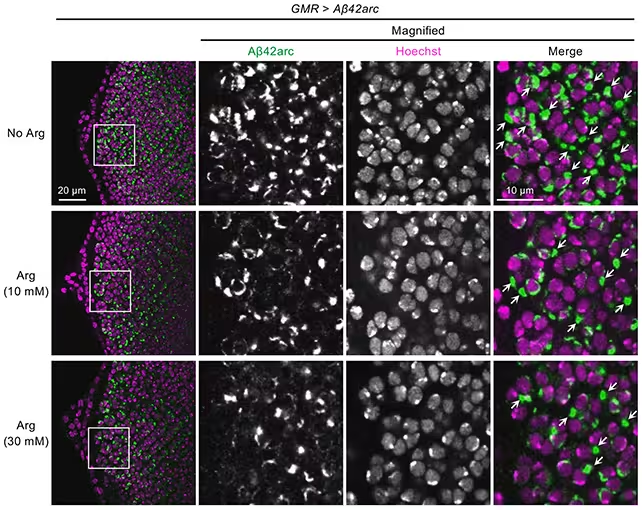
آرژنین تجمعهای آمیلوئید-بتا را (به رنگ سبز) در مدلهای مگس میوه کاهش داد.
انتخاب مسیر خوراکی در طراحی مطالعه از چند منظر منطقی است: اول اینکه دوزدهی و تطبیق رژیم در انسان آسانتر است؛ دوم اینکه اثرات متابولیکی و فارماکوکینتیک خوراکی میتواند نشاندهنده نحوه پخش دارو در بافتهای مختلف از جمله مغز باشد. با این حال، تعیین دوز ترجمهپذیر از حیوان به انسان همیشه چالشبرانگیز است و نیازمند مطالعات فاز یک بالینی برای تعیین محدودههای ایمنی و اثربخشی است.
در مدلهای مگس میوه، مزیت استفاده از این ارگانیسم ساده سرعت در اندازهگیری تغییرات تجمع پروتئینی و تنظیم ژنتیکی هدفها بود. در عین حال، آزمایشهای in vitro به محققان اجازه داد مولکولیترین جلوههای ضدتجمع آرژنین را جداگانه بررسی کنند — برای مثال با اندازهگیری نرخ تشکیل فیبریلها و پایداری ساختارهای آمیلوئیدی در حضور آرژنین.
یافتههای کلیدی و نشانههای زیستی
موشهایی که آرژنین دریافت کردند، رسوب آمیلوئید کمتری در مغز نشان دادند و در آزمونهای رفتاری استاندارد درجات کمتری از ناهنجاریهای رفتاری را بروز دادند. آنالیز مولکولی همچنین کاهش فعالیت ژنهای مرتبط با التهاب عصبی را نشان داد — که این امر نشان میدهد درمان ممکن است بیش از حل پلاکها عمل کند و التهاب ثانویهای را که به آسیب نورونی دامن میزند کاهش دهد.
آزمایشهای in vitro و مطالعات روی مگسهای میوه از اثر ضدتجمع مستقیم حمایت کردند: به نظر میرسد آرژنین هم فیبریلهای موجود را پاک میکند و هم تشکیل آمیلویید-بتای جدید را محدود میسازد. ترکیب این نتایج، دالی برای مکانیسم دوگانه ارائه میدهد: آرژنین بهعنوان یک چپرون شیمیایی و نیز تعدیلکننده پاسخهای التهابی.
علاوه بر این، تجزیه و تحلیل مسیرهای سیگنالدهی نشان داد که سطوح نشانگرهای اکسیداتیو و برخی سیتوکینهای التهابی با درمان کاهش یافتهاند. این الگو از همافزایی میان اثربخشی ضد تجمع و خواص ضدالتهابی حکایت دارد که میتواند در محافظت از نورونها نقش داشته باشد. بررسیهای نوروپاتولوژیک با رنگآمیزیهای اختصاصی نشان داد که مناطق مرتبط با حافظه و کارکرد شناختی—از جمله هیپوکامپ—کمتر دستخوش رسوب آمیلوئید شدهاند.
در سطوح بیوشیمیایی، تغییرات در پروتئینهای دخیل در پروتئواستاز (تعادل پروتئینی) مشاهده شد؛ برای مثال، افزایش نسبی در پروتئازومها و مولکولهای وابسته به بازیافت پروتئین که ممکن است سهمی در حذف پروتئینهای ناقص یا تجمعیافته داشته باشند. این یافتهها نشان میدهد که آرژنین ممکن است مسیرهای حفظ عدم تجمع پروتئینی را نیز تقویت کند.
این نتایج چه معنایی دارند — و چه معنایی ندارند
محقق ارشد، یوشیتاکا ناگای، خلاصهای از امیدبخشی یافته را اینگونه بیان کرد: «مطالعه ما نشان میدهد که آرژنین میتواند تجمع آمیلوئید-بتا را هم در شرایط in vitro و هم in vivo سرکوب کند. آنچه این یافته را هیجانانگیز میکند این است که آرژنین از پیش ایمن و کمهزینه شناخته شده است و بنابراین نامزد مناسبی برای تغییر کاربرد بهعنوان یک گزینه درمانی بالقوه برای بیماری آلزایمر بهشمار میآید.»
با این حال، نویسندگان و مفسران ضمن استقبال تأکید میکنند که باید محتاط بود. مطالعات حیوانی از دوزهای نسبتاً بالا استفاده کردند؛ دوز ایمن و مؤثر در انسان هنوز مشخص نیست. همچنین هرچند مدلهای حیوانی و مگسها ابزارهای ارزشمندی هستند، اما نماینده کامل بیماری پیچیده انسانی آلزایمر نیستند. بسیاری از مداخلاتی که در موشها موفق بودند، در کارآزماییهای بالینی شکست خوردهاند.
بحث علمی گستردهتری نیز وجود دارد: حذف پلاکهای آمیلوئید بهطور مداوم به منفعت شناختی در بیماران ترجمه نشده است، و این سؤال را مطرح میکند که آیا پلاکها محرک اصلی بیماری هستند یا نشانهای ثانویه از فرآیندهای سمی دیگری. بنابراین خواص ضدالتهابی و تقویتکننده پروتئواستاز آرژنین ممکن است بهاندازه پاکسازی پلاکها مهم باشند.
از منظر بالینی، حتی اگر آرژنین رسوب آمیلوئید را کاهش دهد، اثبات فواید قابلتوجه بر حافظه، توجه و عملکرد روزمره بیماران ضروری است. این نکته اهمیت تعیین نقاط پایانی مطالعه (endpoints) مناسب در آزمایشهای بالینی را برجسته میکند: ارزیابیهای شناختی، تصویرسازی مغزی برای نشانگرهای آمیلوئید و نشانگرهای التهاب عصبی باید ترکیبی از شاخصهای زیستی و عملکردی باشند.
دیدگاه کارشناسی
دکتر ماریا چن، نورو فارماکولوژیست که در این مطالعه دخیل نبوده است، اظهار داشت: «این یک مطالعه زیبا و عملگرایانه است. مسیر خوراکی و سابقه ایمنی شناختهشده، آرژنین را به نامزدی منطقی برای ترجمه سریع به کارآزماییهای فاز اولیه تبدیل میکند. با این حال، نقاط پایانی بالینی باید شامل سنجههای شناختی و نشانگرهای زیستی فراتر از بار پلاکی باشند تا منفعت واقعی برای بیمار نشان داده شود.»
گامهای بعدی شامل تعیین دوزهای مناسب و ارزیابیهای ایمنی در انسان است که باید با دقت طراحی شوند؛ از جمله مطالعات فارماکوکینتیک و فارماکودینامیک برای تعیین میزان عبور از سد خونی-مغزی، نیمهعمر پلاسمایی و تعاملات احتمالی با داروهای دیگر. پس از آن باید کارآزماییهای کنترلشده تصادفی اجرا شوند که نتایج شناختی، نشانگرهای آمیلوئید و شاخصهای التهاب عصبی را اندازهگیری کنند.
در صورت اثبات این که آرژنین میتواند چندین فرایند پاتولوژیک را با ایمنی قابل قبول تغییر دهد، ممکن است به فهرست رو به رشدی از استراتژیها علیه اختلالات ناشی از نادرستتاخوردگی پروتئینها بپیوندد. بازآرایی داروهای ارزان و شناختهشده (drug repurposing) مزیت سرعت و هزینه را دارد، اما هرگونه حرکت به سمت درمان انسانی باید بر مبنای شواهد ایمنی و سودمندی باشد.
در جمعبندی، هرچند آرژنین هنوز درمان اثباتشدهای برای آلزایمر نیست، نتایج حیوانی ارائهشده منطق روشنی برای فاز بعدی تحقیقات بالینی فراهم میکنند — و یادآوری میکنند که بازآرایی مولکولهای ارزان و شناختهشده گاهی میتواند مسیرهای سریعی به سوی درمانهای جدید باز کند. برای روشن شدن نقش بالینی آرژنین، مطالعات انسانی با طراحی دقیق که بهطور مستقیم پیامدهای شناختی و بیومارکرها را اندازهگیری کنند، ضروری خواهد بود.
در نهایت، ترکیب دادههای مولکولی، نورپاتولوژیک و رفتاری از این مطالعه نشان میدهد که رویکردهای چندوجهی که هم تجمع پروتئین و هم التهاب عصبی را هدف میگیرند احتمالاً بیشترین شانس موفقیت را در مواجهه با بیماریهای پیچیدهای مانند آلزایمر دارند. آرژنین، بهعنوان یک عامل با پتانسیل چندگانه، مثال خوبی از چنین رویکردی است.
منبع: sciencealert
نظرات
چیپ_
معقول به نظر میاد، ولی باید دوز و تداخل دارویی رو ببینیم
نیک_
من تو خانوادهمون آلزایمر دیدم، اگر واقعاً التهاب رو کم کنه امیدوارم کیفیت زندگی بهتر بشه، اما هنوز شک دارم
پمپزون
به نظرم بیش از حد هیجان زدهس، کلی مرحله مونده؛ با این حال شانسش بهتر از هیچیه
اتمویو
بررسی کامل، منطقیه؛ مسیر خوراکی و سابقه ایمنی جذابه، ولی ترجمه به انسان همیشه پرپیچ و خم بوده 😊
رضا
واقعاً؟ تو موش و مگس جواب داده، اما این که تو انسان هم موثر باشه چقدر واقعیه؟
لابکور
وااای، انتظار نداشتم آرژنین بتونه پلاکها رو اینقد کم کنه... امیدوارم مطالعات انسانی هم جواب بده!

ارسال نظر