8 دقیقه
پژوهشگران روشی برای فریز کردن با دقت زمانی بسیار بالا توسعه دادهاند که سلولهای مغزی را در حین ارسال سیگنالها ثبت میکند و پنجرهای نو بر فرایندهای سیناپسی که در کسری از ثانیه رخ میدهند گشوده است. این تکنیک که به اختصار «زاپاندفریز» (zap-and-freeze) نامیده میشود، به دانشمندان امکان میدهد تا نحوه بستهبندی، رهاسازی و بازیافت وزیکولهای کوچک حامل پیامهای شیمیایی توسط نورونها را مطالعه کنند؛ موضوعی که میتواند در درک و پژوهش بیماریهای عصبی مانند بیماری پارکینسون اهمیت داشته باشد.
فریز کردن سیگنالها در سرعت میلیثانیه
ایده اصلی ساده است اما اجرای فنی آن نیازمند دقت و تجهیزات ویژه است: ابتدا نورونها با تحریک الکتریکی فعال میشوند و سپس با منجمدسازی تحت فشار بالا در بازههای زمانی میلیثانیهای بافت ثابت میگردد؛ با این کار حوادث پویا متوقف و برای بررسی با میکروسکوپ الکترونی آماده میشوند. هنگامی که این روش روی نمونههای بریده مغز انسان که در جراحیهای نوروسرجری برداشته شدهاند و همچنین بافت موش به کار میرود، ساختار سلولی حفظ شده و مراحل زودگذر در انتقال سیناپسی ثبت میشود.
منجمدسازی سریع و تحت فشار بالا امکان حفظ مورفولوژی غشاهای سلولی در زمانی که تغییرات دینامیک بسیار سریع اتفاق میافتند فراهم میکند. در مقایسه با تصویر برداری نوری سنتی یا بافتهای ثابت، این تکنیک میتواند تصویربرداری از فرآیندهای درون سیناپسی مثل ادغام وزیکولها با غشای پیشسیناپسی و مراحل اولیه بازیافت وزیکولی را در مقیاس میلیثانیه نشان دهد. این توانمندی برای مطالعه فرایندهای سیناپسی با سرعت بالا و نیز شناسایی اجزای مولکولی مرتبط با بازیافت وزیکول بسیار ارزشمند است.
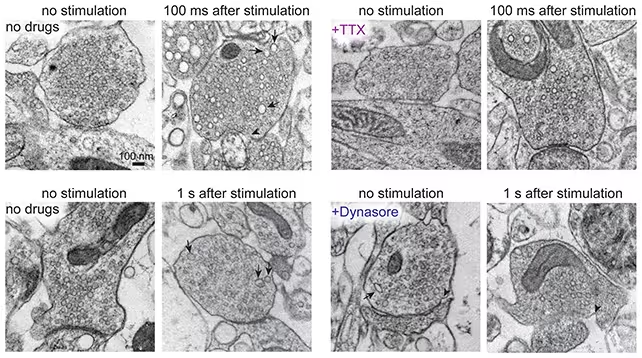
پژوهشگران فعالیت سلولی را میلیثانیهها پس از تحریک تصویربرداری کردند
سیناپسها با وزیکولهایی پر از ناقلهای عصبی ارتباط برقرار میکنند؛ این وزیکولها با غشای پیشسیناپسی ادغام شده و محتوای شیمیایی خود را آزاد میکنند و سپس باید بازیافت شوند تا نورون بتواند به شلیک مکرر ادامه دهد. بسیاری از جنبههای این چرخه بسیار سریع رخ میدهد و با روشهای معمولی تصویر برداری نوری یا نمونههای ثابت قابل تفکیک نیستند. روش زاپاندفریز این شکاف را میبندد و تصویرهای لحظهای از تراکنش غشایی و دینامیک وزیکولی را در زمانهای زیر یک ثانیه ارائه میدهد؛ چیزی که برای فهم مکانیزمهای انتقال سیناپسی و بازیافت وزیکول ضروری است.
یافتههای تیم پژوهشی
با استفاده از زاپاندفریز روی برشهایی از مغز موش و همچنین نمونههایی از بیماران انسانی، گروه پژوهشی شواهدی از وجود اندوسیتوز فوقالعاده سریع (ultrafast endocytosis) یافتند — فرایند بازیافت وزیکولی که ظرف کمتر از ۱۰۰ میلیثانیه پس از تحریک کامل میشود. این مسیر بازیافت بسیار سریع به نظر میرسد در گونههای مختلف حفظ شده باشد، که این امر اعتبار استفاده از مدلهای موشی را برای مطالعه زیستشناسی سیناپسی انسان تقویت میکند و اهمیت مدلهای جانوری در پژوهش ترجمهای را نشان میدهد.
در سطح مولکولی، محققان نقش یک واریانت اسپلایسشده از یک GTPase کلیدی را برجسته کردند: isoform ای از دینامین تحت عنوان dynamin1xA که به نظر میرسد برای این مسیر اندوسیتوز فوقالعاده سریع ضروری است. پروتئینهای دینامین در فرآیند کندن غشا و بازسازی وزیکول نقش دارند؛ دادههای جدید نشان میدهد که ایزوفرمهای خاصی برای بازیافت بسیار سریع در سیناپسهای فعال مورد نیازند و تفاوتهای ایزوفورمی میتواند مکانیزم عملکرد سیناپسی را تحت تأثیر قرار دهد.
این نتایج نشان میدهد که ترکیب فنون ساختاری مانند میکروسکوپ الکترونی با تکنیکهای زمانی-حساس میتواند مشخص کند کدام پروتئینها و کدام مراحل مولکولی دقیقاً مسئول بازیافت سریع وزیکولی و پایداری انتقال سیناپسی هستند. شناخت این مولکولها میتواند در نهایت به هدفگذاری درمانی برای اصلاح نارساییهای سیناپسی منجر شود.
چرا این یافتهها برای پژوهش بیماریها مهم است
اختلال در انتقال سیناپسی و نقص در بازیافت وزیکولی در بیماریهای تخریبکننده عصبی مانند پارکینسون نقش دارد؛ در این بیماری کاهش پیشرونده نورونها و اختلالات سیگنالدهی، از ویژگیهای اصلی است. با تصویربرداری مستقیم دینامیک غشای سیناپسی در بافت انسانی، پژوهشگران میتوانند فعالیت سالم را با الگوهای موجود در مغزهای ناسالم مقایسه کنند و نقاط اختلال زودهنگام در تراکنش وزیکولی را شناسایی کنند؛ این امر میتواند به درک مراحل اولیه بیماری و یافتن بیومارکرهای هشداردهنده کمک کند.
شیگِکی واتانابه، زیستشناس سلولی از دانشگاه جانز هاپکینز و رهبر این مطالعه، اشاره میکند که حفاظت این مکانیسم بین بافت موش و انسان از تحقیقات ترجمهای پشتیبانی میکند: درک شکستهای سیناپسی در سامانههای مدل میتواند به هدفگذاری درمانی مرتبط با انسان بینجامد. این همبستگی بین گونهها فرصتهایی برای آزمایش مداخلات مولکولی و ژنتیکی در مدلهای حیوانی فراهم میآورد که ممکن است بعدها در نمونههای بالینی انسان اعتبارسنجی شوند.
علاوه بر این، شناخت تغییرات مرتبط با ایزوفرمهایی مثل dynamin1xA میتواند مسیرهایی را برای توسعه داروهای کوچک یا مولکولهای بیولوژیک فراهم کند که به بازیافت وزیکولی کمک کرده یا عملکرد سیناپسی را بهبود میبخشند؛ موضوعی که در تحقیقات درمانی بیماریهایی با پایه سیناپسی نظیر پارکینسون بسیار پر اهمیت است.
روشها، نمونهها و ملاحظات اخلاقی
اجرای این تکنیک نیازمند دسترسی سریع به بافت تازه و هماهنگی نزدیک با تیمهای جراحی است. در کار گزارششده، نمونهها از بیمارانی که تحت جراحی مغز برای برداشتن ضایعات قرار داشتند گرفته شدند؛ برای استفاده پژوهشی از این بافتها رضایت آگاهانه بیماران و تأییدیههای اخلاقی مربوطه اخذ گردید. در مطالعات آتی هدف این است که با مجوزهای مناسب، بافتهای اهدایی از بیمارانی که دچار پارکینسون یا دیگر اختلالات عصبی هستند و تحت مداخلات تهاجمی قرار میگیرند وارد مطالعه شوند تا تغییرات سیناپسی مرتبط با بیماریها بهطور مستقیم ارزیابی گردد.
علاوه بر چالش عملی تأمین بافت انسانی، روش زاپاندفریز وابسته به زمانبندی دقیق میان تحریک و کرایوفیکساسیون، تجهیزات تخصصی منجمدسازی تحت فشار بالا و همچنین میکروسکوپ الکترونی برای حل و فصل مورفولوژی غشا در مقیاس نانومتری است. هر مرحله از فرآیند نیازمند تمرین و استانداردسازی است تا نتایج تکرارپذیر و قابل اعتماد حاصل شود.
از منظر اخلاقی، استفاده از بافت انسانی برای پژوهشهای بنیادی ایجاب میکند که پروتکلهای حفاظت از حریم خصوصی، ذخیره و انتقال نمونه، و توافقنامههای اهدایی بهدقت طراحی و اجرا شوند. علاوه بر این، ارتباط با بیماران و خانوادهها در مورد اهداف تحقیق، ریسکها و منافع بالقوه آن باید شفاف و قابل فهم باشد تا اهدای بافت پاسخگو و اخلاقی باشد.
پیامدها و گامهای بعدی
در کوتاهمدت، زاپاندفریز یک آزمون جدید برای فیزیولوژی پایه سیناپسی فراهم میکند که میتواند پروتئینها و مراحل بازیافت وزیکولی را که در بازههای زمانی بسیار سریع عمل میکنند شناسایی کند. این ابزار میتواند به کشف مولکولهایی کمک کند که برای پایداری عملکرد سیناپس حیاتیاند و در نتیجه بعنوان معیارهایی برای تحقیقات مولکولی و ژنتیکی به کار روند.
در بلندمدت، نگاشت اینکه چگونه اندوسیتوز فوقالعاده سریع در پارکینسون و دیگر بیماریهای مغزی تغییر میکند میتواند نقاط مداخلهای را نشان دهد تا از شکست سیناپسی جلوگیری یا آن را کند کرد. برای مثال، اگر کاهش عملکرد dynamin1xA به افت بازیافت وزیکولی و در نتیجه تحلیل سیناپس منجر شود، اصلاح یا تقویت فعالیت این مسیر میتواند هدف درمانی مناسبی باشد.
رویکردهای مکمل—نظیر تصویر برداری فوقرزولوشن زنده-سلولی، تحریک اپتوژنتیک و دستکاریهای مولکولی—میتوانند با زاپاندفریز ترکیب شوند تا خروجیهای کارکردی با نماهای ساختاری با وضوح بالا همبسته شوند. این استراتژی چندوجهی (multimodal) فهم مکانیکی را بهبود میبخشد و کمک میکند تا اهداف دارویی بالقوه معتبرسازی شوند. در نتیجه، ترکیب دادههای ساختاری-زمانی از بافت انسانی با آزمونهای عملکردی در مدلهای حیوانی و با استفاده از مداخلات مولکولی، یک مسیر پژوهشی قوی برای توسعه درمانهای هدفمند فراهم میآورد.
بینش کارشناسان
«ثبت سیناپسها در حرکت، یک پیشرفت عمده است،» دکتر لارا چن، یک نوروفیزیولوژیست که در این مطالعه شرکت نداشت، میگوید. «روشهایی مانند زاپاندفریز به ما تصویر کاملتری از نحوه حفظ سیگنالدهی سریع توسط نورونها میدهند. برای بیماریهایی مثل پارکینسون، دیدن دقیقاً کدام مراحل دچار اختلال میشوند ممکن است کلید توسعه درمانهای مبتنی بر شواهد بهجای رویکردهای آزمایشی و خطا باشد.»
در حالی که تبدیل این یافتهها به درمان زمانبر خواهد بود، ترکیب دادههای بافت انسانی، مکانیسمهای محافظتشده بین گونهها و رهیافتهای مولکولی جدید مانند دینامین1xA یک نقشه راه امیدوارکننده برای پژوهشهای متمرکز بر سیناپس در زمینه نورودژنراسیون فراهم میآورد. با ادامه مطالعات، اعتبارسنجی هدفها و پیادهسازی مداخلات در مدلهای پیشبالینی، میتوانیم شاهد پیشرفت در شناسایی راهکارهای نوین برای حفظ کارکرد سیناپسی و کاهش سرعت تحلیل عصبی در بیماریهای مزمن باشیم.
منبع: sciencealert
نظرات
رضا
خیلی امیدوارکننده ولی فکر میکنم کمی اغراق دارن؛ فاصله تا درمان بالاست، باید صبر و اعتبارسنجی بیشتر باشه
تریپمایند
خلاصه: پنجره جدیدی به سیناپس باز شده. نه دراماتیک، اما مهم. حالا باید بفهمیم این نتایج چطور به درمان تبدیل میشه
بایونیکس
تو آزمایشگاه ما هم مشکل تأمین بافت تازه و هماهنگی با تیم جراحی بود؛ انجامش کار بزرگیه، دست مریزاد به تیم
توربوایر
این واقعاً قابل تکراره؟ زمانبندی میلیثانیهای، خطاها رو چطور کنترل میکنن... یه کم شک دارم ولی جالبه
کوینپایل
معقول به نظر میاد؛ مدل موش قابل اتکاست اما باید بافت انسانی بیشتری بررسی بشه. امیدوارم نمونه بالینی هم بیارن
رودایکس
وااای، ثبت سیناپسها تو حرکت؟! تصورش هم هیجانانگیزه. اگه بتونن تغییرات تو مغز بیماران رو هم ببینن، تحولیست. اما تجهیزاتش وحشتناک گرونه، نه؟

ارسال نظر