9 دقیقه
پژوهشگران MIT و استنفورد یک رویکرد نوین در ایمنیدرمانی سرطان توسعه دادهاند که عملاً یک «ترمز» مولکولی مبتنی بر قند را روی سلولهای سرطانی غیرفعال میکند و به دستگاه ایمنی اجازه میدهد تومورهایی را شناسایی و نابود کند که پیشتر از پشت سرِ بررسی ایمنی فرار میکردند. این استراتژی از پروتئینهای هیبرید مهندسیشدهای به نام AbLec — آنتیبادیهای متصل به لکتین — استفاده میکند تا سیگنالهای سرکوبکنندهی فعالیت ایمنی که توسط گلیکانها منتقل میشوند را بلوکه کند.
چرا گلیکانها اهمیت دارند: سیگنالهای پنهان قندی روی سلولهای سرطانی
گلیکانها ساختارهای پیچیدهای از قند هستند که تقریباً سطح تمام سلولهای بدن را میپوشانند. در سرطان این پوشش قندی تغییر میکند: سلولهای توموری اغلب گلیکانهای غیرطبیعیای را نشان میدهند که غنی از اسید سیالیک (sialic acid) هستند. این گلیکانهای حامل اسید سیالیک با گیرندههای لکتینی روی سلولهای ایمنی که بهعنوان Siglecها شناخته میشوند تعامل میکنند و یک مسیر ایمنیسرکوبگر را فعال میسازند که مانند یک ترمز عمل کرده و پاسخهای ضدتوموری را تضعیف میکند.
مهارکنندههای نقطهای فعلی — داروهایی که PD-1 یا PD-L1 را بلوکه میکنند — یک کلاس از این ترمزها را آزاد میسازند و در برخی بیماران باعث فروپاشی بلندمدت تومور شدهاند. با این وجود بسیاری از تومورها به این درمانها مقاوم هستند یا پاسخ کافی نشان نمیدهند. محور Siglec–اسید سیالیک یک نقطهٔ بازرسی جایگزین را نشان میدهد: هنگامی که Siglecها به اسید سیالیکهای روی سلولهای سرطانی متصل میشوند، ماکروفاژها، سلولهای کشندهٔ طبیعی (NK) و دیگر افکتورهای ایمنی کمتر احتمال دارد به تهاجم علیه تومور بپردازند. این مکانیسم، بهعنوان یک مکانیسم فرار از ایمنی (immune evasion) شناخته میشود و هدف قرار دادن آن میتواند افقهای جدیدی در ایمنیدرمانی سرطان باز کند.
چگونه AbLecها عمل میکنند: ربودن لکتینها با آنتیبادی
نوآوری مرکزی تیمهای MIT و استنفورد یک پروتئین مدولار است که آن را AbLec مینامند. هر AbLec یک دامنه شبیه لکتین که به گلیکانهای حامل اسید سیالیک متصل میشود را به یک بازوی آنتیبادی پیوند میدهد که یک آنتیژن اختصاصی تومور را تشخیص میدهد. آنتیبادی دامنهٔ لکتین را به سطح سلول توموری میرساند و متمرکز میکند، جایی که این دامنه با Siglecهای سلولهای ایمنی بر سر اتصال به اسید سیالیک رقابت میکند. در نتیجه، سیگنالهای سرکوبگر گلیکان-محور کاهش مییابند و افکتورهای ایمنی میتوانند با کارآیی بیشتری تهاجم کنند.
از اتصال ضعیف تا بلوکهکنندهٔ مؤثر
دامنههای لکتینی به تنهایی معمولاً اتصال ضعیفی دارند و به شکل مؤثری روی تومورها تجمع نمیکنند. در مقابل، آنتیبادیها تمایل به آفینیتی بالایی نسبت به آنتیژنهای توموری دارند و میتوانند در تعداد زیاد به سلولهای سرطانی محلیسازی شوند. اتصال یک لکتین به آنتیبادی، نقاط قوت هر دو را ترکیب میکند: تحویل هدفمند به همراه بلوکه محلی گلیکان. نتیجه یک تلهٔ موضعی متمرکز است که از درگیر شدن Siglecهای سرکوبگر جلوگیری میکند و سلولهای ایمنی را آزاد میسازد تا تهاجم ضدتوموری را انجام دهند. این مکانیزم، از منظر زیستشناسی مولکولی و بیوانفورماتیک، نشاندهندهٔ تبدیل یک لیگاند با آفینیتی کم به یک مهارکنندهٔ موضعی قوی است که میتواند بازآرایی شبکهٔ سیگنالینگ ایمنی در میکرومحیط تومور را به همراه داشته باشد.
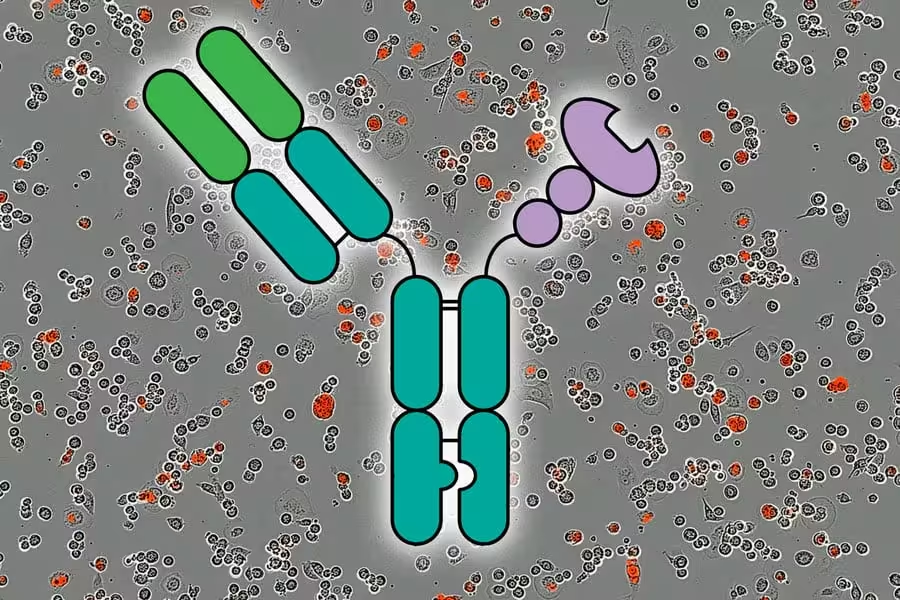
پژوهشگران نشان دادند که میتوان با استفاده از مولکولهایی به نام AbLecها، که در مرکز تصویر نمایش داده شدهاند، یک پاسخ ایمنی ضدتومور قوی را تحریک کرد. پسزمینهٔ تصویر فلورسانسی قرمز نشاندهندهٔ سلولهای سرطانی کشتهشده در طی پنج ساعت است. اعتبار تصویر: با اجازهٔ پژوهشگران؛ MIT News
شواهد پیشبالینی: از کشت سلولی تا موشهای هومانیزه
برای اثبات مفهوم، تیم یک AbLec ساخت که از trastuzumab (آنتیبادی ضد HER2) بههمراه یک دامنهٔ لکتینی مشتق از Siglec-7 یا Siglec-9 تشکیل شده بود. در آزمایشهای مبتنی بر سلول، این AbLecها سلولهای ایمنی را بازبرنامهریز کرده و آنها را واداشتند به سلولهای توموری مثبت برای HER2 حمله کنند. در یک مدل موشی مهندسیشده که Siglecهای انسانی و گیرندههای آنتیبادی انسانی را بیان میکرد، درمان با AbLec بهطور معنیدار متاستازهای ریوی را نسبت به استفادهٔ صرف از trastuzumab کاهش داد.
این نتایج اهمیت زیادی دارند زیرا نشان میدهند که هم افکتورهای ایمنی ذاتی (مانند ماکروفاژها و سلولهای NK) و هم پاسخهای اکتسابی میتوانند با بلوکه کردن نقطههای بازرسی مبتنی بر گلیکان آزاد شوند. در موقعیتهایی که درمان استاندارد آنتیبادی اثر محدودی داشت، رویکرد AbLec توانست بار توموری را کاهش دهد. نتایج پیشبالینی همچنین شواهدی از تعدیل تعاملات سلول-سلول و تغییرات در پروفایل سایتوکاینها و فاگوسیتوز ارائه دادند که نشاندهندهٔ پتانسیل تقویت ایمنی تومور است.
طراحی مدولار: سکویی قابل تغییر و گسترده
یکی از جنبههای امیدوارکنندهٔ AbLecها، مدولار بودن آنها است. بازوی آنتیبادی را میتوان بهسادگی تعویض کرد تا آنتیژنهای مختلف تومور را هدف قرار دهد — برای مثال، rituximab (مخاطب CD20) برای سرطانهای سلول B یا cetuximab (مخاطب EGFR) برای برخی تومورهای جامد دیگر. به همین ترتیب، دامنهٔ لکتین را میتوان عوض کرد تا گلیکانهای متمایز یا اعضای مختلف خانوادهٔ گیرندههای لکتینی را هدف گیرد. این طراحی plug-and-play امکان سفارشیسازی اختصاصی برای انواع مختلف سرطان و ترکیبهای درمانی را باز میگذارد.
از آنجا که بسیاری از انواع تومور بر سرکوب ایمنی مبتنی بر گلیکان اتکا دارند، AbLecها میتوانند مکمل مهارکنندههای نقطهای موجود باشند یا برای بیمارانی که به بلوکهٔ PD-1/PD-L1 پاسخ نمیدهند، گزینهٔ تازهای ارائه دهند. این پلتفرم همچنین قابلیت هدفگیری چندین موتیف گلیکانی ایمنیسرکوبگر را دارد که در سرطانهای مختلف ظهور میکنند؛ بنابراین امکان طراحی درمانهای ترکیبی و شخصیسازی براساس پروفایل گلیکانومی تومور فراهم است.
چالشها و گامهای بعدی
موانع مهمی پیش از ورود AbLecها به بالین وجود دارد. گلیکانهای مرتبط با تومور گاهی بهصورت سطحی و در سطوح پایینتر در بافتهای سالم نیز بیان میشوند — که این موضوع نگرانیهایی دربارهٔ اثرات جانبی خارج از هدف و ایمنی ایجاد میکند. علاوه بر این، دستگاه ایمنی میتواند نسبت به ساختارهای پروتئینی جدید واکنشهای ایمنی (ایمونوجنیسیته) نشان دهد؛ لذا ارزیابی ایمنی، بررسی احتمالات ایمونوژنیسیته و تعیین استراتژیهای مناسب دوزدهی ضروری است. تولید پروتئینهای هیبرید پیچیده در مقیاس صنعتی و تضمین یکنواختی کیفی (CMC) نیز یک چالش عملی و هزینهبر است.
بهصورت کلیدی، ترجمهٔ این فناوری به بالین نیازمند کارآزماییهای بالینی انسانی است تا اثربخشی، تحملپذیری و اینکه آیا AbLecها واقعاً جمعیت بیشتری از بیماران را از مزایای ایمنیدرمانی بهرهمند میسازند یا خیر را ارزیابی کند. نتایج پیشبالینی این گام را توجیه میکنند، اما تنها آزمایشهای بالینیِ طراحیشده با دقت میتوانند ارزش واقعی بالینی را تعیین کنند. طراحی این کارآزماییها باید شامل شاخصهای زیستی (biomarkers) مناسب، گروههای کنترل، نقاط پایانی معنادار بالینی و نظارت دقیق ایمنی باشد.
دیدگاه تخصصی
«هدفگیری چشمانداز گلیکانی راهی زیبا برای گسترش دامنهٔ ایمنیدرمانی است»، دکتر النا مورالس، ایمونوانکولوژیست که در این مطالعه دخیل نبود، میگوید. «AbLecها بهطرز هوشمندانهای یک مشکل تحویل را حل میکنند — آنها اتصالکنندههای ضعیف گلیکان را به بلوکهکنندههای قوی و موضعی تبدیل میکنند. اگر ایمنی و اختصاصیت در کارآزماییها تأیید شود، این میتواند مکمل مهمی برای مهارکنندههای PD-1/PD-L1 باشد.» این نظر متخصص نشان میدهد که جامعهٔ پژوهشی نسبت به راهکارهایی که میکرومحیط تومور و گلیکوکالیکس را هدف میگیرند علاقهمند است و AbLecها یک مسیر ملموس برای توسعهٔ ترکیبهای درمانی جدید ارائه میدهند.
پیامدها برای بیماران و درمانها
برای بیماران، فناوری AbLec دو مزیت بالقوهٔ مهم را وعده میدهد: اول، توانایی غلبه بر یک مکانیسم فرار ایمنی که قبلاً هدفگیری نشده بود؛ دوم، انعطافپذیری برای تطبیق با آنتیژنها و اهداف گلیکانی مختلف تومور. بهطور نظری، این یعنی بخش گستردهتری از سرطانها ممکن است به ایمنیدرمانی پاسخپذیر شوند. از منظر عملی، پزشکان و پژوهشگران باید بیومارکرهایی را تعریف کنند که پیشبینی کنند کدام تومورها تحت کنترل تعاملات اسید سیالیک–Siglec قرار دارند. انتخاب بیماران، طراحی رژیمهای ترکیبی و نظارت ایمنی مشخص خواهد کرد که AbLecها چگونه در کنار درمانهای موجود بهکار گرفته شوند.
همچنین لازم است مکانیزمهای پتانسیل مقاومت ثانویه بررسی شوند: تومور ممکن است الگوهای گلیکانی خود را تغییر دهد یا آنتیژنهای سطحی را کاهش دهد تا از هدفگذاری اجتناب کند. بنابراین، پیشبینی پویایی گلیکانومی تومور در طول درمان و توسعهٔ استراتژیهای ترکیبی برای کاهش مقاومت محتمل، بخشی از برنامهٔ توسعهٔ بالینی خواهد بود. مطالعات ژنومیک، گلیکومیک و تصویربرداری مولکولی میتواند به شناسایی بیماران مناسب و پیگیری پاسخ کمک کند.
نگاهی به آینده
استراتژی AbLec نمایانگر یک روند گستردهتر در ایمونولوژی سرطان است: هدفگیری سیگنالهای بیوشیمیایی میکرومحیط تومور، نه صرفاً نقاط بازرسی سلولهای ایمنی. با تبدیل تلههای مولکولی به درمانهای هدفمند، دانشمندان در تلاشاند تا راههای جدیدی برای آشکارسازی تومور در برابر دستگاه ایمنی باز کنند. فصلهای بعدی این داستان در کارآزماییهای بالینی اولیه نوشته خواهد شد، جایی که اثربخشی، ایمنی و تأثیر واقعی در جمعیتهای بالینی محک خواهند خورد. موفقیت در این مسیر نیازمند همکاریهای میانرشتهای بین زیستشناسان گلیکو، ایمونولوژیستها، بالینپژوهان و شرکتهای بیوفارما برای عبور از موانع آزمایشگاهی به تولید و دسترسی بیمار است.
منبع: scitechdaily
نظرات
اتو_ر
مدولار بودنش امیدوارکننده است؛ بیومارکرها تعیینکنندهاند. باید کارآزماییهای دقیق باشن تا مشخص شه کدوم بیماران سود میبرن
توربو
ایده جالبه، ولی حس میکنم پرهزینه باشه، تولید پروتئین هیبریدی تو مقیاس صنعتی = دردسر و قیمت بالا، امیدوارم مقرونبهصرفه باشه
پمپزون
تو آزمایشگاه ما هم دیدیم گلیکانها فرار میزنن، این راهکار خلاقانهس، ولی سوال: چطوری پروفایل گلیکانومی بیمار رو سریع تشخیص میکنن؟
آرمین
آیا این تو انسان امنه؟ تولید و CMC هم که خودش یه کابوسه، اگر ایمنی برقرار نشه همه زحمات بیاثر میشه...
زیستک
معقول بنظر میاد، ولی ایمونوژنیسیته و اثرات خارج هدف میتونن همهچی رو پیچیده کنن، باید با احتیاط جلو برن
دیتاویو
واااو، ایدهٔ تبدیل لکتینِ ضعیف به یه بلوکهکننده موضعی واقعاً هیجانانگیزه… اگه توی بیمار واقعی هم کار کنه چی میشه؟


ارسال نظر