10 دقیقه
تحقیقات جدید آزمایشگاهی نشان میدهد که شاید روزی بتوانیم پوسیدگی دندان و بیماریهای لثه را نه با کشتن گسترده میکروبهای دهانی، بلکه با قطع «گفتوگوهای» شیمیاییای که به گونههای مضر اجازه میدهد غالب شوند، کاهش دهیم. با هدفگیری کواروم سنسینگ (quorum sensing) — سیگنالدهیای که باکتریها برای هماهنگسازی رفتار خود استفاده میکنند — پژوهشگران نشان دادهاند که میتوان پلاک دندانی را به سمت ترکیب میکروبی سالمتر هدایت کرد و تعادل میکروبی دهان را بازیابی نمود.
چگونه «گفتوگوی» باکتریها شکلدهنده محیط دهان شماست
باکتریهای موجود در دهان بهصورت فردی عمل نمیکنند. آنها در جوامع پیچیدهای به نام بیوفیلم زندگی میکنند — که پلاک دندانی شناختهشدهترین نمونه آن است — و از طریق مولکولهای شیمیایی محیط خود را حس کرده و بیان ژنها را تغییر میدهند. این فرآیند که به آن کواروم سنسینگ گفته میشود، تعیین میکند که چه زمانی باکتریها عوامل چسبندگی، بلوغ بیوفیلم یا فاکتورهای ویرولانس (بیماریزایی) را تولید کنند. دانستن این مکانیسم برای درک پلاک دندانی و مداخلات درمانی مبتنی بر میکروبیوم دهان اهمیت زیادی دارد.
یک کلاس از مولکولهای سیگنالدهنده که N-acyl homoserine lactones یا AHLs نامیده میشوند، در کواروم سنسینگ بسیاری از گونههای گرم-منفی نقش محوری دارد. وقتی غلظت AHLها به یک آستانه مشخص برسد، کلیدهای ژنتیکی را فعال میکنند که زمینه را برای گونههای دیراستعمارکننده فراهم میآورند — گونههایی که معمولاً با بیماریهای پریودنتال مرتبطاند، مانند Porphyromonas gingivalis. در مقابل، استعمارکنندههای اولیه مانند جنسهای Streptococcus و Actinomyces معمولاً از سلامت دهان پشتیبانی میکنند و نقش حفاظتی در تعادل میکروبی دارند.
تفکیک بین گونههای اولیه و ثانویه در پلاک دندانی اهمیت زیادی در پاتوفیزیولوژی پوسیدگی و بیماری لثه دارد: استعمار اولیه به چسبیدن و ایجاد ماتریس بیوفیلم کمک میکند، در حالی که سیگنالدهی جمعی میتواند رژیم ژنی باکتریهای دیررس را تغییر دهد تا فاکتورهای التهابی و تخریبی را افزایش دهند. این فرآیندها همگی در چارچوب میکروبیوم دهان و سلامت دهان نقش تعیینکنندهای دارند و میتوانند با اصطلاحات کلیدی سئو مانند «میکروبیوم دهان»، «پلاک دندانی»، «کواروم سنسینگ» و «بیماری پریودنتال» در متن بهطور طبیعی گنجانده شوند.
یافتههای مطالعه دانشگاه مینهسوتا
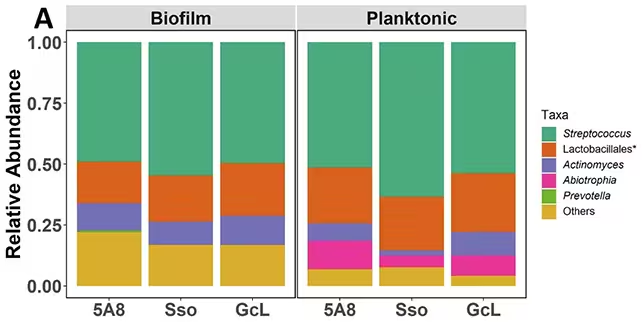
تیمی از محققان تحت هدایت دانشگاه مینهسوتا مدلهای سادهشدهای از پلاک دندانی را در آزمایشگاه رشد دادند تا نقشهای از چگونگی تأثیر سیگنالدهی مبتنی بر AHL بر ترکیب جامعه میکروبی تهیه کنند. بهجای تکیه بر آنتیبیوتیکهای گستردهالطیف که میتوانند تعادل میکروبی را به هم بزنند و به انتخاب سویههای مقاوم منجر شوند، آنها از آنزیمهایی استفاده کردند که سیگنالهای AHL را تجزیه و در نتیجه ارتباط باکتریها را قطع میکنند؛ راهبردی که به آن quorum quenching یا مهار کواروم گفته میشود.
نتایج چشمگیر بود: مسدودسازی AHLها تعادل را از سوی باکتریهای مرتبط با بیماری به سمت گونههای همراه با سلامت تغییر داد. جوامع بیوفیلمی — کلنیهای سطحچسبیدهای که پلاک را تشکیل میدهند — واکنشپذیری بیشتری نشان دادند؛ در حالی که باکتریهای شناور در فاز پلتونتیک تغییرات کمتری را تجربه کردند. این تفاوت بین بیوفیلم و جمعیتهای معلق اهمیت عملی دارد، چون بسیاری از اهداف درمانی باید به عمق بیوفیلم و نواحی چسبیده برسند تا اثر بخشی واقعی داشته باشند.
کار همچنین نکات محیطی مهمی را آشکار کرد. باکتریهایی که در زیستگاههای کماکسیژن (بیهوازی) مانند پاکتهای عمیق زیر خط لثه زندگی میکنند، ممکن است خود AHL تولید نکنند اما قادر باشند سیگنالهای تولیدشده در نقاط دیگر را تشخیص دهند. این «گفتوگوی متقاطع» (cross-talk) توضیح میدهد که چگونه جمعیتهای میکروبی دور از هم میتوانند یکدیگر را تحت تأثیر قرار دهند و چگونه تغییرات محلی در پلاک ممکن است پیامدهای سرتاسری برای میکروبیوم دهان داشته باشد.
«با اختلال در سیگنالهای شیمیایی که باکتریها برای ارتباط استفاده میکنند، میتوان جامعه پلاک را طوری دستکاری کرد که در مرحله همراه با سلامت باقی بماند یا به آن بازگردد»، گفت مایکل الیاس، بیوشیمیستی که در این مطالعه همکاری داشت. همنویسنده راکش سیکدار افزود که کواروم سنسینگ احتمالاً نقشهای متفاوتی بالای خط لثه و زیر خط لثه ایفا میکند و این نکته برای طراحی درمانهای هدفمند در بیماری پریودنتال اهمیت عملی دارد. این بینشها میتوانند راهنمای خوبی برای توسعه داروها یا محصولات دندانی هدفمند باشند.
چرا این موضوع برای سلامت دهان و سلامت کلی مهم است
چشمانداز تعدیل میکروبیوم دهان جذاب است زیرا هدف آن حفظ تعادل میکروبی است نه از بین بردن بیهدف باکتریها. این رویکرد اکو-میکروبیال میتواند از انتخاب سویههای مقاوم جلوگیری کند و گونههای حفاظتی را حفظ کند که نقش مانع در برابر استعمار پاتوژنها دارند. در زمینه کلینیکال، حفظ تعادل میکروبی کمک میکند تا از دیسبایوز (dysbiosis) جلوگیری شود — وضعیتی که در آن ترکیب میکروبی به نفع میکروبهای بیماریزا تغییر میکند.
سلامت دهان با نتایج سیستمیک گستردهای در ارتباط است: بیماری مزمن لثه در مطالعات مختلف با بیماریهای قلبیعروقی، عوارض دیابت و حتی کاهش شناختی ارتباط داده شده است. اگر استراتژیهای quorum-quenching در انسانها تأیید شود، ممکن است ابزاری دقیق برای کاهش این خطرات فراهم کنند، با جلوگیری از دیسبایوز در دهان و احتمالاً در بافتهای دیگر. بالطبع برای اثبات این ادعاها باید مطالعات طولانیمدت و کارآزماییهای بالینی صورت گیرد تا ارتباط علیتی بین مداخلات موضعی و نتایج سیستمیک بهروشنی نشان داده شود.
از منظر پیشگیری و درمان بالینی، استفاده از راهبردهای مبتنی بر قطع سیگنال میتواند مکمل روشهای فعلی مانند بهداشت دهان روزانه، جرمگیری و کنترل عوامل خطر (مانند قندخوری و سیگار) باشد. بهعنوان مثال، محصولاتی که بهطور انتخابی AHLها را تجزیه میکنند میتوانند در کنار مسواک زدن و نخ دندان کشیدن به حفظ یک میکروبیوم متعادل کمک کنند و خطر پیشرفت به مرحله التهابی شدید یا تخریب بافت_supporting_ بافتهای نگهدارنده دندان را کاهش دهند.
مسیرهای درمانی و امکانات فناوری
- آنزیمهایی که AHLها را تجزیه میکنند (quorum quenchers) میتوانند بهصورت دهانشویه، ژلهای رهاشونده آهسته یا پوششهای موضعی برای پاکتهای لثه فرموله شوند. آنزیمهای شناختهشدهای مانند لاکتونازها (lactonases) و آسیلازها (acylases) توانایی تجزیه انواع مختلف AHL را دارند و در مطالعات پیشبالینی مورد ارزیابی قرار گرفتهاند.
- رویکردهای پروبیوتیک ممکن است ترکیبی از استعمارکنندههای اولیه مفید را با مولکولهای مسدودکننده سیگنال تلفیق کنند تا جانشینی سالم در شکلگیری پلاک را تقویت کنند. این ایده مبتنی بر مفهوم «رقابت سازگاری» است: گونههای سودمند هم بهصورت مستقیم از طریق رقابت برای جایگاه و مواد غذایی و هم غیرمستقیم از طریق تغییر پیامرسانی جمعی میتوانند مانع از رشد پاتوژنها شوند.
- مهارکنندههای کوچکمولکولی کواروم سنسینگ مسیر دیگری هستند، اگرچه مشخصات و ایمنی آنها چالشهای کلیدی خواهند بود. نیاز است این ترکیبات اختصاصی گونه یا حداقل گروهی از سیگنالها باشند تا از اثرات ناخواسته روی میکروبیوم مفید جلوگیری شود.
محدودیتها و گامهای بعدی
این مطالعه در مدلهای سادهشده آزمایشگاهی انجام شد، بنابراین تحقیقات بیشتری لازم است تا تأیید شود که این پویاییها در دهان انسان به همان شکل عمل میکنند. محققان در این کار معیارهای بالینی مانند تشکیل حفره دندان یا پیشرفت پریودنتیت را اندازهگیری نکردند؛ این نقاط انتهایی بالینی برای سنجش اثربخشی واقعی هر مداخله لازم است. ترجمه یک آنزیم یا مهارکننده کوچکمولکولی به یک درمان دهانی ایمن و مؤثر نیازمند مطالعات حیوانی، آزمایشهای ایمنی، آزمایشهای انسانی کنترلشده و توجه دقیق به نحوه تأثیر مداخلات بر میکروبیوم دهان در طول زمان خواهد بود.
همچنین باید به سوالات فنی و عملی پاسخ داده شود: پایداری آنزیمها در محیط دهان، اثر بزاق و پروتئینهای میزبان بر فعالیت آنها، امکان تحریک پاسخ ایمنی میزبان و مخاطرات احتمالی تغییرات بلندمدت در میکروبیوم. از منظر توسعه محصول، فناوریهای رهاسازی هدفمند، حفاظت آنزیمی در برابر شکست هیدرولیز، و شناسایی ردپای ایمنی مناسب از جمله چالشهای مهندسی خواهند بود.
مسئله دیگر تعیین سطوح هدفمند سیگنالهای AHL در نقاط مختلف پلاک است. همانطور که مطالعه نشان داد، بیوفیلمها نسبت به جمعیتهای پلتونتیک حساسترند و نواحی بیهوازی عمیق میتوانند پیامها را دریافت کنند بدون اینکه خودشان تولیدکننده باشند. این تفاوتهای موضعی باید در طراحی دوز و روش تحویل لحاظ شوند تا اثرات مورد نظر در محلهای کلیدی اعمال شود.
بینش کارشناسان
«این کار هیجانانگیز است زیرا درمان را بهعنوان مدیریت اکولوژیک میبیند نه جنگ میکروبیاتی»، گفت دکتر لورا کیم، پژوهشگر فرضی در حوزه میکروبیوم در یک بیمارستان پژوهشی بزرگ. «کاربرد در دنیای واقعی به تحویل بستگی دارد — رساندن عوامل مهارکننده کواروم به جایگاه مناسب بدون برهمزدن میکروبهای مفید — اما این مفهوم مسیر جدیدی برای دندانپزشکی پیشگیرانه و کنترل هدفمند عفونت باز میکند.»
بهطور کلی، مطالعه یک اثباتمفهوم ارائه میدهد که ربودن ارتباط باکتریایی میتواند روش عملی برای هدایت جوامع میکروبی دهان بهسمت سلامت باشد. اگر مطالعات بعدی این یافتهها را در شرایط درونزی (in vivo) تأیید کنند، دندانپزشکان و میکروبیولوژیستها ممکن است ابزارهای جدید و ظریفی برای پیشگیری از پوسیدگی دندان و بیماریهای پریودنتال داشته باشند که در عین حفظ اعضای مفید میکروبیوم دهان، اثرات درمانی موثری ارائه دهند.
برای آمادهسازی مسیر بالینی، تیمهای تحقیقاتی باید همکاری میانرشتهای میان میکروبیولوژی، بیوشیمی، مهندسی دارویی و دندانپزشکی بالینی را تقویت کنند. همافزایی این رشتهها به طراحی آزمایشهای تصادفی کنترلی، انتخاب معیارهای زیستنمایه (biomarkers) مناسب برای نظارت بر تعادل میکروبی و ارزیابی اثرات سیستمیک احتمالی کمک خواهد کرد. در نهایت، پذیرش بالینی چنین فناوریهایی وابسته به شواهد قوی ایمنی و اثربخشی و رویکردهای مقرونبهصرفه در تولید و توزیع خواهد بود.
منبع: sciencealert
نظرات
آرمین
من تو آزمایشگاه دیدم که cross-talk واقعی هست؛ امیدوارم ژل رهاشونده جواب بده چون پاکت لثههای عمیق واقعا مشکلسازن
سفرلو
احساس میکنم کمی هایپ شده 😕 ایده کاربردیه ولی قیمت و تولید انبوه و اثرات بلندمدت رو ببینیم، بعد بزرگش کنیم...
بایونیکس
مطالعه خوب و ایدهآله؛ ولی مدل آزمایشگاهی سادهست — لازمه in vivo و کارآزمایی بالینی برای ایمنی و پایداری انجام بشه
توربو
به نظرم منطقیه، نگه داشتن باکتریای مفید بهتر از نابودی همه است. اما تحویل به عمق پلاک چالشیه
کوینکپ
خیلی خوب به نظر میاد ولی سوال اینه: تست انسانی شده یا هنوز همش تو پتری دسک و شبیهسازیه؟
نتبایت
وای! ایده هدایت پلاک به جای کشتن همه باکتریها جذابه... ولی واقعا آنزیمها توی بزاق دوام میارن؟

ارسال نظر