7 دقیقه
یک نانومادهٔ تزریقی جدید نشان میدهد که میتواند با محدود کردن آسیبهای ثانویه پس از بازگرداندن جریان خون، از بافت مغز در سکتهٔ ایسکمیک محافظت کند. در آزمایشهای روی موش، این درمان التهاب را کاهش داد، صدمات ناشی از پاسخ ایمنی را مهار کرد و روند بازسازی عصبی را پشتیبانی نمود — نتیجهای که نشاندهندهٔ پتانسیل بهعنوان درمان کمکی کنار درمانهای بازگردانی خون (reperfusion therapies) است.
نحوهٔ عملکرد «مولکولهای رقصان» در جایی که دیگر روشها چالش دارند
پژوهشگرانی در دانشگاه Northwestern مادهٔ نانویی بازسازیکنندهای به نام IKVAV-PA را توسعه دادهاند که از پپتیدهای درمانی سوپرامولکولی (supramolecular therapeutic peptides - STPs) ساخته شده است. این پپتیدها که بهخاطر حرکت و بازچینش پویا در سطح مولکولی گاهی بهعنوان «مولکولهای رقصان» توصیف میشوند، بهگونهای مهندسی شدهاند که بتوانند با سلولها بهصورت انعطافپذیر تعامل کنند. همین سازگاری ظاهراً به آنها کمک میکند تا بافت مغزی آسیبدیده را هدفگذاری کرده و سلولهای عصبی را برای خودتعمیر یا حفظ عملکردشان تشویق کنند.
سکتهٔ ایسکمیک که شایعترین نوع سکته است زمانی رخ میدهد که لختهای یک شریان مغزی را مسدود میکند. بازگرداندن سریع جریان خون گاهی نجاتبخش است، ولی این فرآیند (reperfusion) میتواند مولکولهای سمی را آزاد کند که در گردش خون پخش شده و منجر به التهاب ثانویه و صدمات اضافی میشوند. مادهٔ پپتیدی جدید طراحی شده است تا آن آبشار زیانآور را کاهش دهد و همزمان فرایندهای بازیابی بافت و ترمیم عصبی را ترویج کند. از منظر زیستپزشکی و نانو فناوری، هدف کاهش اندازهٔ اینفارکت (infarct) و تضعیف سیگنالهای آسیبزا مانند گونههای اکسیژن فعال (ROS) و پروتئازهای ماتریکسی است که میتوانند مرگ سلولی ثانویه را تشدید کنند.
مسیر سیستمی: راهی عملی برای دسترسی به مغز
یک پیشرفت کلیدی در این مطالعه، مسیر سیستمیک تزریق است: پپتیدها بهجای تحویل مستقیم به داخل بافت مغز، به جریان خون تزریق میشوند. تحویل سیستمیک سریعتر و کمتهاجمیتر است و تیم پژوهشی نشان داد که این پپتیدها از سد خونی-مغزی عبور میکنند و تا ناحیهٔ سکته نفوذ مییابند. در موشهای درمانشده، این درمان اختلالات خارج از هدف را به حداقل رساند که نشاندهندهٔ عملکرد انتخابی در نواحی مغزی آسیبدیده است.
در آزمایشهای آزمایشگاهی، موشهایی که پس از بازگردانی خون این تزریق IKVAV-PA را دریافت کردند، نواحی آسیب بافتی کمتری داشتند، نشانگرهای التهابی پایینتری نشان دادند و نشانههای پاسخ ایمنی آسیبزا کمتر دیده شد نسبت به گروه کنترل بدون درمان. بهعبارت دیگر، این درمان هم عواقب التهابی بعد از برداشتن لخته را کاهش داد و هم به حفظ یا ترمیم شبکههای عصبی کمک کرد، امری که میتواند به بهبود عملکردی پس از سکته بینجامد.
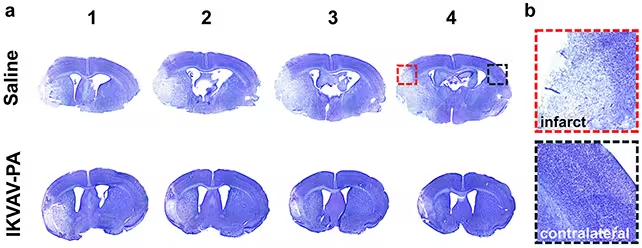
مغزهای موشهای تحت درمان (ردیف پایین) علائم کمتری از آسیب بافتی مغز را نشان دادند (نواحی رنگپریدهتر).
پیشزمینهٔ علمی و مکانیزم اثر
پپتیدهای سوپرامولکولی بهطور خودبهخودی به ساختارهای نانو مقیاس سازماندهی میشوند که میتوانند سیگنالهای زیستی را بهصورت کنترلشده به سطح سلولها ارائه دهند. IKVAV-PA حامل موتیفهایی است که چسبندگی نورونها و رشد آکسونها را تشویق میکنند و همزمان خواص ضدالتهابی موضعی نیز القا میکنند. زمانی که بازگردانی خون با آزادسازی موجی از مولکولهای مضر همراه است، این ویژگیهای ضدالتهابی میتواند مرگ سلولی ثانویه را کاهش دهد و حلقهٔ بازخوردی که منجر به تشدید آسیب میشود را بشکند.
ساموئل استاپ (Samuel Stupp)، دانشمند مواد که این کار را هدایت کرد، دو مزیت مهم را برجسته میکند: قابلیت تجویز سیستمیک و نفوذپذیری به سد خونی-مغزی. ترکیب این ویژگیها میتواند این رویکرد را فراتر از سکته گسترش دهد و برای اختلالاتی که تحویل دارو به سیستم عصبی مرکزی چالشبرانگیز است، مانند آسیب تروماتیک مغزی یا برخی بیماریهای نورودژنراتیو، مفید باشد. از منظر بیوفیزیکی و زیستشناسی مولکولی، عبور از سد خونی-مغزی ممکن است از طریق تغییرات گذرا در نفوذپذیری پس از ایسکمی یا از راهبردهای داخلی پپتید برای تعامل با ناقلها و رسپتورها تسهیل شود.
پیامدها برای بیماران و مراحل بعدی
نتایج بهدستآمده در موشها امیدوارکننده است، اما تبدیل یک موفقیت آزمایشگاهی به درمان بالینی نیازمند مطالعات دقیق و طولانیمدت است. ایمنی در دورههای طولانی، پنجرههای دوزگذاری نسبت به زمان بازگردانی خون، و احتمال واکنشهای ایمنی در انسان همگی نیاز به ارزیابی دقیق دارند. اگر این موانع برطرف شوند، این پپتید میتواند بهعنوان یک درمان کمکی همراه با تکنیکهای مرسوم بازگرداندن خون، برای کاهش ناتوانی پس از سکته مورد استفاده قرار گیرد.
عصبشناس Ayush Batra اشاره میکند که هر درمانی که ناتوانی بلندمدت را کاهش دهد، فواید شخصی و اجتماعی عظیمی خواهد داشت و بار عاطفی و مالی را از روی بیماران، خانوادهها و سیستمهای بهداشتی کاهش میدهد. دهها میلیون نفر هر سال پس از سکته زنده میمانند، اما شمار زیادی از آنها دچار ناتوانی مزمن میشوند—مشکلی که مداخلاتی مانند IKVAV-PA امیدوارند آن را کاهش دهند. از منظر سلامت عمومی، کاهش میزان ناتوانی میتواند به کاهش هزینههای مراقبت طولانیمدت و افزایش مشارکت اجتماعی و اقتصادی افراد کمک کند.
فناوریهای مرتبط و چشمانداز آینده
این پژوهش در تقاطع زیستمواد (biomaterials)، علوم اعصاب و ایمنیشناسی قرار دارد. گروههای دیگری نیز در حال بررسی داربستهای پپتیدی مشابه، حاملهای نانوذرهای و پروتئینهای مهندسیشده برای تعدیل التهاب و ترویج ترمیم هستند. یک پپتید سیستمیک که بهطور قابلاعتماد به بافت مغزی آسیبدیده برسد، میتواند تبدیل به سکویی (platform) شود: با تعویض یا ترکیب موتیفهای عملکردی میتوان درمانهایی را برای آسیب نخاعی، ALS یا بازتولید عصبی هدفمند سفارشیسازی کرد.
کاربرد در جهان واقعی وابسته به آزمایشهای بالینی انسانی است. پژوهشگران باید زمانبندی بهینه نسبت به برداشتن لخته، تعاملات احتمالی با داروهای حلکنندهٔ لخته یا فرایندهای ترومبکتومی مکانیکی، و پیامدهای بلندمدت مانند بهبود عملکردی و خطر وقوع مجدد رویدادها را مشخص کنند. علاوه بر این، مطالعات داروشناسی و فارماکوکینتیک (PK/PD) در انسان برای تعیین دوز مؤثر و محدودهٔ ایمنی ضروری خواهد بود.
نظرات کارشناسان
دکتر Lena Morales، متخصص نورولوژی و تحقیقات ترجمهای، اشاره میکند: «ایدهٔ یک مادهٔ خونحامل که به بافت مغزی آسیبدیده هوم کند و هم التهاب را آرام کند و هم از نورونها حمایت نماید، جالب است. در عمل، پنجرهٔ زمانی ایمن برای تجویز پس از بازگردانی خون حیاتی خواهد بود. اگر مطالعات آینده هدفگیری مداوم و سمیت سیستمیک پایین را تأیید کنند، این رویکرد میتواند نحوهٔ نگاه ما به مراقبت حاد سکته را تغییر دهد.»
فعلاً IKVAV-PA یک اثبات مفهوم امیدوارکننده ارائه میدهد: مولکولهای رقصانی که شاید روزی بیماران را بهسوی بازیابی بهتر همراهی کنند. در عین حال، لازم است تأکید شود که مسیر توسعه از مدل حیوانی تا درمان انسانی طولانی و نیازمند تکرار، استانداردسازی ساختار نانوپپتید، بررسی ایمنی زیستسازگاری و ارزیابی اثربخشی در جمعیتهای متنوع است.
منبع: sciencealert
نظرات
آرمین
اگر واقعاً بشه به انسان هم منتقلش کرد، بار زندگی خیلیا سبک میشه. خدا کنه مراحل بالینی هم سریع پیش بره 🙏
لابکور
از دیدگاه بیومواد، عبور از سد خونی مغزی خیلی مهمه. من تو آزمایشگاه دیده ام که... زمانبندی واقعا همه چیز رو تعیین میکنه
توربوام
احمقانه نیست، ولی حس میکنم یه کم اغراق دارن؛ پنجره زمانی خیلی مهمه، امیدوارم رعایت کنن
بیتگیر
جالبه ولی سوال دارم: عوارض بلندمدت چی؟ توی موش کار کرد، آدم کی وارد مطالعات میشه؟
دیتاپالس
وای، این "مولکولهای رقصان" واقعا امیدوارکنندهست... اگه برای انسان هم جواب بده کلی زندگیها عوض میشه

ارسال نظر