10 دقیقه
پژوهشگران برزیلی مکانیسم مولکولی مهمی را کشف کردهاند که میتواند توضیح دهد چرا آدنوکارسینوم پانکراس (سرطان لوزالمعده) تا این اندازه کشنده است: سلولهای ستلاته مرتبط با تومور پروتئینی به نام پریوستین را ترشح میکنند که چارچوب بافتی اطراف تومور را بازسازی میکند و راهی برای نفوذ زودهنگام سلولی به اعصاب فراهم میسازد. این کشف نه تنها به نشانگرهای بیولوژیک جدید اشاره میکند، بلکه اهداف درمانی تازهای را برای سرطانی که معمولاً نسبت به درمانهای فعلی مقاوم است، پیش روی پژوهشگران میگذارد. از منظر تشخیصی و درمانی، درک این مکانیسم میتواند به طراحی داروها و بیومارکرهایی منجر شود که پاسخ به درمان را بهبود ببخشد و تشخیص تهاجم عصبی (perineural invasion) را در مراحل اولیه ممکن سازد.
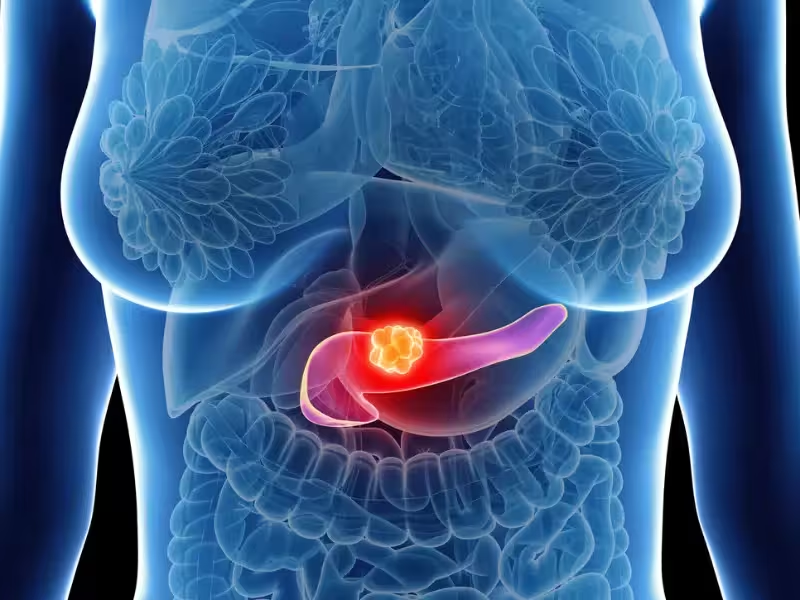
آدنوکارسینوم مجاری پانکراسی بهعنوان یک تومور تهاجمی و بسیار مرگبار شناخته میشود؛ نرخ مرگومیر آن تقریباً با میزان بروز بیماری برابر است.
مسیر پنهان تهاجم: پریوستین و انتشار پرینهورال
آدنوکارسینوم مجاری پانکراسی (PDAC) اغلب با یک توده اولیه به ظاهر کوچک ظاهر میشود اما به سرعت منتشر میگردد. یکی از عوامل کلیدی این انتشار، تهاجم پرینهورال است؛ فرآیندی که طی آن سلولهای سرطانی به اعصاب نفوذ میکنند و در امتداد آنها سفر میکنند. تهاجم پرینهورال با درد شدید بالینی، افزایش احتمال متاستاز و بدتر شدن پیشآگهی بیماران ارتباط دارد و در تعداد زیادی از بیماران حتی در مراحل اولیه بیماری نیز مشاهده میشود. همین ویژگی باعث میشود که مدلهای تشخیص و درمان PDAC نیازمند توجه ویژه به ویژگیهای میکرو محیط تومور و تعامل آن با اعصاب باشند.
مطالعهای که اخیراً در نشریه Molecular and Cellular Endocrinology منتشر شده و بهدست تیمی از مرکز تحقیقات بیماریهای التهابی (CRID) در سائوپائولو و با هماهنگی برنامه RIDC از FAPESP انجام شد، از روشهای ترنسکریپتومیک تکسلولی و فضایی با دقت بالا برای تحلیل 24 نمونه سرطان پانکراس استفاده کرد. این تیم سلولهای ستلاته پانکراس در استرومای تومور را بهعنوان منبع اصلی تولید پریوستین شناسایی کرد؛ پروتئینی از ماتریکس خارجسلولی (ECM) که داربست بافتی را بازآرایی میکند و امکان مهاجرت سلولهای توموری به سمت اعصاب و در امتداد آنها را فراهم میسازد. این یافتهها نشان میدهد که تعامل میان سلولهای تومور و استروما (میکرو محیط تومور) نقش فعالی در تسهیل تهاجم عصبی و گسترش محلی و دوردست سرطان ایفا میکند، و این امر پیامدهای مهمی برای تشخیص، پیشبینی و درمان دارد.
چگونه تومورها میکرو محیط را بازبرنامهریزی میکنند
میکرو محیط تومور در PDAC یک پسزمینه منفعل نیست؛ بلکه توسط سلولهای سرطانی بهطور فعال تسخیر و بازبرنامهریزی میشود. سلولهای ستلاته که در شرایط طبیعی سلولهای حمایتی ساکن پانکراس هستند، در مواجهه با سیگنالهای توموری فعال میگردند و تولید پریوستین را در سطوح بالا آغاز میکنند. پریوستین با دیگر اجزای ماتریکس خارجسلولی و آنزیمهایی که ماتریکس را تجزیه یا تغییر میدهند، مانند ماتریکس متالوپروتئینازها (MMPها)، تعامل میکند و مسیری با مقاومت ساختاری کاهشیافته ایجاد میکند. این بازسازی ساختاری نه تنها معماری بافت را تغییر میدهد بلکه خواص بیوفیزیکی مانند سختی (stiffness) و نفوذپذیری ماتریکس را نیز بهطور چشمگیری تحت تأثیر قرار میدهد.
به زبان عملی، بازسازی غنی از پریوستین باعث شل شدن ماتریکس خارجسلولی و ترویج واکنش دسموپلاستیک میشود: فیبروز چگال شامل کلاژن، فیبروبلاستها و واسطههای التهابی. این بافت فیبروتیک سختشده هم مهاجرت جهتدار سلولهای توموری به سمت اعصاب را تسهیل میکند و هم به طور همزمان انتقال درمانهای سیستمیک را مختل میسازد. شیمیدرمانی و بسیاری از ایمندرمانیها با سد فیزیکی مواجه میشوند که نفوذ دارو و فعالیت ایمنی موضعی را کاهش میدهد؛ بنابراین میکرو محیط تومور نقشی کلیدی در مقاومت درمانی (treatment resistance) بازی میکند. از نظر مطالعات بالینی و تحقیقاتی، این یافتهها توضیح میدهند که چرا تکدرمانیهای هدفمند علیه سلولهای توموری اغلب ناکافیاند و ترکیبهای درمانی که بهطور همزمان میکرو محیط را نیز هدف قرار دهند ممکن است مؤثرتر باشند.
هلدر ناکایا، پژوهشگر اصلی این مطالعه، سازوکار را اینگونه جمعبندی میکند: پریوستین به بازآرایی ماتریکس خارجسلولی کمک میکند تا سلولهای توموری بتوانند از توده اولیه جدا شوند و از اعصاب بهعنوان مسیرهایی برای انتشار موضعی و دوردست استفاده کنند. پزشک آنکولوژیست پدرو لوییز سِرانو سون جونیور به اهمیت بالینی این پدیده اشاره میکند: تهاجم پرینهورال نشانهای است از اینکه سلولهای توموری توانایی تحرک و ظرفیت بیشتر برای ایجاد متاستاز را کسب کردهاند—چیزی که بخش مهمی از پیشآگهی ضعیف بیماران PDAC را توضیح میدهد.
یافتههای کلیدی و رویکرد تجربی
محققان ترکیبی از توالییابی RNA تکسلولی و نقشهبرداری فضایی را برای تعیین محل فعالیت ژنی در چارچوب معماری بافت بهکار بردند. این رویکرد دوگانه به آنها اجازه داد که منبع سلولی پریوستین (سلولهای ستلاته) را به مناطق مشخصی که در آنها ماتریکس خارجسلولی بیشترین تغییرات را نشان میدهد و جایی که سلولهای توموری در اطراف اعصاب خوشهبندی شدهاند، متصل کنند. با یکپارچهسازی دادهها از چندین نمونه، شواهد محکمی حاصل شد که نشان میدهد بخش استرومال فقط یک واکنش ثانویه نیست؛ بلکه یک محرک فعال تهاجم است. این نوع تحلیل چندلایه (multi-omics و spatial transcriptomics) توانایی تشخیص تعاملات سلولی در محیط بافتی واقعی را دارد و در نتیجه نتایج بالینی قابلاستنادی را فراهم میکند.
یافتههای کلیدی شامل موارد زیر است:
- افزایش بیان پریوستین در سلولهای ستلاته پانکراس مجاور حاشیههای تومور؛ این الگو در بسیاری از نمونهها تکرار شد و ارتباط مکانی قوی با مسیرهای تهاجمی نشان داد.
- هممحلی فضایی استروما غنی از پریوستین، آنزیمهای بازسازیکننده ECM و سلولهای توموری که نفوذ پرینهورال را انجام میدهند؛ این گفته بهروشنی نشان میدهد که مولکولهای بازسازیکننده ماتریکس و سلولهای استرومال بهعنوان همکاران تهاجم عمل میکنند.
- ارتباط میان دسموپلازی (پاسخ فیبروتیک) و کاهش اثربخشی بالقوه درمانهای سیستمیک بهدلیل نفوذپذیری پایین؛ این یافته نشان میدهد که بافت فیبروتیک یک مانع فیزیکی و بیولوژیک برای توزیع دارو و فعالیت ایمنی محلی ایجاد میکند.
این نتایج بر شواهد رو به رشدی صحه میگذارد که هدف قرار دادن میکرو محیط تومور—بهجای تمرکز صرف روی سلولهای توموری—ممکن است برای مسدود کردن رفتار متاستاتیک زودهنگام در PDAC ضروری باشد. در کنار ترنسکریپتومیک، ترکیب دادههای پروتئومیک، ایمنوهیستوشیمی و مدلهای حیوانی میتواند مسیر ترجمهپذیری (translational pathway) این یافتهها را به آزمایشات بالینی هموار سازد.
پیامدهای درمانی و جهتگیریهای آینده
از منظر درمانی، پریوستین از این مطالعه بهعنوان یک هدف مولکولی امیدوارکننده بیرون آمده است. مسدودسازی مستقیم پریوستین با آنتیبادیها، مهار شرکای تعاملی آن، یا کاهش یا بازبرنامهریزی سلولهای ستلاته تولیدکننده پریوستین میتواند نفوذ پرینهورال و پتانسیل متاستاتیک تومورهای پانکراس را کاهش دهد. برخی از آزمایشهای بالینی در سرطانهای دیگر در حال بررسی استراتژیهای ضد پریوستین هستند و این میتواند تلاشهای ترجمهای برای PDAC را تسریع کند. علاوه بر این، ترکیب رویکردهای ضد پریوستین با شیمیدرمانی، ایمندرمانی یا مهارکنندههای MMP بهعنوان یک استراتژی چندوجهی میتواند مانع مقاومت درمانی شود.
مفاهیم درمانی امیدبخش شامل موارد زیر هستند:
- آنتیبادیهای مونوکلونال که پریوستین را خنثی یا اتصال آن به گیرندههای روی سلولهای تومور و استرومال را مسدود میکنند؛ این رویکرد میتواند بهطور مستقیم مسیر سیگنالینگ مهاجرت و چسبندگی ماتریکس را هدف گیرد.
- مولکولهای کوچک یا بیولوژیکهایی که آنزیمهای بازسازیکننده ECM (بهعنوان مثال برخی مهارکنندههای MMP) را بهصورت هدفمند مهار میکنند؛ این دسته دارویی باید بهدقت طراحی شوند تا اثرات سیستمیک مضر کاهش یابد و تمرکز بر محل تومور حفظ گردد.
- راهبردهای هدفگیری سلولی برای خاموش کردن فعالسازی سلولهای ستلاته یا تبدیل آنها به فنوتیپ ساکن و غیرحمایتی؛ رویکردهای سلولدرمانی یا نانوذراتی که داروها را بهطور انتخابی به استرومای تومور میرسانند از گزینههای تحقیقاتی هستند.
فراتر از توسعه دارو، این مطالعه فرصتهای تشخیصی را نیز برجسته میکند. اندازهگیری سطح پریوستین یا الگوهای ترنسکریپتومی سلولهای ستلاته فعال میتواند تشخیص زودهنگام تومورهای تهاجمی و دارای نفوذ عصبی را بهبود بخشد و به طبقهبندی بیماران برای درمانهای دقیق (precision therapy) کمک کند؛ بهویژه ترکیب استراتژیهای هدفگیری استروما با درمانهای سیتوتوکسیک یا ایمندرمانی میتواند اثربخشی درمان را افزایش دهد.
دیدگاه کارشناسان
«این مطالعه تأکید میکند که پیشرفت سرطان اغلب یک فرایند تعاملی بین سلولهای بدخیم و میکرو محیط آنهاست»، میگوید دکتر مایا تامپسون، آنکولوژیست و پژوهشگر ترجمهای که در این مطالعه مشارکت نداشت. «هدف قرار دادن محرکان استرومال مانند پریوستین میتواند راههای فرار مورد استفاده سلولهای سرطانی—یعنی اعصاب و لنفاتیکها—را تضعیف کند و درمانهای متداول را مؤثرتر سازد.»
دکتر تامپسون میافزاید که مسیر واقعگرایانه برای دستیابی به تأثیر بالینی نیازمند بیومارکرهای قوی برای شناسایی بیمارانی است که تومورهایشان به بازسازی ماتریکس وابسته به پریوستین متکی است، و نیز آزمایشات ترکیبی که مهارکنندههای استروما را با شیمیدرمانی یا ایمندرمانی همراه میسازند تا موانع فیزیکی و ایمنوساپرسیو حاصل از دسموپلازی را از بین ببرند. از منظر طراحی آزمایشهای بالینی، ارزیابی توالی و زمانبندی ترکیب درمانها، همراه با معیارهای پایان (endpoints) بالینی مناسب نظیر میزان نفوذ دارو، شاخصهای درد مرتبط با تهاجم عصبی و نرخ بقا، اهمیت دارد.
نتیجهگیری
کار تیم برزیلی پیوند مکانیسمیکی شفافتری بین فعالیت سلولهای ستلاته، بازسازی ماتریکس خارجسلولی مبتنی بر پریوستین و تهاجم پرینهورال در آدنوکارسینوم پانکراس فراهم میکند. با نشان دادن اینکه چگونه تومور بهطور فعال بافت سالم اطراف را بازشکل میدهد تا نفوذ زودهنگام به اعصاب را تسهیل کند، این مطالعه بخشی از رفتار کشنده PDAC را بهعنوان یک فرایند قابل هدفگیری بازتعریف میکند. ترجمه این بینشها به ابزارهای بالینی—آنتیبادیها، مولکولهای کوچک و ابزارهای تشخیصی—میتواند مسیرهای جدیدی در پزشکی دقیق برای یکی از دلایل شایع مرگومیر ناشی از سرطان بگشاید.
با پیشرفت تحقیقات، ترکیب درمانهای متمرکز بر میکرو محیط با درمانهای متداول ممکن است کلید بهبود نتایج بیماران مبتلا به سرطان پانکراس باشد. گامهای بعدی روشناند: اعتبارسنجی پریوستین بهعنوان یک بیومارکر پیشبینیکننده، آزمایش عوامل مسدودکننده پریوستین در مدلهای پیشبالینی PDAC، و طراحی آزمایشات بالینی که هم سلولهای تومور و هم شرکای استرومال آنها را مورد توجه قرار دهند. علاوه بر این، بررسی نقش پریوستین در حالتهای مولکولی مختلف تومور، تعامل آن با مسیرهای التهابی و ایمنی، و ارتباط آن با پاسخ به درمانهای نوین میتواند چارچوبی برای توسعه راهبردهای درمانی مبتنی بر شواهد گستردهتر فراهم آورد.
منبع: scitechdaily
نظرات
مکس_
اگر پریوستین رو بزنیم پایین، ممکنه عوارض سیستمی نداشته باشه؟ یعنی ممکنه بافت سالم هم صدمه ببینه؟ سوالای زیادی دارم...
آرمان
معقول به نظر میاد، ترکیب ضد پریوستین با شیمیدرمانی شاید بازی رو عوض کنه.
سیتیلن
نخبهگرایی متن رو اذیت میکنه؛ کلی پتانسیل هست ولی جملهها شبیه خلاصه کنفرانسن، کاش دادههای بالینی هم بیشتر بود.
بیونیکس
تو آزمایشگاه هم دیدم سلولهای ستلاته مثل یار کمکت عمل میکنن، اما اینکه پریوستین نقش محوری داشته باشه، هیجانانگیزه و امیدوارم مدلهای پیشبالینی جواب بدن.
توربو
جالبه؛ هرچی بیشتر میفهمیم، میفهمیم باید همزمان استروما رو هم هدف بگیریم. ولی ترجمهاش به درمان واقعی راه طولانی داره
کوینکس
این واقعیه یا فقط مدل آزمایشگاهی؟ نشون میده امیدوارکنندهست، ولی بعید نیست توی بدن آدم فرق کنه؟
رودایکس
واقعا؟ این یعنی تومور خودش مسیر فرار میسازه... فکر نمیکردم اینقدر پیچیده باشه، حیف که خیلی زود تشخیص سخت میشه!

ارسال نظر