8 دقیقه
پژوهشگران یک تغییر ظریف و وابسته به سن را در سلولهایی که دیوارهٔ داخلی روده را میپوشانند شناسایی کردهاند — جابهجایی در نشانههای DNA که میتواند بهتدریج ژنهای مهارکنندهٔ تومور را خاموش کند و پیش از شکلگیری تومور، در سطح وسیعی از روده گسترش یابد. آزمایشهای جدید التهاب مزمن، تغییرات در سیگنالدهی سلولی و نارسایی در تعادل آهن داخل سلولی را بهعنوان عوامل محرک این فرایند نشان میدهند، امری که کمک میکند توضیح دهیم چرا خطر ابتلا به سرطان کولورکتال با افزایش سن بالا میرود.
چگونه پیری کنترل ژنها در روده را بازنویسی میکند
دانشمندان این پدیده را "جابجایی مرتبط با پیری و سرطان روده" یا ACCA drift نامیدهاند: الگویی از تغییرات در متیلاسیون DNA که بدون تغییر در کد ژنتیکی، ژنها را خاموش میکند. متیلاسیون DNA یک نشان اپیژنتیک است — برچسب شیمیایی که به سلول میگوید آیا باید یک ژن فعال باشد یا خیر. در طول چند دهه این برچسبها میتوانند جابهجا شوند، تجمع یابند یا از دست بروند و باعث شوند بافت نمایهٔ اپیژنتیک «پیرتری» پیدا کند.
با مقایسهٔ بافت سالم کولون از افراد با سنین مختلف و بافتهای توموری کولورکتال، تیم بینالمللی الگوهای متیلاسیون همپوشانی را مشاهده کرد. این شباهت نشان میدهد که همان جابهجایی اپیژنتیک که در پیری طبیعی ظاهر میشود، در بافتهای سرطانی نیز بهچشم میخورد و بدینترتیب یک مسیر مشترک از تغییر مولکولی مرتبط با سن تا افزایش ریسک سرطان را نشان میدهد. این نتیجه در مسیرهای مولکولی، شامل تغییر در فعالیت آنزیمهای تنظیمکنندهٔ متیلاسیون و پروفایلهای تنظیمی ژنها نمود پیدا میکند.
نقطهٔ آغاز جابجایی — و چگونگی گسترش آن
این اثر در کریپتهای رودهای آغاز میشود، فرورفتگیهای کوچکی در پوشش روده که سلولهای بنیادی را در خود جای دادهاند و مسئول بازسازی مداوم اپیتلیوم هستند. با بهرهگیری از نمونههای انسانی، مدلهای موشی و ارگانوئیدهای در آزمایشگاه (سیستمهای کوچکشدهٔ روده)، پژوهشگران رد ACCA drift را تا تغییرات داخل سلولهای بنیادی کریپت دنبال کردند. همانطور که آن کریپتهایی که تحت کنترل سلولهای بنیادی تغییر یافتهاند تقسیم میشوند و بافت همسایه را جایگزین میکنند، نواحی دارای پروفایل اپیژنتیک پیرتر و مستعد سرطان بهتدریج افزایش مییابند.
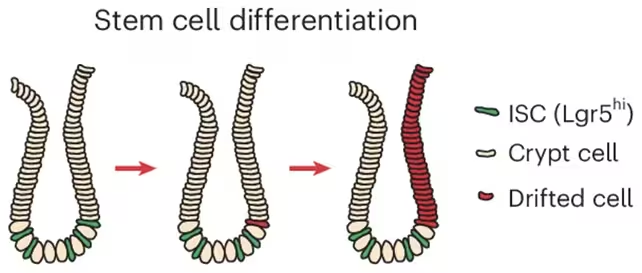
پژوهشگران تغییرات و گسترش سلولهای بنیادی کریپت را شناسایی کردند.
چندین عامل با هم تداخل پیدا میکنند و نگهداری نرمال نشانهای متیلاسیون را مختل میسازند: التهاب مزمن در روده، تضعیف سیگنالهای رشد و کاهش آهن داخل سلولی. وقتی سامانههای ترمیم وابسته به آهن دچار اختلال میشوند، نشانهای متیلاسیونی نادرست ماندگار شده و ژنهایی که بهطور معمول جلوی تومور را میگیرند، بهتدریج خاموش میشوند. این فرایند میتواند شامل تغییر در فعالیت DNA methyltransferaseها (DNMTها) و آنزیمهای وابسته به آهن مانند خانوادهٔ TET باشد که در حذف متیلاسیون غیرطبیعی نقش دارند.
چرا التهاب و آهن اهمیت دارند
- التهاب سیگنالهایی آزاد میکند که سلولهای بنیادی را تحت فشار قرار میدهد و نگهداری اپیژنتیک را مختل میسازد.
- کاهش سیگنالهای رشد توانایی سلول در اصلاح یا جایگزینی الگوهای اپیژنتیک معیوب را کاهش میدهد.
- کمبود آهن داخل سلولی عملکرد آنزیمهایی را که متیلاسیون نابهنجار را حذف میکنند مختل میکند و اجازه میدهد نشانهای مضر تجمع یابند.
«ما الگوی اپیژنتیکی را مشاهده میکنیم که با افزایش سن آشکارتر میشود،» گفت Francesco Neri از دانشگاه تورین و بدین وسیله پیوند میان جابهجایی تدریجی متیلاسیون و افزایش حساسیت به سرطان در سالهای بعد را برجسته کرد. Anna Krepelova، نیز از تورین، افزود که تقسیم کریپت مانند یک پچورک رشد آهسته عمل میکند: «از طریق فرایند طبیعی تقسیم کریپتها، این نواحی بهطور پیوسته بزرگ میشوند و میتوانند طی سالها رشد کنند.»
مهم این است که آزمایشها در ارگانوئیدها نشان داد جابجایی لزوماً دائمی نیست. بازگرداندن جذب آهن یا بازیابی بعضی سیگنالهای رشد خاص، فرایند پیری اپیژنتیک در سلولهای بنیادی کریپت را کند کرد و در برخی موارد تا حدی معکوس نمود. این برگشتپذیری نشانهٔ امیدوارکنندهای است که فرایندهای مولکولی زیربنایی پیری و خطر سرطان ممکن است قابلتأثیر یا تعدیل باشند.
پیامدها برای پیشگیری و پژوهشهای آینده
این مطالعه خطر سرطان کولورکتال را نه تنها بهعنوان نتیجهٔ تجمع جهشهای DNA بلکه بهعنوان پیامدی از تغییرات پیشروندهٔ اپیژنتیک سطحوسرایت که روی سطح روده گسترش مییابند بازتعریف میکند. این چشمانداز امکان توسعهٔ استراتژیهای پیشگیرانهٔ نوینی را فراهم میآورد که التهاب، متابولیسم آهن و سیگنالدهی سلولی در جایگاه سلولهای بنیادی روده را هدف قرار میدهند. تلاشهای غربالگری که بتوانند «مناطق خطر اپیژنتیک» را شناسایی کنند، ممکن است روزی مکمل روشهای موجود برای تشخیص زودهنگام شوند — از جمله آزمونهای مولکولی بر اساس الگوهای متیلاسیون در نمونههای بافتی یا حتی نمونههای مدفوع.
با اینکه نواحی خطر و سرعت ACCA drift در میان افراد متفاوت خواهد بود، شناخت عوامل محرک، محققان را به اهداف مولکولی مشخصی هدایت میکند که میتوان آنها را در مدلهای پیشبالینی و مطالعات بالینی آزمود. نتایج منتشرشده در Nature Aging به یک لایهٔ جدید از زیستشناسی پیری اشاره میکند — لایهای که ممکن است با مداخلات مناسب آهسته یا تنظیم شود تا خطر lifetime ابتلای به سرطان روده کاهش یابد.
در ادامهٔ بحث علمی پیرامون موضوع، چند نکته فنی و زمینهای اهمیت دارد: متیلاسیون DNA معمولاً توسط آنزیمهای انتقالدهندهٔ گروههای متیل (DNMTها) برقرار میشود و حذف یا اصلاح این نشانها اغلب مستلزم آنزیمهایی است که برای فعالیت خود به آهن و کوفاکتورهای متابولیک نیاز دارند. اختلال در وضعیت آهن سلولی میتواند توازن این آنزیمها را بههم زده و منجر به تثبیت الگوهای اپیژنتیکی نامطلوب شود. علاوه بر این، مسیرهای التهابی مانند NF-κB و سیتوکینهایی مثل IL-6 و TNF-α میتوانند بر رفتار سلولهای بنیادی و محیط میکروبیوتای روده اثر بگذارند و بهطور غیرمستقیم پروفایل اپیژنتیک را تحتتأثیر قرار دهند.
از منظر بالینی، این یافتهها پیامدهایی برای توصیههای پیشگیرانه و سیاستهای سلامت عمومی دارند. تنظیم وضعیت تغذیهای و آهن، کنترل التهاب مزمن دستگاه گوارش (مثلاً در بیماری التهابی روده) و توسعهٔ داروهایی که روی آنزیمهای اپیژنتیک عمل میکنند، میتوانند محور برنامههایی باشند که هدفشان کاهش ریسک سرطان کولورکتال در طول عمر است. با این حال، هرگونه مداخله نیاز به آزمون دقیق در مطالعات بالینی دارد تا کارایی و ایمنی آنها اثبات شود؛ زیرا تنظیم آهن یا سرکوب التهاب میتواند اثرات سیستمیک پیچیدهای نیز داشته باشد.
در نهایت، پیگیری طولی (Longitudinal) افراد برای ثبت سرعت و الگوی ACCA drift، و همچنین ترکیب دادههای اپیژنتیک با اطلاعات ژنتیکی، اپیدمیولوژیک و میکروبیوتا، میتواند به توسعهٔ مدلهای پیشبینی بهتر و شخصیسازی رویکردهای غربالگری و پیشگیری کمک کند. این ترکیبِ دادهها ضمن تقویت اعتبار نتایج، فرصتهایی را برای یافتن نشانگرهای زیستی (biomarkers) با دقت بالاتر فراهم میآورد که قابلاستفاده در عمل بالینی باشند.
بهطور خلاصه، شواهد جدید نشان میدهد که پیری اپیژنتیک روده و جابهجایی متیلاسیون DNA یک عامل مهم و قابلتوجه در افزایش خطر سرطان کولورکتال است — عاملیتی که با عوامل قابلتغییر مانند التهاب و آهنِ داخلسلولی در تعامل است و میتواند بهعنوان هدف برای اقدامات پیشگیرانه و پژوهشهای بالینی آینده مطرح شود.
منبع: sciencealert
نظرات
کوینهات
معقول بنظر میاد، ولی مداخله روی آهن میتونه خطر داشته باشه؛ با احتیاط پیگیری کنن.
اسمانگرد
من تو آزمایش ارگانوئید دیدم بعضی وقتا برگشتپذیره، گاهی نه؛ اگه بشه تو بدن هم معکوسش کرد واقعا تحولی بزرگ میشه، امیدوارم ادامه بدن
دیتاپالس
رویکرد علمی قوی به نظر میاد، هدف گرفتن التهاب و آهن منطقیه اما عوارض سیستمیک و پیچیدگی متابولیسم آهن رو نباید دست کم گرفت، نیاز به مطالعات طولی و کنترل شدهست
رضا
این همه تاکید روی متیلاسیون، آیا واقعا جدا از تجمع جهشهاست؟ واقعاً؟
بایونیکس
وای، یعنی پیری اپیژنتیک میتونه اینقدر گسترده بشه؟!... نگران کننده ست ولی امیدوارم بشه کنترلش کرد

ارسال نظر