7 دقیقه
محققان یک ریشه ژنتیکی مشترک را که هشت اختلال عمده روانپزشکی را به هم پیوند میدهد، کشف کردهاند و نشان دادهاند چگونه برخی واریانتهای ژنی در طول فرایند رشد مغز عمل میکنند و میتوانند بر طیف وسیعی از اختلالات تأثیر بگذارند. این یافتههای جدید نشاندهنده مسیرهای مولکولی مشترکی است که ممکن است به عنوان اهدافی برای درمانهایی عمل کنند که میتوانند بیش از یک بیماری را همزمان مورد هدف قرار دهند.
نشانههای ژنتیکی مشترک در میان هشت اختلال
در تصویری روبهگسترش از ژنتیک روانپزشکی، یک تیم مستقر در ایالات متحده بر پایه کارهای بینالمللی پیشین تلاش کردند تا نقشهای از نحوه مشارکت همان ژنها در تشخیصهای متنوع تهیه کنند. در سال 2019، پژوهشگران 109 ژنی را شناسایی کردند که در ترکیبهای مختلف در اختلال طیف اوتیسم، اختلال نقص توجه و بیشفعالی (ADHD)، اسکیزوفرنی، اختلال دوقطبی، اختلال افسردگی اساسی، سندرم تورت، اختلال وسواس-اجباری و بیاشتهایی عصبی ظاهر شده بود. این همپوشانی زیستشناختی توضیحی برای چرایی همراهی مکرر این اختلالات در افراد و خانوادهها ارائه میداد.
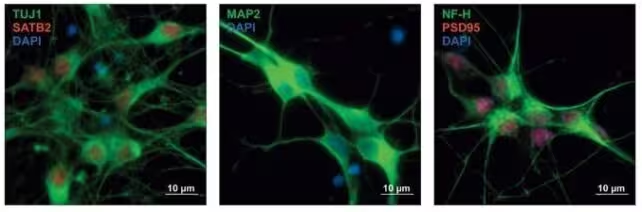
نورونهای پیشساز انسانی با بیان پروتئینی که به رنگهای مختلف رنگآمیزی شده است، نشاندهنده انواع در حال رشد نورونها.
مطالعه اخیر که اوایل سال 2025 در نشریه Cell منتشر شد، عمیقتر کاوید. به جای فهرستکردن تنها ژنهای درگیر، محققان نزدیک به 18,000 واریانت ژنتیکی را از مجموعه ژنهای مشترک و ژنهای اختصاصی هر اختلال انتخاب و آزمایش کردند. آنها این واریانتها را وارد سلولهای پیشساز عصبی انسانی کردند تا تأثیر آنها بر تنظیم ژنها را در پنجرههای بحرانی رشد مغز مشاهده کنند. این رویکرد تجربی روی تنظیم ژنی در مراحل حساس نوروروشد متمرکز بود و از مدلهای سلولی انسانی برای شناسایی تاثیرات زمانی و مکانی واریانتها بهره گرفت.
روشهایی که نشان میدهند ژنها چه زمانی و چگونه عمل میکنند
با مدلسازی فعالیت واریانتها در نورونهای در حال رشد انسانی و سپس اعتبارسنجی نتایج در نورونهای در حال رشد موش، تیم تحقیقاتی 683 واریانت را شناسایی کرد که بهطور قابل اندازهگیری فعالیت تنظیمی را تغییر میدهند. بسیاری از این تغییرات پلیتروپیک هستند: یعنی یک واریانت واحد بر چندین صفت یا اختلال تأثیر میگذارد. این واریانتهای پلیتروپیک نه تنها در محدوده وسیعتری از انواع سلولهای مغزی فعال بودند، بلکه میزان تعامل پروتئین-با-پروتئین بیشتری نیز نسبت به واریانتهای اختصاصی یک اختلال نشان دادند.
در سطح فنی، شناسایی این واریانتهای تنظیمی نیازمند ترکیب روشهای پیچیده بیوانفورماتیک و آزمایشهای عملکردی بود. تیم از آزمایشهای گزارشگری تنظیمی، ویرایش ژن با CRISPR و تحلیل شبکههای پروتئینی برای تعیین اینکه کدام واریانتها واقعاً منجر به تغییرات عملکردی در تنظیم ژنی میشوند استفاده کردند. همچنین بررسیهای زمانی (time-course) نشان داد که برخی واریانتها تنها در مراحل اولیه تمایز نورونی فعال هستند، درحالیکه دیگر واریانتها فعالیتی ممتد در طول بلوغ نورونی نشان میدهند.
منظور از پلیتروپی در این مطالعه چیست
پلیتروپی—حالتی که یک تغییر ژنتیکی چندین فرایند زیستی را تحت تأثیر قرار میدهد—به توضیح همپوشانی علائم و همرخدادی تشخیصی کمک میکند. «پروتئینهایی که توسط این ژنها تولید میشوند نیز به شدت به سایر پروتئینها متصل هستند»، هَیجونگ وون، ژنتیکدان دانشگاه کارولینای شمالی، توضیح داد. «تغییرات در این پروتئینها میتواند مانند امواجی در شبکه حرکت کند و احتمالا اثرات گستردهای بر مغز داشته باشد.»
این دید شبکهای اهمیت دارد زیرا بسیاری از واریانتهای پلیتروپیک در پنجرههای توسعهای طولانیتری فعال میمانند و امکان دارد آبشاری از تنظیم ژنی را از تمایز اولیه نورونی تا بلوغ بعدی تحتتأثیر قرار دهند. به عبارت عملی، یک واریانت میتواند مراحل مختلف توسعه و انواع سلولی متفاوتی را تحتتأثیر قرار دهد و بر اساس زمان و زمینه سلولی، نتایج بالینی متنوعی تولید کند. این سازوکار میتواند توضیح دهد چرا یک واریانت در یک فرد با سن یا محیط مشخص باعث اسکیزوفرنی میشود و در فرد دیگری با زمینه ژنتیکی یا محیطی متفاوت با اختلال افسردگی یا اوتیسم همراه است.
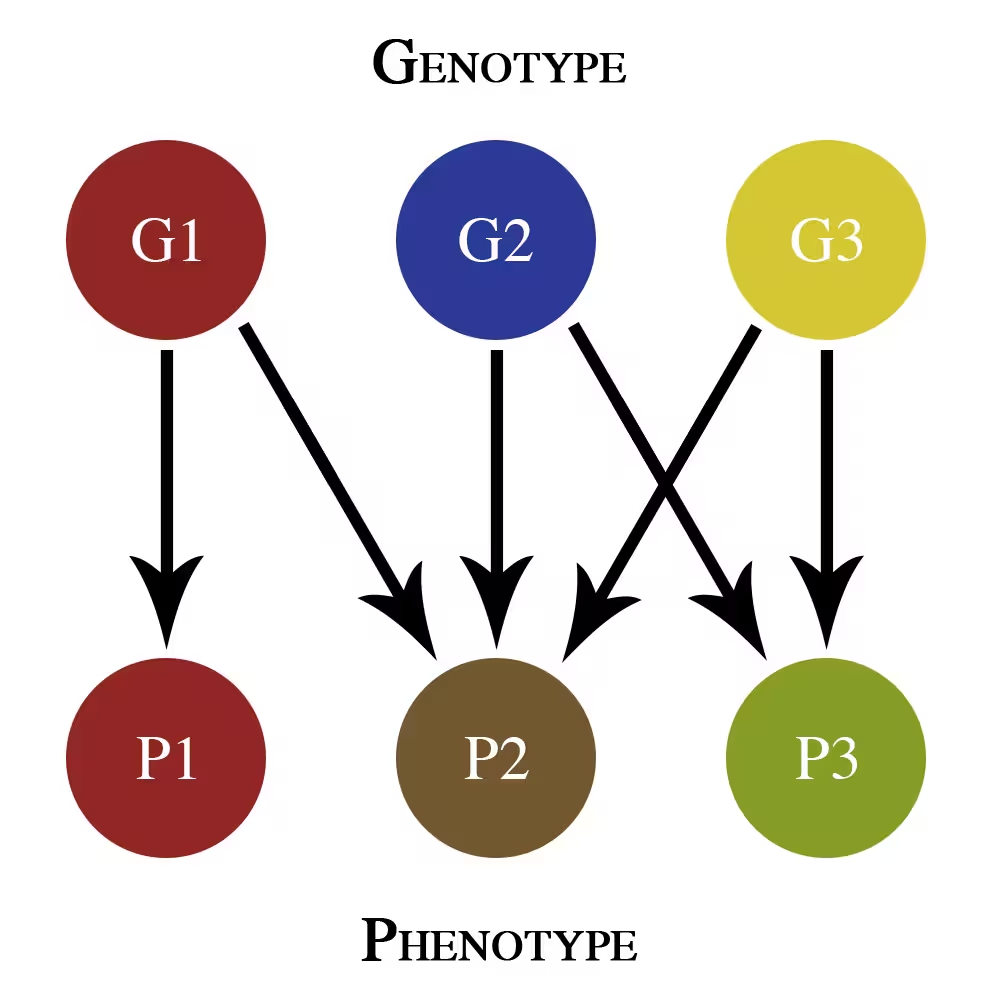
این نقشه ساده ژنوتیپ-فنوتیپ تنها اثرات افزایشی پلیتروپی را نشان میدهد. G1، G2 و G3 ژنهای مختلفی هستند که به صفات فنوتیپی P1، P2 و P3 کمک میکنند.
چرا این یافته میتواند استراتژیهای درمانی را تغییر دهد
درک معماری ژنتیکی مشترک، شیوه تفکر دانشمندان در مورد تشخیص و درمان را تغییر میدهد. وون گفت: «پلیتروپی بهطور سنتی بهعنوان یک چالش دیده میشد، زیرا طبقهبندی اختلالات روانی را پیچیده میکند. با این حال، اگر بتوانیم پایه ژنتیکی پلیتروپی را درک کنیم، ممکن است بتوانیم درمانهایی توسعه دهیم که این عوامل ژنتیکی مشترک را هدف قرار میدهند و در نتیجه چندین اختلال روانپزشکی را با یک درمان مشترک مساعدت کنند.»
اهمیت سلامت عمومی بسیار بالا است: سازمان جهانی بهداشت تخمین میزند حدود یک نفر از هر هشت نفر—تقریباً یک میلیارد نفر در سراسر جهان—با نوعی از اختلال روانی زندگی میکنند. درمانهایی که گرههای مرکزی در شبکههای پروتئینی یا آبشارهای تنظیمی را هدف قرار میدهند میتوانند بهصورت نظری بار علائم را در دستهبندیهای تشخیصی مختلف کاهش دهند، بهجای آنکه هر اختلال را بهطور مجزا درمان کنند. چنین رویکردی میتواند به صرفهجویی در منابع درمانی، افزایش کارایی داروها و کاهش زمان مورد نیاز برای رسیدن بیمار به بهبود منجر شود.
علاوه بر جنبههای درمانی، این پژوهش یک نقشه راه برای کارهای آینده فراهم میآورد: اولویتبندی واریانتهای تنظیمی پلیتروپیک، نقشهبرداری از فعالیت زمانی آنها در مغز در حال رشد، و آزمودن اینکه آیا مداخله در مسیرهای مشترک، ریسک چندین اختلال را همزمان تغییر میدهد یا خیر. کلید این رویکرد ترکیب دادههای ژنتیکی جمعیتی، مدلهای سلولی انسانی، مدلهای جانوری برای اعتبارسنجی عملکردی و تحلیل شبکهای است تا هدفهای مولکولی مرکزی شناسایی شوند.
برای آمادهسازی این نوع درمانهای هدفمند، لازم است محدودیتها و گپهای دانش فعلی نیز در نظر گرفته شوند. بسیاری از واریانتهای شناساییشده اثرات کوچک اما تجمعی دارند؛ بنابراین ترجمه آنها به اهداف درمانی بلندمدت نیازمند مطالعات بزرگتر، شبیهسازی مسیرهای سیگنالی و ارزیابی ایمنی مداخلات مولکولی در مدلهای بالینی است. همچنین باید بین تغییرات عملکردی در سلولهای آزمایشگاهی و پیامدهای بالینی واقعی تفکیک برقرار کرد؛ یعنی نشان داد که اصلاح یک مسیر مولکولی خاص واقعاً میتواند ریسک یا شدت اختلال را در انسان کاهش دهد.
از منظر دادهها و مدارک علمی، این مطالعه بر پایه روشهای آزمایشگاهی و تحلیلهای شبکهای معتبر است و با انتشار در Cell قابلیت پیگیری و اعتبارسنجی توسط دیگر گروههای تحقیقاتی را دارد. اگرچه برخی اظهارنظرها نیازمند بررسیهای مستقل و تکرارپذیری در نمونههای بزرگتر و متنوعتر جمعیتی هستند، اما ترکیب یافتههای ژنتیکی با دادههای عملکردی سلولی گامی مهم به سمت افزایش اقتدار علمی (content authority) در حوزه ژنتیک اختلالات روانی به شمار میآید.
در نتیجه، این تحقیق نه تنها بینشهایی درباره مکانیسمهای مولکولی مشترک فراهم میآورد، بلکه ایدههای متفاوتی برای موقعیتیابی رقابتی (competitive positioning) پژوهشهای بعدی ارائه میدهد: به جای جستجوی هدفهای منحصر به یک اختلال، توجه را به مسیرها و گرههای مرکزی شبکه معطوف کنیم که میتوانند چندین اختلال را همزمان تحتتأثیر قرار دهند. این بینش میتواند پژوهش و توسعه دارویی را به سمت ساخت داروهای فراگیرتر و راهکارهای تشخیصی جامعتر هدایت کند.
منبع: sciencealert
نظرات
فینهانت
نقشهبرداری زمانی جذابه؛ امیدوارم گروههای مختلف تکرار و تطبیق بدن، نمونههای بزرگتر لازمه، صبر ببینیم
شبشهر
خیلی خوبه ولی یه خورده اغراق نشه؛ شناسایی واریانت ها قدم خوبیه ولی درمان روی انسان کلی پیچیدهتره، حقه بازی نیست
امیر
تو بیمارستان دیدهم، خانوادهها چندتا تشخیص دارن، این توضیحات میتونه نفهمیها رو کم کنه اما... باید ببینیم در عمل چی میشه
بیوانیکس
چطور از سلولهای کشتشده میشه به درمان قطعی رسید؟ اینهمه واریانت با اثر کوچک، واقعا قابل هدف گیری هستن؟
دیتاپالس
وااای، فکر نمیکردم پلیتروپی اینقدر پیچیده باشه... اگر درمان مشترک باشه عالیه، ولی راه طولانیه

ارسال نظر