8 دقیقه
این بهظاهر پارادوکس است: بیماریای که زندگیها را ویران میکند ممکن است مولکولهایی حمل کند که پیشرفت یک بیماری ویرانگر دیگر را کند میکنند. با این حال، کارهای آزمایشگاهی اخیر روی موشها دقیقاً به همین احتمال اشاره دارند و دلیل آن در یک پروتئین کوچک و تیم پاککننده مغز نهفته است.
الگوی غیرمنتظره بین دو تشخیص تلخ
پزشکان و اپیدمیولوژیستها مدتهاست یک الگوی عجیب را مشاهده کردهاند: بهطور میانگین افرادی که با سرطان تشخیص داده میشوند، احتمال کمتری دارد که بعداً مبتلا به بیماری آلزایمر شوند، و بالعکس افراد مبتلا به آلزایمر بهنظر کمتر در معرض ابتلا به سرطان قرار میگیرند. همبستگی الزاماً به معنای علیت نیست. با این حال وقتی الگو در مطالعات بزرگ جمعیتی تکرار میشود، شایسته توضیح مکانیکی است.
بیماری آلزایمر بهطور سنتی با آمیلوئید بتا مرتبط است؛ پروتئینی که بهصورت ناصحیح تا میشود و در بین نورونها تجمع یافته و پلاکهای چسبندهای ایجاد میکند. این پلاکها پیامرسانی عصبی را مختل میکنند، التهاب مزمن را برمیانگیزند و به کاهش پیشرونده شناختی کمک میکنند. در مغزهای سالم، سلولهای ایمنی بهنام میکروگلیا بافت را گشت میزنند و زبالهها را پاک میکنند، اما در آلزایمر اغلب این سلولها در حذف پروتئینهای ناصحیح تاخورده ناکارا میشوند و اجازه میدهند پلاکها تجمع یابند.
نتایج آزمایشهای موشی چه نشان داد
محققان بافتهای توموری انسانی—برداشتهشده از سرطانهای ریه، پروستات و روده—را زیر پوست موشهای دستورزیشدهای کاشتند که بهطور طبیعی با افزایش سن پلاکهای متراکم آمیلوئید بتا را تشکیل میدهند. نتیجه چشمگیر بود. موشهایی که تومور حمل میکردند در مغز خود تجمع پلاک کمتری نسبت به همتایان بدون تومور نشان دادند. در چند آزمون، موشهای حامل تومور در وظایف حافظه نیز عملکرد بهتری داشتند که نشان میداد تغییر تنها یک نشانه میکروسکوپی نبود و پیامدهای کارکردی داشت.
ردیابی سیگنال تیم را به سمت سیستاتین‑C هدایت کرد؛ پروتئین کوچکی که ترشح میشود و در نمونههای خون تومور بسیار فراوان بود. شواهد آزمایشی نشان میدهد سیستاتین‑C تولیدشده توسط تومور وارد گردش خون میشود، از سد خونی‑مغزی عبور میکند—مرزی انتخابی و اندوتلیالی که معمولاً اجازه عبور بسیاری از مولکولهای خونی را نمیدهد—و به پارانشیم مغز میرسد.
پس از ورود به مغز، بهنظر میرسد سیستاتین‑C به خوشههای نوظهور آمیلوئید بتا میچسبد و نقش برچسب را ایفا میکند. این برچسب ظاهراً میکروگلیا را ازطریق گیرندهای شناختهشده بهنام Trem2 درگیر میکند و این سلولهای ایمنی را به فنوتیپی فعالتر و پاککننده پلاک تبدیل میکند. بهاختصار: تومورها مولکولی صادر کردند که به میکروگلیا در انجام وظیفهاش کمک میکرد.
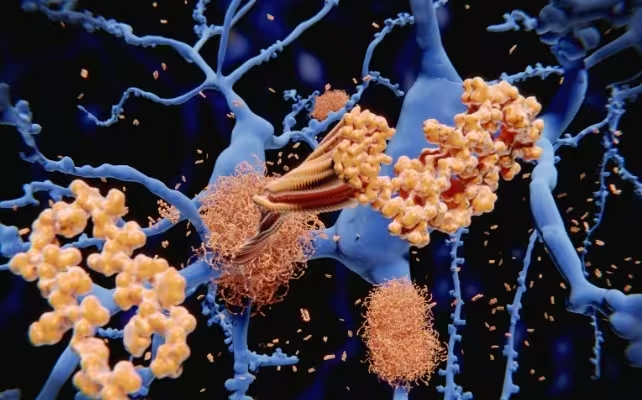
تجمعهای آمیلوئید بتا التهاب و آسیب در بافت مغز ایجاد میکنند.
زیستشناسی مبادلات و مصالح
در نگاه اول ایده اینکه سرطان بتواند اثری محافظتی بر مغز داشته باشد غیرمنطقی بهنظر میرسد. اما زیستشناسی تکاملی و مولکولی پر از مصالحههاست: مسیرهایی که در یک زمینه بقای سلول و رشد را تسهیل میکنند میتوانند در زمینهای دیگر مضر باشند. متابولیسم تومور و «سکریتوم» آن—مخلوطی از پروتئینهای ترشحشده—بازتابی از میل تومور به رشد و فرار از کنترلهای محلی است. گاهی این عوامل ترشحشده در نقاط دیگر بدن اثرات خارج از هدف دارند، خواه به نفع یا ضررِ میزبان.
در اینجا سیستاتین‑C شبیه یک محصول جانبی از بیولوژی تومور است که بهطور اتفاقی به میکروگلیا کمک میکند تا دانههای آمیلوئید را شناسایی و حذف کند. این بدان معنا نیست که سرطان مطلوب است. آسیبهای ناشی از بدخیمی بسیار فراتر از هر فایده اتفاقی است. اما شناسایی این پروتئین و مکانیزم آن فرصتهایی ایجاد میکند: آیا میتوانیم اثر مفید سیستاتین‑C را بدون ایجاد تومور تقلید کنیم؟
پیامدها و امکانات درمانی
چند مسیر ترجمهپذیر قابل تصور وجود دارد. یکی طراحی فرمهای مهندسیشده سیستاتین‑C است که بهتر به آمیلوئید بتا متصل شوند یا مدت زمان بیشتری در مغز باقی بمانند. دیگری توسعه مولکولهای کوچک یا بیولوژیکهایی است که بهطور انتخابی Trem2 را فعال کنند و میکروگلیا را به سمت وضعیت پاککنندگی پلاک سوق دهند. رویکردهای ژندرمانی نیز قابل تصورند، اگرچه موانع نظارتی و ایمنی بالاتری دارند.
هر مسیر نیازمند تعادلبخشی دقیق است. فعالسازی میکروگلیا میتواند تیغ دو لبه باشد: فعالسازی بسیار کم باعث ماندگاری پلاکها میشود؛ فعالسازی بیش از حد هم inflammation و آسیب به نورونها را درپی دارد. هر درمانی باید پاسخ ایمنی را به سمت برنامهای سازنده و نه مخرب سوق دهد.
هشدار کلیدی این است که این یافتهها از موشها بهدست آمدهاند، نه انسان. مدلهای موشی جنبههایی از آلزایمر—بهویژه رسوب آمیلوئید—را بازتولید میکنند اما تمام چشمانداز بالینی و آسیبشناختی زوال عقل انسانی را در بر نمیگیرند. مشخص نیست آیا تومورهای انسانی سیستاتین‑C کافی تولید میکنند یا مکانیک سد خونی‑مغزی در انسان همان انتقال مشاهدهشده در موشها را اجازه میدهد یا خیر. مطالعات وسیع انسانی و کارآزماییهای بالینی طراحیشده با دقت لازم است قبل از اینکه هر درمان مبتنی بر سیستاتین‑C مطرح شود.

کشف جدید افقهای جذابی برای درمانهای آلزایمر میگشاید.
نکته تخصصی
«این کار به ما پیوند مولکولی ملموسی بین دو بیماری میدهد که مدتها در دادههای جمعیتی بهصورت متقابل مشاهده شدهاند»، میگوید دکتر ماریا لانگفورد، ایمونولوژیست عصبی در موسسه تحقیقات مغز البیون. «آن پیوند—درگیرشدن سیستاتین‑C با Trem2 میکروگلیا—یک هدف واقعبینانه فراهم میکند. چالش اکنون تبدیل یک پدیده هدایتشده توسط تومور به درمانی ایمن و کنترلشده است که پاکسازی را افزایش دهد بدون اینکه التهاب مضر را برانگیزد.»
دکتر لانگفورد بر احتیاط تأکید میکند. «مدلهای موشی برای آشکارسازی مکانیزم ضروریاند، اما زیستشناسی انسان پیچیدهتر است. ما به نشانگرهای زیستی (بیومارکرها) نیاز داریم که بگویند چه زمانی میکروگلیا در حال پاکسازی مفید است و چه زمانی دارد آسیب جانبی ایجاد میکند. این دقت تعیین خواهد کرد که آیا این رویکرد عملیاتی است یا خیر.»
زمینه گستردهتر و گامهای بعدی
این مطالعه با پذیرش فزایندهای همجهت است که سلامت سیستمیک بر نورو-دژنراسیون تأثیر میگذارد. جریان خون صرفاً مجرایی برای مواد مغذی و هورمونها نیست؛ بلکه پیامهایی از دستگاه ایمنی، میکروبیوم روده، اندامهای متابولیک و، همانطور که این کار نشان میدهد، تومورها را حمل میکند. درمانهایی که عوامل سیستمیک—خواه پروتئینها، لیپیدها یا تعدیلکنندههای ایمنی—را دستکاری میکنند ممکن است رویکردهای تکمیلی به استراتژیهایی باشند که مستقیماً آمیلوئید را هدف میگیرند.
محققان اکنون باید به چند پرسش پاسخ دهند: آیا افراد مبتلا به انواع مشخص تومور تغییرات قابلاندازهگیری در سیستاتین‑C مایع مغزی-نخاعی نشان میدهند؟ آیا فرمهای مهندسیشده سیستاتین‑C میتوانند بهطور ایمن از سد خونی‑مغزی انسان عبور کنند؟ بازه دوزی که از overstimulation میکروگلیا جلوگیری میکند کدام است؟ اینها سؤالهای قابل حلاند اما نیازمند مطالعات تدریجی و دقیق در محیطهای بالینی هستند.
برای بیماران و مراقبان امروز، نتیجه این تحقیق درمان نیست، بلکه یادآوری این نکته است که زیستشناسی میتواند ارتباطات شگفتانگیزی پنهان کند. پروتئینی که به بقای تومور کمک میکند ممکن است به مغز در پاکسازی پروتئینهای سمی نیز یاری برساند. دانشمندان در حال یادگیری خواندن این سیگنالهای بین-اندامی هستند و، با کمی شانس، بازمهندسی آنها بدون وارد کردن بیماری.
چه سیستاتین‑C به هدف دارویی تبدیل شود، چه بهعنوان یک بیومارکر یا یک اهرم مفهومی برای ایمنوتراپیهای جدید استفاده شود، این مطالعه پژوهش را به سوی نقشهای غنیتر از نحوه گفتوگوی اندامها با یکدیگر هدایت میکند—و نشان میدهد فهم این گفتگوها چگونه میتواند از مغز در حال پیری محافظت کند.
منبع: sciencealert
نظرات
پمپزون
عجب، طبیعت همیشه غافلگیر میکنه. اگر سیستاتین C قابل مهندسی باشه باید با احتیاط و بر اساس بیومارکرها پیش برن
داNیک
خیلی هیجانانگیز ولی یه خورده اغراق داره، انتقال از موش به انسانه کل ماجرا. امیدوارم جلوتر حسابی آزمون کنن
سینا
تو کارم دیدهم که یه چیزای عجیب سیستمیک رو تغییر میده، ولی از سرطان انتظار 'خوبی' ندارم؛ باید مواظب باشن، خیلی پیچیدهست
دیتاپالس
این فقط تو موشها بود؟ آیا سد خونی-مغزی آدم هم همینطوره؟ شواهد انسانی کجاست، کی جواب میده؟
لابکور
وای، جدی؟! یعنی سرطان ممکنه یه مولکول داشته باشه که آلزایمر رو کند کنه... فکر نکنم این همه ساده باشه، اما کنجکاوم


ارسال نظر