8 دقیقه
تصور کنید یک سرباز خط مقدم که هنگام اسارت ترجیح میدهد یک نارنجک قورت دهد تا موقعیت دشمن را فاش نکند. این تشبیه تا حدودی تصویر انتخاب شدید برخی سلولهای ایمنی در مغز را هنگام مواجهه با انگل توکسوپلاسما گوندی نشان میدهد: این سلولها مرگ خود را فعال میکنند تا مانع از آن شوند که مهاجم از آنها بهعنوان وسیلهای برای گسترش استفاده کند.
سلولهای T — بهویژه زیرگروه CD8+ — عمدتاً بهخاطر شکار سلولهای آلوده و فراخواندن تقویتکنندههای ایمنی شناخته میشوند. اما پژوهشگران دانشگاه ویرجینیا یک تاکتیک دفاعی شدیدتر را کشف کردهاند. زمانی که این سلولهای T توسط T. gondii آلوده میشوند، میتوانند مرگ برنامهریزیشدهٔ سلولی را آغاز کنند؛ حرکتی که مخفیگاه انگل را از بین میبرد و جلوی گسترش بیشتر در بافت عصبی را میگیرد.
چگونه یک سوئیچ مولکولی فداکاری قاطع را تحمیل میکند
در قلب این پاسخ خودفروخته یک آنزیم به نام کاسپاز-8 قرار دارد. دانشمندان پیشتر کاسپاز-8 را به مسیرهای مرگ سلولی مرتبط کرده بودند، اما نقش ویژهٔ آن داخل سلولهای CD8+ در مواجهه با T. gondii تا کنون روشن نشده بود. تیم تحقیقاتی از موشهای مهندسیشدهٔ ژنتیکی استفاده کرد تا کاسپاز-8 را از جمعیتهای سلولی هدف حذف کند. نتیجه واضح بود: وقتی سلولهای CD8+ فاقد کاسپاز-8 بودند، انگل بهعرضهگی بیشتری وارد بافت مغز شد، حتی با وجود فعالیت ایمنی نسبتاً قوی در سایر جنبهها.
این یافته به منطق ساده اما قدرتمندی اشاره دارد. توکسوپلاسما با زیستن داخل سلول میزبان بقا مییابد. اگر سلول حامل قبل از تکمیل چرخهٔ زندگی انگل بمیرد، پاتوژن جایگاه خود را از دست میدهد. کاسپاز-8 مانند یک دکمهٔ خودانهدامی مولکولی عمل میکند که وقتی آلودگی در سلول T شناسایی میشود فعال میشود. بدون این دکمه، انگل گاهی اوقات «سوارِ» وسیله میشود — مانند یک اسب تروآ — و عمیقتر وارد سیستم عصبی مرکزی میگردد.
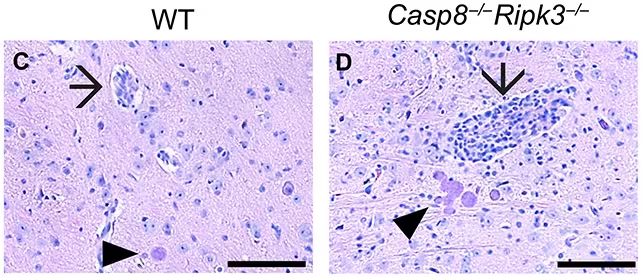
چهار هفته پس از عفونت، موشهای فاقد کاسپاز-8 (راست) سطوح بالاتری از التهاب را نسبت به حیوانات دارای کاسپاز-8 (چپ) نشان دادند. فلشها رگهای خونی ملتهب را نشان میدهند و مثلثهای کوچک کستهای T. gondii را علامتگذاری کردهاند. (Sibley et al., Sci. Adv., 2025)
طراحی آزمایش و آنچه موشها نشان دادند
محققان گروههای مختلف موش را که بهصورت مهندسیشده در سلولهای گوناگون فاقد کاسپاز-8 بودند، در مقابل حیوانات کنترل با عملکرد طبیعی کاسپاز-8 مقایسه کردند. در تمام این آزمونها، T. gondii بهطور قابلتوجهی بیشتر وارد مغز شد و کست تشکیل داد، زمانیکه سلولهای CD8+ قادر به اجرای برنامهٔ مرگ وابسته به کاسپاز-8 نبودند. بهگونهای حیاتی، نشانگرهای التهابی و سایر پاسخهای ایمنی در آن حیوانات قوی باقی ماندند؛ این مسئله تأکید میکند که از دسترفتن محافظت، ناشی از ضعف سیستم ایمنی کلی نیست بلکه به علت فقدان این تاکتیک دفاعی خاص است.
چرا این موضوع فراتر از یک نکتهٔ کنجکاوانهٔ ایمونولوژیک اهمیت دارد؟ زیرا پاتوژنهایی که بهطور مداوم داخل سلولها زندگی میکنند باید یا مسیرهای مرگ سلولی میزبان را تحمل کنند یا آنها را دور بزنند. محققان پیشنهاد میکنند که تنها میکروبهایی که میتوانند با کاسپاز-8 تداخل کنند — با مسدود کردن فعالسازی آن یا اثرات پس از آن — میتوانند از سلولهای CD8+ بهعنوان وسایل نقلیه بهرهبرداری کنند. این احتمال میتواند توضیح دهد چرا T. gondii بهندرت این شگرد را امتحان میکند: در اغلب موارد، فداکاری سلول T پیروز میشود.
T. gondii بیشتر حیوانات خونگرم را آلوده میکند و میتواند سالها بهطور خاموش در مغز انسانها پایدار بماند. برآوردها نشان میدهد که دهها میلیون نفر در ایالات متحده بهصورت بدونعلائم حامل این انگل هستند. برای افراد سالم این وضعیت اغلب بیماری قابلتوجهی ایجاد نمیکند، اما در افراد باردار و بیماران دارای نقص سیستم ایمنی خطرات جدیتری وجود دارد: توکسوپلاسموز میتواند به عوارض شدید منجر شود، از جمله آسیب به جنین یا عفونت تهدیدکنندهٔ زندگی در کسانی که دفاع ایمنیشان تضعیف شده است.
تبعات برای درمانها و علم ایمنی
ترجمهٔ این کشف به درمانها نیازمند احتیاط است. نتایج کنونی پیشبالینی و مبتنی بر مدلهای موشی است؛ زیستشناسی ایمنی انسان تفاوتهای مهمی دارد که باید بررسی شوند. با این حال، شناسایی کاسپاز-8 بهعنوان نقطهٔ محوری کنترل توسط سلولهای T راههای متعددی را باز میکند: تشخیص بهتر عفونتهای نهفتهٔ مغزی، راهبردهایی برای محافظت از بیماران آسیبپذیر، و حتی داروهای هدفمند که بتوانند رفتار خودمحدودکنندهٔ سلولهای آلوده را تقلید یا تقویت کنند.
این پژوهش همچنین درک ما از عملکرد سلولهای CD8+ را فراتر از کشتار سیتوتوکسیک و سیگنالدهی سایتوکاینی عمیقتر میکند. این یادآور میشود که ایمنی تنها دربارهٔ حذف مهاجمان نیست بلکه دربارهٔ محروم کردن آنها از فرصتها نیز هست. گاهی مؤثرترین دفاع، تصمیمی بیرحم اما منطقی برای سوختن پل پشت شماست.
بهعلاوه، این کار نور جدیدی بر مفهوم «مشروعیت بافت ایمنی» و چگونگی تعامل سلولهای ایمنی با بافتهای دارای مصونیت نسبی مانند مغز میاندازد. مغز بهعلت سد خونی-مغزی و محیط کوچک تری از ماکروفاژها و سلولهای ایمنی تخصصی، حساسیت ویژهای نسبت به التهاب دارد؛ بنابراین راهکارهای محدودکنندهٔ آسیب که در عین حال کنترل پاتوژن را فراهم کنند اهمیت بالایی دارند. عملکرد کاسپاز-8 در سلولهای CD8+ ممکن است نمونهای از این راهکارهای تطبیقی باشد که تعادل بین محافظت و حفظ بافت را برقرار میکند.
از منظر مولکولی، کاسپاز-8 افزون بر نقش در آپوپتوز، شبکهٔ پیچیدهای با مسیرهایی مانند نکروپتوز و فعالسازی اینفلاماسوم دارد. در بسیاری از شرایط، کاسپاز-8 بهعنوان یک نقطهٔ تصمیمگیرنده عمل میکند: فعالسازی آن میتواند مسیر آپوپتوز را پیش ببرد و در غیر این صورت برخی مسیرهای التهابی دیگر فعال شوند. بررسی این تلاقیها در زمینهٔ آلودگی توسط T. gondii میتواند سرنخهایی دربارهٔ اینکه چگونه سلول میزبان مرگ برنامهریزیشده را به گونهای اجرا میکند که کمترین آسیب را به بافت عصبی وارد کند، فراهم آورد.
بنابراین از منظر بالینی، دو رویکرد بالقوه دیده میشود: یا باید مکانیزمهای درونسلولی را تشویق کنیم تا در مواجهه با آلودگی تصمیم به مرگ بگیرند و از گسترش جلوگیری کنند، یا باید مکانیزمی بیابیم که مانع از دستکاری کاسپاز-8 توسط پاتوژنها شود. هر دو راه مستلزم توازن دقیقی هستند زیرا افزایش بیضابطهٔ مرگ سلولی در مغز میتواند خود موجب اختلال عملکرد عصبی شود.
در نهایت، این یافته به توسعهٔ ابزارهای تشخیصی نیز کمک میکند. نشانگرهای فعالشدن کاسپاز-8 در سلولهای T یا الگوی مولکولی مرتبط با مرگ برنامهریزیشده ممکن است بهعنوان بیومارکرهایی برای شناسایی عفونتهای نهفتهٔ مغزی عمل کنند؛ چیزی که در تشخیص توکسوپلاسموز نهفته میتواند بسیار باارزش باشد، خصوصاً در بیماران با خطر بالا مانند افراد ایمنکاهشیافته یا زنان باردار.
دیدگاه کارشناسان
«این کشف چارچوب تفکر ما را دربارهٔ پاتوژنهای داخلسلولی و معاوضههای ایمنی بازتعریف میکند،» دکتر لنا اورتیز، ایمونولوژیستی که در این مطالعه دخیل نبوده است، میگوید. «مرگ واسطهشده توسط کاسپاز-8 در سلولهای CD8+ یک استراتژی محصورسازی ساده اما مؤثر است. گام بعدی نقشهبرداری از چگونگی عملکرد پاتوژنهایی است که از این مکانیزم فرار میکنند — آن دانش به سوی درمانهایی هدایت خواهد کرد که یا تصمیم سلول به مردن را تقویت میکنند یا مانع از بهزیان انداختن این فرایند توسط پاتوژنها میشوند.»
این مطالعه توضیح مکانیکی معقولی برای چرایی اینکه چرا اکثر عفونتهای T. gondii در افراد سالم خاموش میمانند ارائه میدهد: هنگامی که سلولهای ایمنی نفوذ را تشخیص میدهند، گاهی حاضرند خود را قربانی کنند تا از تاسیس انگل درون سلولی جلوگیری کنند. اگر تحقیقات آتی مکانیزمهای مشابهی را در انسان تأیید کنند، پزشکان میتوانند روزی از این دانش برای حفاظت از آسیبپذیرترین بیماران و طراحی مداخلاتی استفاده کنند که با کنترل عفونتهای مزمن، بافت حساس مغز را نیز حفظ نمایند.
با وجود وعدههای بالقوه، محدودیتهای قابل توجهی وجود دارد که باید توجه شوند: اختلافات بین اجزای ایمنی موش و انسان، پیچیدگی مسیرهای التهابی در مغز، و خطر تشدید آسیب بافتی در صورت مداخلهٔ نامناسب. بنابراین نیاز به مطالعات تکمیلی در مدلهای انسانی و آزمایشهای بالینی محتاطانه آشکار است.
در پایان، این پژوهش یک بار دیگر بر اهمیت مطالعهٔ تعاملات دقیق بین میزبان و پاتوژن تأکید میکند. فهم این تعاملات نهتنها برای کشف نحوهٔ کنترل عفونتهای درونسلولی مانند توکسوپلاسما ضروری است، بلکه برای طراحی راهبردهای درمانی هوشمندی که هم ایمنی و هم بقا و عملکرد بافت را تأمین کنند، حیاتی است. مطالعهٔ بیشتر دربارهٔ کاسپاز-8، مسیرهای مرگ سلولی و راههای فرار پاتوژن میتواند زمینهساز نوآوریهای درمانی در مدیریت عفونتهای مزمن مغزی و محافظت از بیماران پرخطر گردد.
منبع: sciencealert
نظرات
مکس_ای
معقوله، ایدهٔ جالبیه ولی کلی کار آزمایشگاهی مونده. امیدوارم تبدیل به درمان نشه که آسیب بزنه.
کوینپایل
به نظرم کمی اغراق داره؛ مدل موشی هست و هر مداخلهای روی مرگ سلولی تو مغز خطرناکه، باید با احتیاط جلو رفت.
آسمانچرخ
توازن بین کشتن پاتوژن و حفظ بافت خیلی ظریفه، مطالعه منطقی و متقاعدکننده بنظر میاد، منتظر دادههای انسانی هستم.
مهدی
تو بیمارستان دیدم عفونتای نهفته چقدر خطرناک میشن، اگه بشه این مکانیزم رو تقویت کرد مفیده، اما خطر التهاب مغزی رو هم باید حساب کرد.
بیوانیکس
آیا توی انسان هم همین نقش کاسپاز-8 هست؟ آیا نتایج موش به انسان تعمیم پیدا میکنه یا نه؟ 🤔
رودایکس
واو، فکر نمیکردم سلولها اینقد بیرحم واکنش بدن! تصویر نارنجک واقعیه، ولی نگرانم که قضاوتمون اشتباه باشه...

ارسال نظر