10 دقیقه
تصور کنید یک قلب مینیاتوری که نه تنها به خودی خود میتپد، بلکه بهصورت دقیق میگوید هر سلول چه کاری انجام میدهد. این همان وعدهٔ جدیدترین پلتفرم «قلب روی تراشه» (HOC) است که یک تیم تحقیقاتی کانادایی توسعه دادهاند: یک بافت قلبی سهبعدی مهندسیشده که اندازهگیری نیروی کلی را با حسگرهای میکروسکوپی جاسازیشده در داخل بافت ترکیب میکند تا سلولهای عضلانی در حین کار قابلمشاهده باشند. چنین فناوریهایی در حوزهٔ مهندسی بافت، مدلسازی بیماریهای قلبی و داروسازی پیشبالینی نوآوری ایجاد میکنند و نشاندهندهٔ پیشرفت در آزمایشهای قلبی-عروقی و پزشکی شخصی (پزشکی دقیق) هستند.
برای دههها، قلبشناسی با همان مشکل بنیادی روبهرو بوده است: شما نمیتوانید با اطمینان کامل آزمون کنید که یک قلب انسانی واقعی به یک داروی جدید یا یک بیماری چگونه پاسخ خواهد داد بدون آنکه خطراتی برای بیمار وجود داشته باشد. مدلهای حیوانی و کشتهای سلولی ساده مفیدند اما مکانیک پیچیدهٔ انقباض عضلهٔ قلب را بهطور کامل بازتولید نمیکنند. این دستگاه جدید فاصلهٔ بین مدلهای ساده و نمونهٔ انسانی را پر میکند و با تلفیق دو سیستم اندازهگیری مکمل — ستونیهای بزرگ که با هر ضربان خم میشوند و قطرههای هیدروژلی کوچکی که تنشهای محلی را اندازه میگیرند — اطلاعات در مقیاسهای گوناگون فراهم میکند.
چگونه قلب دوحسی ساخته میشود
نقطهٔ شروع ساده است اما دقیق: سلولهای بنیادی یا سلولهای قلبی استخراجشده از حیوانات را در یک ژل غنی از پروتئین معلق میکنند و اجازه میدهند که خود را سازماندهی کرده و به توالی منسجم بافت عضلانی تبدیل شوند. در مطالعهٔ یادشده، محققان از کاردیومیوسیتهای موش صحرایی و سلولهای پیوندی استفاده کردند که در یک ژل شبیه ماتریکس خارج سلولی پشتیبان جاسازی شده بودند و سپس این مخلوط را روی یک تراشهٔ سیلیکونی کشت دادند. بافت بهصورت خودسامان یک نوار ضرباندار تشکیل داد که بین دو ستون انعطافپذیر آویزان بود. هر انقباض باعث انحراف ستونها میشود؛ میزان و زمان این انحراف نشاندهندهٔ قدرت انقباضی کل بافت و الگوی ریتم آن است. اندازهگیری نیروی انقباضی کل (bulk force sensing) برای سنجش عملکرد کلی مدل قلبی حیاتی است و دادههای مقیاس اندیکاسیون را فراهم میکند.
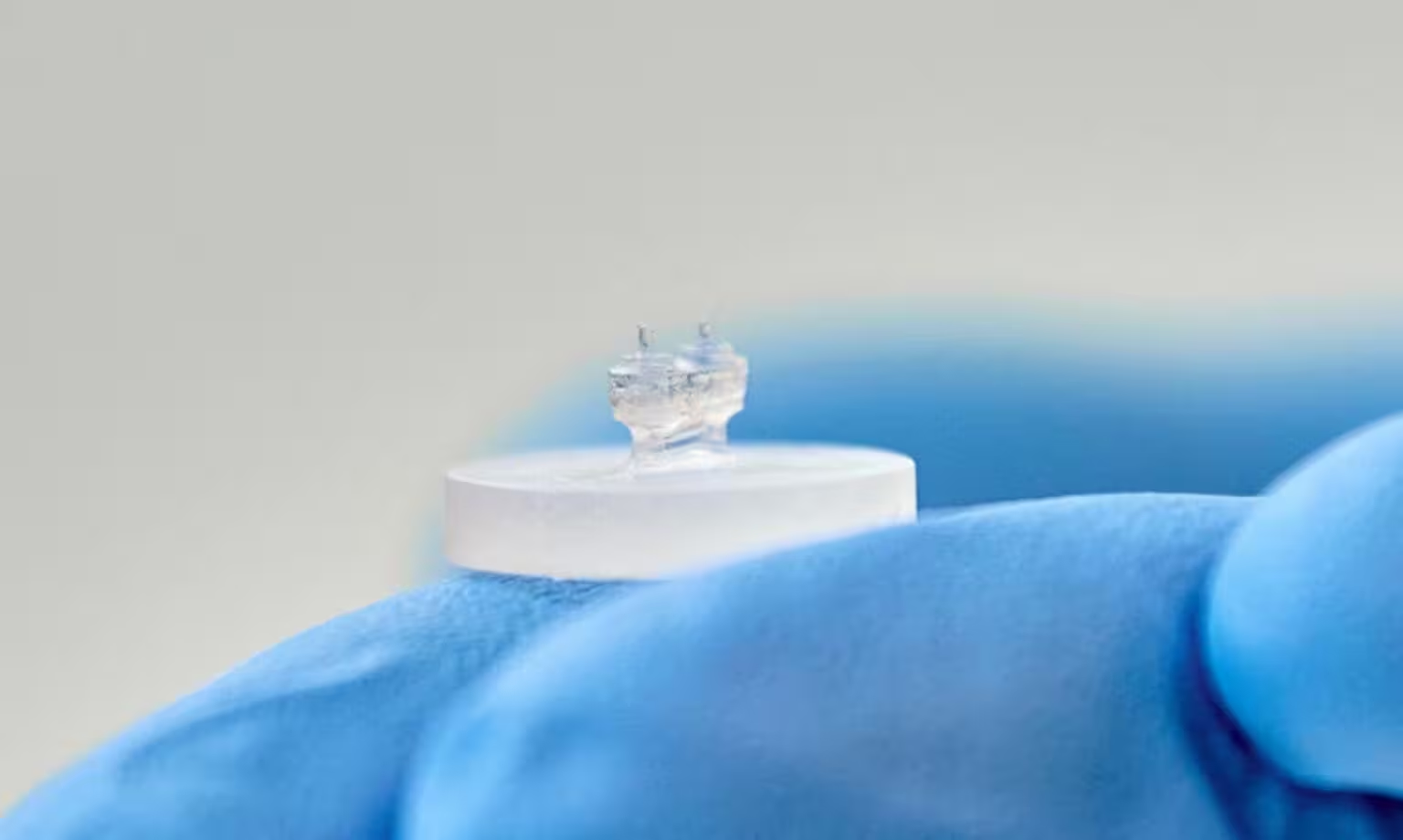
نوآوری اصلی اما در لایهٔ میکرو-حسگرها قرار دارد. قطرههای ریز هیدروژلی، در حدود 50 میکرومتر قطر، در داخل بافت پراکنده میشوند. این قطرهها تحت تأثیر نیروهای بسیار کوچک و محلی قرار میگیرند که توسط هر کاردیومیوسیت و سلولهای اطراف آن تولید میشود و تغییر شکل میدهند. با دنبالکردن شکل و حرکت قطرهها، تیم میتواند تنشهای مکانیکی در سطح سلولی را استنتاج کند—چیزهایی که در پلتفرمهای رایج قلب-روی-تراشه قابلدیدن نیستند. این رویکرد ترکیبی، امکان همزمان مطالعهٔ نیروهای کل بافت و الگوهای نیروی محلی را فراهم میکند که برای درک بیماریهای قلبی و ارزیابی داروها بسیار ارزشمند است.
حسگرهایی که مقیاسها را به هم پیوند میدهند
سیستم ستونها به سؤال بزرگ پاسخ میدهد: «عضلهٔ مهندسیشدهٔ قلب چقدر قوی میتپد؟» قطرههای میکرو اما به سؤال ظریفتری پاسخ میدهند: «کدام سلولها دچار نقص شدهاند و این نقص در کجا قرار دارد؟» این تفاوت اهمیت دارد. بسیاری از بیماریهای قلبی-عروقی از سطح تکسلولی آغاز میشوند—اختلال در توانایی انقباضی، انتقال نیروی نادرست یا مکانیسمهای ترمیمی معیوب—که مدتها قبل از اینکه عملکرد کل بافت فرو بریزد ظهور میکنند. خوانش دوگانه (dual readout) به پژوهشگران هم نمای کلی (کل بافت) و هم جزئیات سلولی (سطح سلولی) را ارائه میدهد و بدینترتیب هم «جنگل» و هم «درختان» را نشان میدهد.
این رویکرد دوحسی به ویژه در مطالعهٔ همگنی و ناهمگنی سلولی (cellular heterogeneity) اهمیت دارد؛ در بافتهای قلبی، سلولها ممکن است بسته به موقعیت، پاسخهای مکانیکی و الکتریکی متفاوتی نشان دهند. قطرههای هیدروژلی میتوانند نقشههای فضایی از توزیع نیروها ایجاد کنند و مشخص کنند نقاطی از بافت که تحت فشار بیشازحد یا کاهش نیرو هستند، کجا قرار دارند. این دادهها برای تحلیلهای سازهای-عملکردی (structure–function analyses)، مدلسازی عددی (computational modeling) و طراحی درمانهای هدفمند حیاتیاند.
داروشناسی، پاتولوژیها و استراتژیهای دقیق
اثبات مفهوم زمانی حاصل شد که تیم تراشههای خود را در معرض دو ترکیب شناختهشده قرار داد. نوراپینفرین، محرک آدرنرژیک، همانطور که پیشبینی میشد نیروی انقباضی را افزایش داد و ریتم را تندتر کرد. بلبیستاتین، مهارکنندهٔ میوزین، انقباضات را کاهش داد. منحنیهای پاسخ با انتظارات فیزیولوژیک مطابق بودند که نشان میدهد این تراشهها میتوانند بهعنوان پلتفرمهای پیشبالینی قابلاعتماد برای غربالگری اثرات دارو بر انقباض و ریسک آریتمیزایی بهکار روند. این موضوع اهمیت زیادی در توسعهٔ دارو دارد، زیرا توانایی تشخیص اثرات نامطلوب روی عملکرد مکانیکی قلب میتواند از بروز عوارض در فازهای بالینی جلوگیری کند.

چرا این مفید است؟ زیرا پلتفرمهای آزمایشگاهی که بهدقت هم مکانیک در سطح بافت و هم ناهمگنی سلولی را بازتولید میکنند میتوانند فرایند کشف دارو را تسریع کرده و تستها را ایمنتر کنند. بهجای تجویز یک ترکیب آزموننشده به یک بیمار که احتمال دارد قلبش واکنش نامطلوب نشان دهد، در آینده پزشکان میتوانند ابتدا داروها را روی سلولهای خودِ بیمار که در قالب یک تکهٔ کوچک و تپندهٔ بافت رشد کردهاند، صفحهآرایی کرده و اثرات را مشاهده کنند. این مفهوم «داروشناسی شخصی» یا پزشکی دقیق را تقویت میکند و میزان آزمونوخطا بالینی را کاهش میدهد.
تیم تحقیقاتی برنامه دارد گام بعدی را با ساخت تراشههای قلبی از سلولهای برداشتشده از بیماران با شرایط قلبی خاص، مانند کاردیومیوپاتی اتساعی و آریتمیهای ژنتیکی بردارد. این مدلهای اختصاصی بیمار به پژوهشگران امکان میدهد پیشرفت بیماری را مدلسازی کنند و تست کنند کدام درمانها در بازگرداندن مکانیک طبیعی در زمینهٔ خاص هر بیمار مؤثرند. چنین رویکردی میتواند مسیرِ ارزیابی پاسخدرمانی مبتنی بر بیمار را هموار سازد و درمانهای هدفمندتر و ایمنتری را پیشنهاد دهد.
در زمینهٔ توسعهٔ دارو و علوم ترجمهای، این پلتفرمها میتوانند به عنوان فیلترهایی عمل کنند که تعداد نامزدهای دارویی را قبل از ورود به مطالعات حیوانی و بالینی کاهش دهند. بهعلاوه، دادههای کمّی نیرویی و نقشههای فضایی نیروی سلولی میتوانند ورودیهای ارزشمندی برای مدلهای کامپیوتری چندمقیاسی (multi-scale computational models) باشند که هدفشان پیشبینی رفتار قلب انسانی در شرایط متفاوت است.
بینش کارشناسی
«مشاهدهٔ مکانیک سلولی درون یک بافت در حال انقباض در زمان واقعی، بازی را تغییر میدهد»، میگوید علی موسوی، مهندس زیستپزشکی و نویسندهٔ اول مطالعه. «مسأله تنها این نیست که آیا بافت میتپد؛ بلکه این است که نیرو چگونه و کجا تولید و از دست میرود.» این دیدگاه نشان میدهد که دادههای مکانیکی در مقیاس سلولی میتواند سرنخهایی دربارهٔ علتهای اولیهٔ نارساییهای مکانیکی فراهم کند که در غیر این صورت با آزمونهای معمولی مشاهده نمیشوند.
هومن ساوجی، نویسندهٔ ارشد و مهندس زیستپزشکی، چشمانداز وسیعتری را مطرح میکند: «این طراحی دوحسی ما را به سلامت دقیق نزدیکتر میکند. در آینده، ممکن است پزشکان پس از مشاهدهٔ واکنش بافت قلب خودِ بیمار روی تراشه، یک دارو را انتخاب کنند — پیش از آنکه بیمار آن دارو را دریافت کند.» این چشمانداز با روندهای فعلی در پزشکی شخصی و مدلسازی بیماری همخوانی دارد و میتواند تصمیمگیری بالینی را مبتنی بر دادههای عملکردی اختصاصیتر کند.
با این حال، این دستگاهها یکشبه جایگزین آزمایشهای بالینی یا مطالعات حیوانی نخواهند شد. آنها ابزارهای تکمیلی قدرتمندی هستند: سریعتر، ارزانتر و از نظر اخلاقی سادهتر از بسیاری از جایگزینها و در عین حال اطلاعات بیشتری نسبت به آزمونهای تکسلولی منفرد ارائه میدهند. توانایی نقشهبرداری از ناهنجاریهای مکانیکی با وضوح سلولی مسیرهای جدیدی را برای فهم فرایندهای التیام زخم در میوکارد، چگونگی بازسازی بافت تحت فشار و دلایل پاسخندادن بعضی بیماران به درمانهای مشخص باز میکند.
سؤالاتی باقی است؛ آیا بافتهای مشتقشده از انسان همان خروجیهای قطرهای را که در سلولهای موش صحرایی دیده شده بازتولید میکنند؟ آیا تصویربرداری از میکروسنسورها را میتوان برای غربالگریهای با توان بالا (high-throughput) مقیاسبندی کرد بدون آنکه حساسیت پایین بیاید؟ مهندسان و زیستشناسان هماکنون در حال بهینهسازی مواد، شیمی حسگرها و خطوط پردازش تصویری برای پاسخ دادن به این پرسشها هستند. علاوه بر آن، استانداردسازی پروتکلها و اعتبارسنجیهای بینمرکزی برای کاربردهای پیشبالینی و تنظیمی ضروری خواهد بود.
بهطور خلاصه: قلب روی تراشه با قطرههای هیدروژلی جاسازیشده پنجرهای به مکانیک زندگی باز میکند. این سیستم کوچک است اما صدای بلندی دارد — و ما در حال یادگیری شنیدن آن هستیم. در زمینههای تحقیق و توسعهٔ دارو، مدلسازی بیماری، و پزشکی شخصی، «قلب روی تراشه» همراه با حسگرهای میکرو میتواند نقشی محوری در افزایش دقت، کاهش ریسک و تسریع فرایندهای علمی ایفا کند.
کلیدهای موفقیت آتی شامل موارد زیر هستند:
- تضمین سازگاری نتایج بین گونهها و بین نمونههای انسانی و حیوانی.
- بهینهسازی مواد هیدروژلی و شیمی حسگر برای افزایش حساسیت و پایداری در طول زمان.
- توسعهٔ ابزارهای تحلیلی و الگوریتمهای بینایی ماشینی برای استخراج خودکار و نرخ-بالا از دادههای قطرهها و ستونها.
- یکپارچهسازی دادههای مکانیکی با مشخصات الکتروفیزیولوژیک و مولکولی برای تحلیلهای چند-لایه و بهبود قابلیت پیشبینی بالینی.
با رشد پیوستهٔ فناوریهای مهندسی بافت، تصویربرداری پیشرفته و الگوریتمهای یادگیری ماشین، انتظار میرود که کارایی و کاربردهای قلب-روی-تراشهها برای پژوهشهای قلبی-عروقی و داروسازی روزبهروز افزایش یابد. همچنین، این پلتفرمها میتوانند به تمرکز بر توسعهٔ درمانهای هدفمند و کاهش هزینهها و زمان توسعهٔ داروها کمک کنند، که در نهایت منافع قابلتوجهی برای بیماران و سیستمهای بهداشتی خواهد داشت.
منبع: sciencealert
نظرات
نور_ف
رویکرد دوحسی خوبه، هم کلیت رو میبینی هم سطح سلولی. ترکیب با دادههای الکتروفیزیولوژیک هم بیاد فوقالعاده میشه، اما کلی کار مونده
تکدنده
هیجانانگیزه ولی به نظر یه مقدار پرفورمِنسمحور شده؛ قبل از پیادهسازی پزشکی شخصی باید تکرارپذیری، اعتبار بینمرکزی و حساسیت رو ثابت کنن، امیدوارم زود قضاوت نکنیم
شهررو
تو لاب ما هم چیزایی شبیه دیدم ولی هیدروژل و حسگرها دوام نداشتن، اونا چطور پایداری رو حل کردن؟ یه نکته عملی میخوام سریع
آرمین
آیا بافتهای انسانی هم همین خروجیها رو میدن یا موش فریبندهست؟ تصویربرداری برای high-throughput چطور قراره انجام بشه؟ 🤔
سکهران
معقول بنظر میاد، مخصوصا برای فاز پیشبالینی. البته استانداردسازی لازمه
زیستنو
وای، یه قلب مینیاتوری که تکتک سلولارو میتونه رصد کنه؟ جذابه... اگر روی نمونههای انسانی هم همینقدر دقیق باشه، انقلابیه، ولی امیدوارم ضعفای عملی هم گفته بشن

ارسال نظر