10 دقیقه
خلاصهٔ کشف: گیرندهٔ پنهانی که قدرت استخوان را کنترل میکند
پژوهشگران دانشگاه لیپزیگ گیرندهای را شناسایی کردهاند که پیشتر کمتر مورد توجه قرار گرفته بود — GPR133 — و بهعنوان یک «کلید مولکولی استخوان» عمل میکند که استحکام اسکلتی را تنظیم میکند. در مطالعات آزمایشگاهی روی موشها، فعالسازی GPR133 با یک مولکول کوچک جدید به نام AP503 باعث افزایش تراکم استخوان و بازگرداندن تغییراتی شد که شبیه به پوکی استخوان هستند. این کار نشاندهندهٔ یک هدف زیستی جدید برای درمانهایی است که میتوانند هم از استخوان محافظت کنند و هم آن را بازسازی نمایند، امری که با پیر شدن جمعیتها نیاز شدیدی به آن وجود دارد.
چرا درمانهای جدید برای پوکی استخوان ضروریاند
پوکی استخوان یک بیماری مزمن است که با از دست رفتن پیشروندهٔ تودهٔ استخوانی و تخریب میکروساختار استخوان مشخص میشود و خطر شکستگی را افزایش میدهد. تنها در آلمان حدود شش میلیون نفر به این مشکل مبتلا هستند که عمدتاً زنان، بهویژه پس از یائسگی، در میان آنها قرار دارند. درمانهای فعلی — مانند بایسفسفوناتها، دنوزوماب یا عوامل آنابولیکی مانند تریپاراتید و روموسوزوماب — میتوانند خطر شکستگی را کاهش دهند اما محدودیتهایی دارند، از جمله عوارض جانبی، مدت زمان محدود مصرف و بازیابی ناقص کیفیت استخوان. نیاز فوری به راهکارهای ایمنتر و بلندمدت وجود دارد که هم از تحلیل استخوان جلوگیری کنند و هم یکپارچگی اسکلتی را بازسازی نمایند.
برای یافتن جایگزینهایی با مشخصات بهتر ایمنی و اثربخشی، دانشمندان در حال کشف اهداف مولکولی جدید در زیستشناسی استخوان هستند. یکی از اهداف امیدوارکننده GPR133 است، یک گیرندهٔ GPCR چسبنده (adhesion GPCR) که تا پیش از این در زمینهٔ بازسازی استخوان کمتر مطالعه شده بود.
مکانیسم: چگونه فعالسازی GPR133 ساختار استخوان را بازسازی میکند
GPR133 به گروهی از پروتئینهای غشایی تعلق دارد که «گیرندههای متصل به پروتئین جی چسبنده» نامیده میشوند. این مولکولها توسط نشانههای مکانیکی و تماسهای بین سلولی فعال میشوند و از طریق پروتئینهای جی پیامها را به داخل سلول منتقل میکنند. در بافت استخوان، فعالسازی GPR133 یک آبشاری از سیگنالها را راهاندازی میکند که فعالیت استئوبلاستها — سلولهای سازندهٔ استخوان — را افزایش میدهد و همزمان فعالیت استئوکلاستها — سلولهای مسئول بازجذب استخوان — را کاهش میدهد. با جابهجا کردن تعادل به سمت ساخت استخوان، سیگنالدهی GPR133 ساختار استخوان را تقویت و دوام آن را افزایش میدهد.
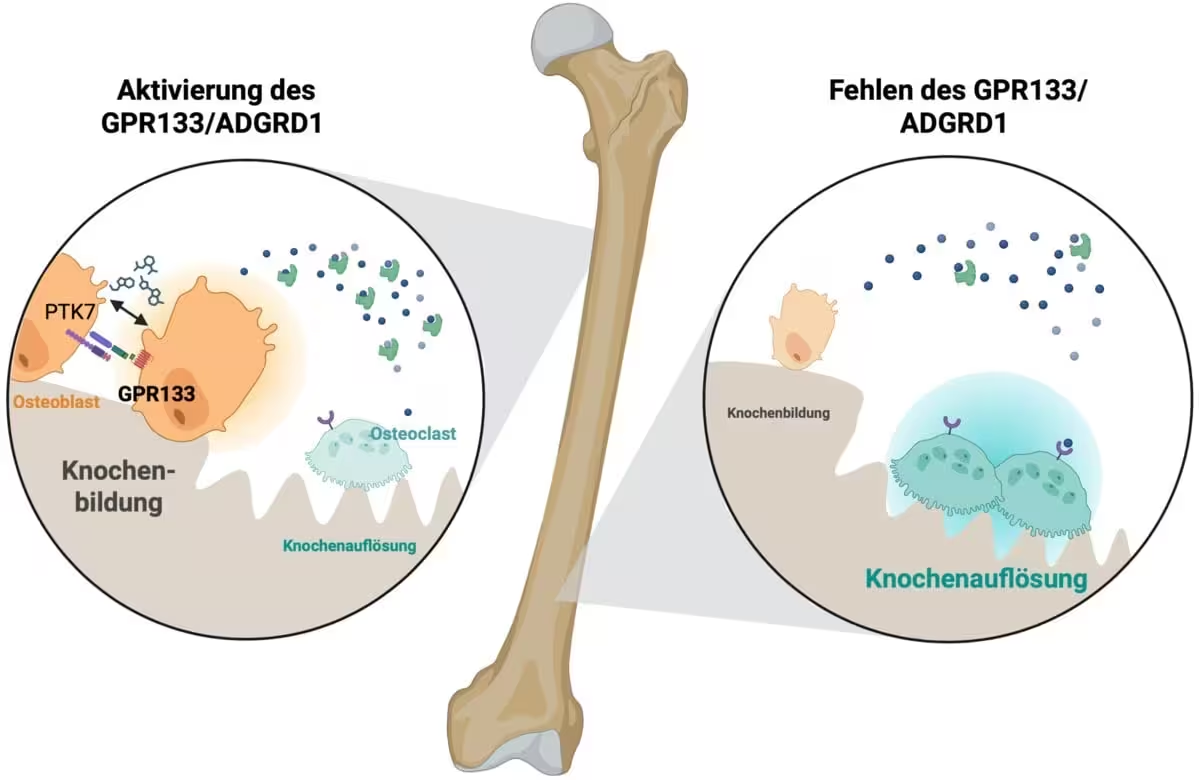
وقتی GPR133 در بافت استخوان فعال میشود، سیگنالی را راهاندازی میکند که سلولهای سازندهٔ استخوان (استئوبلاستها) را تحریک و سلولهای بازجذبکنندهٔ استخوان (استئوکلاستها) را مهار میکند. منبع: Biorender، Ines Liebscher
آزمایشهای آزمایشگاهی در مؤسسهٔ بیوشیمی رودولف شونهایمر نشان داد که نقص ژنتیکی در GPR133 در موشها باعث کاهش تراکم استخوان در اوایل زندگی میشود، پدیدهای که جنبههایی از پوکی استخوان انسانی را بازتاب میدهد. در مقابل، تحریک دارویی این گیرنده با استفاده از AP503 — که از طریق غربالگری محاسباتی شناسایی شد — رشد قابلتوجهی در جرم استخوان و بهبود خواص مکانیکی اسکلت را در مدلهای حیوانی سالم و مبتلا به پوکی استخوان به همراه داشت.
حالتهای فعالسازی: فشار مکانیکی و تعاملات سلولی
GPR133 نسبت به فشار مکانیکی و همچنین سیگنالهایی که از تعاملات مستقیم بین سلولهای استخوانی ناشی میشوند پاسخگو است. این حساسیت دوگانه نشان میدهد که گیرنده بهعنوان یک یکپارچهساز فیزیولوژیکی هم بار فیزیکی (تمرین، تحمل وزن) و هم سیگنالدهی بینسلولی محلی را دریافت کرده و این نشانهها را به پاسخهای آنابولیک (ساخت استخوان) تبدیل میکند.
یافتههای مطالعه و جزئیات تجربی
در مطالعهٔ لیپزیگ، محققان ترکیبی از ژنتیک مولکولی، زیستشناسی سلولی و داروشناسی در جانور را بهکار گرفتند. یافتههای کلیدی عبارتاند از:
- موشهایی که عملکرد GPR133 در آنها کاهش یافته بود، در سنین جوانی دچار کمتراکی استخوان شدند که نشان میدهد این گیرنده برای تجمع و نگهداری طبیعی استخوان لازم است.
- AP503، یک آگونیست مولکول کوچک که از طریق غربالگری محاسباتی با قابلیت پردازش بالا کشف شد، بهصورت انتخابی GPR133 را تحریک کرد و سیگنالدهی آنابولیک طبیعیاش را در استخوان بازتولید نمود.
- درمان با AP503 تراکم مواد معدنی استخوان را افزایش داد، میکرومعماری را بهبود بخشید و تغییرات شبیه به پوکی استخوان را در موشهای تحت درمان معکوس کرد.
این نتایج پیشبالینی از ایدهٔ هدفگیری GPR133 برای هر دو جنبهٔ جلوگیری از کاهش استخوان مربوط به سن و بازسازی فعال استخوانی که قبلاً از دست رفته بود، پشتیبانی میکنند. شایان ذکر است که کار پیشین همان گروه نشان داد AP503 همچنین عضلات اسکلتی را تقویت میکند و این احتمال را مطرح میسازد که مزایای همراستا برای سلامت عضلانی-اسکلتی وجود داشته باشد — ویژگیای مطلوب برای مداخلاتی که هدف آنها افراد مسن و ضعیف است.
پیامدهای بالینی و چالشهای توسعه
شناسایی GPR133 و AP503 مسیر ترجمهای را باز میکند اما چالشهای معمولی را نیز به همراه دارد:
- ایمنی و اختصاصیت: انتخابپذیری AP503 برای GPR133 و پروفایل اهداف خارج از هدف باید بهطور کامل مشخص شود. تعدیل بلندمدت سیگنالدهی GPCR نیازمند مطالعات سمیشناسی دقیق است.
- فارماکوکینتیک و روش تجویزی: ممکن است به بهینهسازی شیمیایی نیاز باشد تا قابلیت جذب خوراکی، پایداری متابولیک و دوزدهی مناسب برای انسان فراهم شود.
- اثربخشی در پستانداران بزرگتر و انسان: مدلهای موشی اطلاعات ارزشمندی میدهند اما دینامیک بازسازی استخوان در انسان را بهطور کامل بازنمیتابانند. مطالعات روی حیوانات بزرگتر و در نهایت کارآزماییهای بالینی مرحلهای برای ارزیابی کاهش خطر شکستگی و نتایج عملکردی لازم خواهند بود.
از آنجا که داروهای استاندارد فعلی بالفعل خطر شکستگی را کاهش میدهند، هر درمان جدید باید یا اثربخشی برتر، ایمنی بهتر برای مصرف بلندمدت یا مزایای منحصربهفردی مانند تقویت همزمان عضله را نشان دهد. پتانسیل جلوگیری از تحلیل استخوان و بازسازی همزمان آن، GPR133 را به هدفی بسیار جذاب برای توسعهٔ دارویی تبدیل کرده است.
زمینهٔ پژوهشی: یک دهه مطالعهٔ GPCR در لیپزیگ
دانشگاه لیپزیگ بیش از ده سال را به مطالعهٔ ساختاری و عملکردی گیرندههای GPCR چسبنده از طریق مرکز پژوهشی مشترک 1423 با عنوان «پویایی ساختاری فعالسازی و سیگنالدهی GPCR» اختصاص داده است. این تلاش متمرکز و بلندمدت دانشگاه را به یک مرکز بینالمللی برای پژوهش روی گیرندههای GPCR چسبنده تبدیل کرده و رویکردهای چندرشتهای را ممکن ساخت که نقش GPR133 در زیستشناسی استخوان را آشکار کردند.
«اگر این گیرنده توسط تغییرات ژنتیکی مختل شود، موشها در اوایل سنین کاهش تراکم استخوان را نشان میدهند — مشابه پوکی استخوان در انسان. با استفاده از مادهٔ AP503، که اخیراً از طریق غربالگری کامپیوتری بهعنوان یک محرک GPR133 شناسایی شد، توانستیم استحکام استخوان را هم در موشهای سالم و هم در موشهای مبتلا به پوکی استخوان بهطور قابلتوجهی افزایش دهیم»، توضیح میدهد پروفسور اینس لیبشر، پژوهشگر اصلی این مطالعه از مؤسسهٔ بیوشیمی رودولف شونهایمر در دانشکدهٔ پزشکی.
دیدگاه کارشناسان
دکتر مارتین کلر، داروشناس ترجمهای ساختگی و مشاور ارشد تحقیق و توسعه با تجربه در توسعهٔ داروهای عضلانی-اسکلتی، اظهار میدارد: «هدفگیری گیرندههای GPCR چسبنده مانند GPR133 یک استراتژی هوشمندانه است زیرا این گیرندهها در مرز بین محرکهای مکانیکی و پاسخ سلولی قرار دارند. ترکیبی که بتواند بهطور ایمن سیگنالدهی ناشی از ورزش را شبیهسازی کند و بازسازی را به سمت ساخت استخوان متمایل سازد ممکن است درمان بلندمدت پوکی استخوان را دگرگون کند — بهویژه برای بیمارانی که نمیتوانند درمانهای فعلی را تحمل کنند. مسیر از موش تا بازار طولانی است، اما مزیت همزمان عضله و استخوان که در اینجا گزارش شده، برای مراقبتهای سالمندان بهخصوص جذاب است.»
گامهای بعدی و چشمانداز آینده
تیم لیپزیگ چندین پروژهٔ پیگیری را دنبال میکند تا مکانیسم AP503 را با جزئیات بیشتر تعریف کند و نقش گیرنده را در مدلهای بیماری دیگر آزمایش نماید. گامهای مهم بعدی عبارتاند از:
- مطالعات دوز-پاسخ و تجویز مزمن برای ارزیابی اثرات پایدار و ایمنی.
- مطالعات ساختاری برای فهمیدن نحوهٔ اتصال و فعالسازی GPR133 توسط AP503، که به بهینهسازی دارو مانند خواص کمک میکند.
- مطالعات در مدلهای حیوانی بزرگتر برای پیشبینی بهتر فارماکولوژی انسانی.
- توسعهٔ زودهنگام بالینی، اگر ایمنی و اثربخشی پیشبالینی تأیید شود.
اگر این مسیرها با موفقیت پیش بروند، آگونیستهای GPR133 میتوانند به نسل بعدی درمانهای پوکی استخوان بپیوندند، بهویژه برای زنان پس از یائسگی و سالمندان در معرض خطر بالای شکستگیهای ناشی از شکنندگی.
نتیجهگیری
کشف GPR133 بهعنوان تنظیمکنندهٔ استحکام استخوان و نشان دادن اینکه یک فعالکنندهٔ مولکول کوچک، AP503، میتواند تراکم استخوان را افزایش دهد و تغییرات شبیه به پوکی استخوان را در موشها معکوس کند، پیشرفتی امیدبخش در زیستشناسی استخوان بهشمار میآید. با تکیه بر یک دهه پژوهش دربارهٔ گیرندههای GPCR چسبنده در دانشگاه لیپزیگ، این کار هم یک هدف درمانی تازه و هم چارچوب مفهومی برای مداخلاتی فراهم میآورد که نشانههای مکانیکی و سلولی را برای بازسازی و حفظ سلامت اسکلت یکپارچه میکنند. اگرچه ترجمه به درمانهای انسانی نیازمند پیگیری گستردهای است، پتانسیل همزمان تقویت استخوان و عضله، تنظیم GPR133 را به یک مسیر با اولویت بالا برای مقابله با کاهش عملکرد عضلانی-استخوانی مرتبط با سن تبدیل میکند.
دانشمندان یک «کلید استخوان» پیدا کردند که میتواند پوکی استخوان را متوقف کند و استخوانها را با افزایش سن قوی نگه دارد. منبع: Shutterstock
وقتی GPR133 در بافت استخوان فعال میشود، سیگنالی را راهاندازی میکند که سلولهای سازندهٔ استخوان (استئوبلاستها) را تحریک و سلولهای بازجذبکنندهٔ استخوان (استئوکلاستها) را مهار میکند. منبع: Biorender، Ines Liebscher
منبع: scitechdaily

ارسال نظر