8 دقیقه
مقدمه
یک تیم چندرشتهای از دانشگاه لایپزیگ (آلمان) و دانشگاه شاندونگ (چین) یک گیرنده سطح سلولی به نام GPR133 (که با نام ADGRD1 هم شناخته میشود) را بهعنوان تنظیمکنندهای کلیدی در تشکیل استخوان شناسایی کردهاند. این کشف که در نشریه Signal Transduction and Targeted Therapy منتشر شده، نشان میدهد فعالسازی این گیرنده استئوبلاستها را تحریک میکند و میتواند جرم و مقاومت مکانیکی استخوان را در مدلهای موشی بهطور محسوسی افزایش دهد.
زمینه و دلیل تحقیق
مطالعات ژنتیکی انسانی قبلاً نشان داده بودند که واریانتهای ژنتیکی در GPR133 با تفاوت در چگالی معدنی استخوان مرتبط است. این نتایج باعث شد محققان نقش زیستی این گیرنده را پیگیری کنند. آنها با ترکیب مدلهای حذف ژن و یک فعالکننده مولکولی کوچک به نام AP503 بررسی کردند که چگونه از دست رفتن یا تحریک GPR133 توسعه اسکلتی و نگهداری استخوان را تحت تاثیر قرار میدهد.
روش آزمایشی و یافتههای کلیدی
در این مطالعه از موشهایی استفاده شد که یا فاقد GPR133 بودند یا نسخهای از گیرنده را داشتند که میتوانست بهصورت دارویی فعال شود. حیواناتی که گیرنده را نداشتند، دچار کاهش جرم استخوان و شکنندگی ساختاری شدند که شبیه تغییرات اوستئوپروز بود. برعکس، موشهایی که AP503 دریافت کردند نشان دادند که فعالیت استئوبلاست افزایش یافته است، تشکیل استخوان بیشتر شده و مقاومت استخوان بهطور اندازهگیر بالا رفته است.
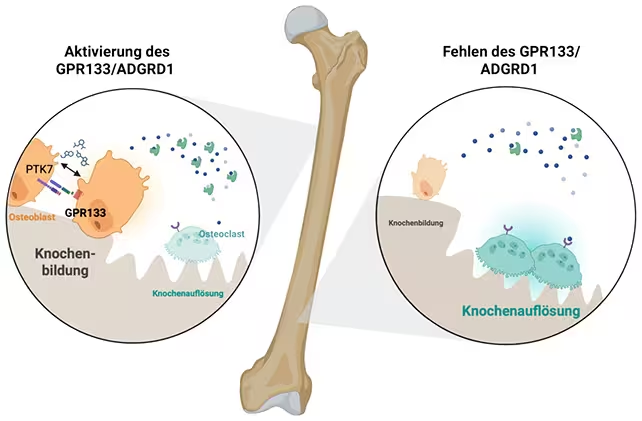
With GPR133 activated (on the left), the osteoblasts (orange) are more dominant. (Biorender, Ines Liebscher)
AP503 مثل یک کلید مولکولی عمل کرد که استئوبلاستها را روشن میکرد و رسوب ماتریکس استخوانی را در موشهای سالم و در مدلهای دارای از دست رفتن استخوان افزایش داد. محققان همچنین ترکیب فعالسازی گیرنده با بارگذاری مکانیکی (محرکهای شبیه به ورزش) را آزمایش کردند و اثرات جمعشونده مشاهده کردند: تحریک GPR133 به همراه فعالیت فیزیکی سود بیشتری در جرم و استقامت استخوان نسبت به هر یک بهتنهایی داشت.
نکات برجسته یافتهها
- حذف ژنتیکی GPR133 منجر به کاهش جرم استخوان و شکنندگی ساختاری شد.
- AP503 بهعنوان آگونیست GPR133 با استفاده از صفحهنمایش کمکشده کامپیوتری شناسایی شد.
- فعالسازی GPR133 استئوبلاستها را تقویت و نرخ تشکیل استخوان را بالا برد.
- ترکیب درمان دارویی و بار مکانیکی اثرات سینرژیک و قویتری ایجاد کرد.
مکانیسم بهاختصار
GPR133 عضو خانواده گیرندههای GPCR چسبنده (adhesion G protein–coupled receptor) است. این نوع گیرندهها سیگنالها را از غشای سلولی عبور میدهند و مسیرهای درون سلولی را فعال میکنند که قاعدتاً تمایز و عملکرد سلولی را کنترل میکنند. در این مطالعه، فعالسازی GPR133 تمایز و فعالیت استئوبلاست را افزایش داد و توازن را به نفع تشکیل استخوان نسبت به بازجذب جابجا کرد.
هرچند مسیرهای پاییندستی دقیق هنوز نیاز به نقشهبرداری دارند، نتیجه نهایی افزایش نرخ رسوب ماتریکس استخوانی جدید و بهبود میکرومعماری استخوان بود. این تغییرات در سطح سلولی با افزایش پارامترهای مکانیکی قابل اندازهگیری مانند سختی و مقاومت مطابقت داشتند.
پیامدها برای پوکی استخوان و سالمندی
پوکی استخوان یک بیماری مزمن است که استخوان را ضعیف میکند و خطر شکستگی را افزایش میدهد. این بیماری میلیونها نفر را در سراسر جهان مبتلا میکند و بهویژه پس از یائسگی شایع است. درمانهای فعلی میتوانند از دست رفتن استخوان را کند کنند، اما بهطور معمول قادر به بازسازی کامل استخوان از دست رفته نیستند یا با ریسکها و کاهش کارایی در طول زمان همراهند.
شناسایی GPR133 بهعنوان یک گیرنده قابل هدفگیری راهی بالقوه برای درمانهای آنابولیک فراهم میآورد؛ درمانهایی که بهجای صرفاً کاهش بازجذب، استخوان را بازسازی میکنند. تیم لایپزیگ تاکید میکند نتایج فعلی از مدلهای حیوانی بهدست آمده است، اما ماهیت محافظتشده زیستشناسی استئوبلاستها نوید قابلیت انتقال این یافتهها را میدهد.
اگر عملکرد GPR133 بهدلیل واریانت ژنتیکی یا کاهش وابسته به سن مختل شود، درمانهای هدفگیرنده گیرنده میتوانند برای افزایش چگالی استخوان در جمعیتهای در معرض خطر توسعه یابند. این گروهها شامل زنان پس از یائسگی و بزرگسالان مسن هستند.
"با تحریک دارویی GPR133، افزایشهای قابلتوجهی در استحکام استخوان در مدلها مشاهده کردیم،" گفت Ines Liebscher، بیوشیمیستی که در این تحقیق مشارکت داشت. Juliane Lehmann، زیستشناس مولکولی، نیز به امیدبخشی این گیرنده برای کاربردهای پزشکی در هدفگیری شکنندگی اسکلتی جمعیتهای مسن اشاره کرد.
فناوریهای مرتبط و گامهای بعدی
ترجمه این کشف به درمانهای بالینی نیازمند چندین گام است. ابتدا باید آگونیستهای GPR133 برای افزایش قدرت و ایمنی بهینه شوند. سپس آزمایشهای دقیق سمشناسی و مطالعات پیشبالینی در حیوانات بزرگتر ضروری است تا پیش از آغاز آزمایشهای انسانی اطمینان حاصل شود.
علاوه بر این، محققان باید اثرات بلندمدت، استراتژیهای دوزدهی، و اینکه آیا فعالسازی میتواند با اطمینان اوستئوپروز تثبیتشده را بازگرداند بدون عوارض خارجهدف را بررسی کنند. تعیین پنجره درمانی امن و شناسایی عوارض جانبی احتمالی از جمله ملاحظات مهم است.
ملاحظات عملی برای پیشبالینی و بالینی
- بهینهسازی ملکولی AP503 برای افزایش انتخابپذیری و پایداری دارویی.
- مطالعات سمشناسی کوتاهمدت و بلندمدت در گونههای مختلف حیوانی.
- ارزیابی اثرات ترکیبی با درمانهای موجود و با برنامههای توانبخشی فیزیکی.
- تعریف معیارهای ایمنی و بیومارکرهای پاسخدهی به درمان.
نظر کارشناسی را Dr. Maria Andersen، اندوکرینولوژیست و پژوهشگر زیستشناسی استخوان که با این مطالعه همکاری مستقیمی نداشت، اینگونه بیان کرد: "این کار یک استراتژی آنابولیک هیجانانگیز را پیشنهاد میدهد. اگر آگونیستهای GPR133 قابل پالایش و ایمن در انسان شوند، میتوانند مکملی برای ورزش و تغذیه در بازسازی استخوان بیماران باشند. رویکرد مسیر-محور احتمال اثرات سیستمیک گسترده را کاهش میدهد، اما ارزیابی بالینی دقیق ضروری است."
مزیتهای بالقوه درمان مبتنی بر GPR133
در صورت موفقیتآمیز بودن ترجمه، مزایای بالقوه شامل موارد زیر است:
- بازسازی فعال استخوان بهجای صرفاً کاهش بازجذب.
- بهبود میکرومعماری و پارامترهای مکانیکی استخوان.
- امکان ترکیب با ورزش برای تقویت اثرات درمانی.
- هدفگیری مسیر خاص که میتواند ریسک عوارض سیستمیک را کاهش دهد.
چه پرسشهایی هنوز بیپاسخ ماندهاند؟
- چه مسیرهای درونسلولی دقیقاً پس از فعالسازی GPR133 فعال میشوند؟
- آیا فعالسازی طولانیمدت این گیرنده عوارض غیرمنتظرهای ایجاد میکند؟
- اثر در گونههای بزرگتر و در انسان چگونه خواهد بود؟
- بهترین استراتژی دوزدهی و ترکیب با سایر درمانها چیست؟
نتیجهگیری
شناسایی GPR133 بهعنوان تنظیمکننده تشکیل استخوان توسط استئوبلاستها یک مسیر امیدوارکننده جدید در پژوهشهای مربوط به پوکی استخوان باز میکند. در موشها، فعالسازی این گیرنده با مولکول کوچک AP503 تشکیل استخوان و استحکام را افزایش داد و بهطور ترکیبی با بارگذاری مکانیکی اثرات قدرتمندتری ایجاد کرد.
اگرچه انتقال این یافتهها به درمان انسانی نیازمند آزمایشهای گسترده بیشتری است، هدفگیری GPR133 در نهایت میتواند به توسعه درمانهای آنابولیک منجر شود که استخوان تحلیلرفته را بازسازی کنند و ریسک شکستگی را در جمعیتهای مسن کاهش دهند.
برای مرجع تصویری و تکمیلی، تصویر مرکز یافتهها در این مقاله گنجانده شده است:

With GPR133 activated (on the left), the osteoblasts (orange) are more dominant. (Biorender, Ines Liebscher)
منابع اصلی این پژوهش دانشگاه لایپزیگ، دانشگاه شاندونگ و مقاله منتشرشده در Signal Transduction and Targeted Therapy هستند. نامها و مولکولهای کلیدی شامل GPR133 (ADGRD1)، AP503، Ines Liebscher، Juliane Lehmann و اظهار نظر کارشناسی Dr. Maria Andersen در متن حفظ شدهاند.
پیشنهادات اجرایی و گامهای عملی برای پژوهشگران
- ادامه پژوهشهای سلولی برای تعیین مسیرهای پاییندستی GPR133.
- بهینهسازی AP503 و مشتقات آن برای افزایش انتخابپذیری و کاهش سمیت.
- طراحی مطالعات پیشبالینی در حیوانات بزرگتر با ارزیابی عملکردی و بافتشناسی.
- برنامهریزی برای مطالعات فاز اولیه انسانی با تمرکز بر ایمنی و بیومارکرهای پاسخ.
این گامها میتوانند به تسریع تبدیل یک کشف بنیادی به گزینه درمانی عملی کمک کنند. در هر مرحله، تعامل بین علوم پایه، داروشناسی و کلینیکال ضروری است.
خلاصه اجرایی
در یک جمله: فعالسازی گیرنده GPR133 با مولکول AP503 توانست تشکیل استخوان را در موشها افزایش دهد و با ورزش ترکیبی سودمند ایجاد کند. این یافته یک هدف دارویی جدید برای درمانهای آنابولیک پوکی استخوان نشان میدهد، اما نیاز به آزمونهای ایمنی و کارآزماییهای بالینی دارد.
تماس و قدردانی
پژوهشگران و مؤسسات شریک در این پروژه عبارتاند از دانشگاه لایپزیگ و دانشگاه شاندونگ. تصویرها و نمودارهای همراه توسط Biorender و با مشارکت Ines Liebscher تهیه شدهاند.
منبع: sciencealert

ارسال نظر