8 دقیقه
خلاصه مطالعه و تصویر کلیدی
یک مطالعه جدید از موسسه فلوری علوم اعصاب و سلامت روان در ملبورن گزارش میدهد که عفونت کووید-۱۹ در موشهای نر تغییرات قابلاندازهگیری در محتوای اسپرم ایجاد کرده است که با افزایش رفتارهای شبیه اضطراب در فرزندانشان همراه بوده است. این نتایج که در یک نشریه بازنگریشده همتا منتشر شدهاند (Nature Communications)، نشاندهنده تغییرات مولکولی در RNA اسپرم و تغییرات پایدار در فعالیت ژنی مغز هستند که میتواند بازتابدهنده وراثت اپیژنتیک باشد. این یافتهها در زمینه پژوهشهای زیستی مولکولی و سلامت عمومی اهمیت قابلتأملی دارند و سوالات جدیدی را درباره پیامدهای میاننسلی همهگیری کووید-۱۹ مطرح میکنند.
الیزابت کلیمن، نویسنده اول مقاله، گفت: "ما مشاهده کردیم که فرزندان حاصل رفتارهای اضطرابی بیشتری نسبت به فرزندان پدران غیرمبتلا نشان دادند." کارولینا گوبِرت، همنویسنده ارشد، افزود که تغییر در فعالیت ژنها در ناحیه هیپوکامپ — مرکز تنظیم هیجانات در مغز — میتواند تا حدی این تغییرات رفتاری را توضیح دهد. چنین شواهدی اشاره دارند به اینکه رویدادهای محیطی مانند عفونت ممکن است از طریق تغییر در RNA و علامتهای اپیژنتیک گامتها اثرات فراتر از نسل مستقیم را بر جای بگذارند.
طراحی تجربی و یافتههای مولکولی
در این پژوهش محققان موشهای بالغ نر را در معرض ویروس عامل کووید-۱۹ قرار دادند، سپس این نرها را با مادههای سالم و عاری از عفونت جفتگیری دادند و سلامت، رفتار و الگوهای بیان ژن در مغز بچهموشهای حاصل را دنبال کردند. تیم تحقیقاتی گزارش داد که تمام فرزندانی که از پدران مبتلا به ویروس بهوجود آمدند، در آزمونهای رفتاری استاندارد افزایش رفتارهای شبیه اضطراب را نشان دادند. این مشاهدات شامل چندین شاخص رفتاری بود که معمولاً در مدلهای رفتاری موش برای سنجش اضطراب بهکار میروند و نشاندهنده یک الگوی نسبتاً پایدار بود.
تحلیلهای مولکولی نشان داد که پس از عفونت، اجزای معینی از RNA در اسپرم دچار تغییر شدهاند. این تغییرات RNA شامل گونههایی بودند که بهطور شناختهشده شبکههای ژنی دخیل در رشد عصبی و توسعه مغزی را تحتتأثیر قرار میدهند. نویسندگان اشاره میکنند که برخی از این مولکولهای RNAِ منتقلشده توسط اسپرم در تنظیم ژنهایی که در مراحل اولیه شکلگیری مغز فعالاند نقش دارند؛ بنابراین تغییر در ترکیب RNA اسپرم میتواند بر برنامهریزی عصبی اولیه تأثیر بگذارد و پیامدهای رفتاری را در نسل بعدی شکل دهد. از نظر مکانیزمی، این گونه تغییرات ممکن است از طریق مولکولهای کوچک مانند میکروRNAها، تکههای مشتقشده از tRNA یا RNAهای غیربدنی کار کنند؛ اما پژوهشگران تأکید میکنند که تعیین نقش دقیق هر کلاس RNA نیازمند تحلیلهای بیشتر و آزمایشهای عملکردی است.
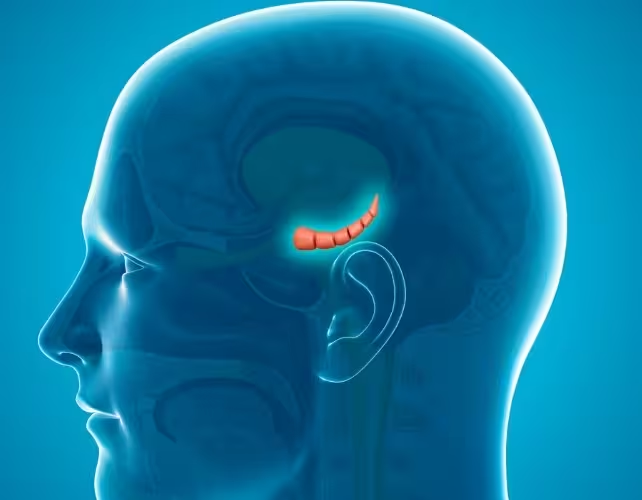
هیپوکامپ (مرکز) در یک مغز انسانی
در میان فرزندان ماده، تیم تحقیقاتی تغییرات "قابلتوجهی" در الگوهای بیان ژن هیپوکامپ مشاهده کرد. کارولینا گوبِرت این تفسیر را خلاصه کرد: "این امر ممکن است از طریق وراثت اپیژنتیک و تغییرات در رشد مغزی به افزایش اضطراب در فرزندان کمک کند." آنتونی هانن، پژوهشگر ارشد، بر پیامدهای احتمالی عمیقتر تأکید کرد و گفت: "این یافتهها نشان میدهند که پاندمی کووید-۱۹ ممکن است اثرات طولانیمدتی بر نسلهای آینده داشته باشد." با این حال، او همچنین هشدار داد که برای تعیین اینکه آیا مکانیسمهای مشابه در انسان هم عمل میکنند، کار و شواهد بیشتری لازم است. درواقع، مطالعات مکانیکی و ترجمهای بیشتر برای پرکردن فاصله بین مدلهای حیوانی و وضعیت انسانی ضروریاند.
زمینه علمی و پیامدها
«وراثت اپیژنتیک» به تغییراتی اشاره دارد که در توالی DNA نیستند — مانند تغییرات شیمیایی روی DNA یا پروتئینهای اطراف آن (هیستونها)، یا تغییر در محتوای RNA در سلولهای زایشی — اما میتوانند الگوی بیان ژن را در نسلهای بعدی تحتتأثیر قرار دهند. در مدلهای حیوانی نشان داده شده است که عوامل محیطی از جمله عفونت، استرس روانی، رژیم غذایی و تماس با سموم میتوانند علامتهای اپیژنتیک در اسپرم را تغییر داده و صفات رفتاری یا فیزیولوژیک فرزندان را دگرگون سازند. این مطالعه، در چارچوب یک مدل کنترلشده موشی، عفونت SARS-CoV-2 را به فهرست عواملی اضافه میکند که میتوانند نشانهای اپیژنتیک در گامتها ایجاد یا تعدیل کنند.
اگر فرآیندهای مشابه در انسان رخ دهند، پیامدهای سلامت عمومی میتواند چشمگیر باشد: میلیونها نفر در سراسر جهان در طول همهگیری به این ویروس مبتلا شدند و اثرات میاننسلی میتواند اثر زیستی پاندمی را فراتر از کسانی که خود بهطور مستقیم بیمار شدهاند گسترش دهد. با این وجود، محققان و کارشناسان مستقل بر احتیاط تأکید دارند. زیستشناسی خط زایا (germline) و توسعه در انسان با موش تفاوتهایی دارد و شواهد اپیدمیولوژیک قوی که ارتباط مستقیم بین کووید-۱۹ والدین و اختلالات رشد عصبی یا رفتاری کودکان را نشان دهد هنوز قطعی نیست. برای نمونه، متغیرهای متعددی مانند شدت عفونت والدین، زمان وقوع عفونت نسبت به لقاح، وضعیت واکسیناسیون، عوامل اجتماعی-اقتصادی و محیط پس از تولد میتوانند نتایج توسعهای را تعدیل کنند و باید در مطالعات انسانی کنترل شوند.
گامهای بعدی و اولویتهای پژوهشی
تحقیقات آتی باید بررسی کنند که آیا تغییرات مشابه در RNA اسپرم و نشانهای اپیژنتیک در مردان انسانی مبتلا نیز دیده میشود، آیا این سیگنالها در طول زمان پایدار میمانند، و چگونه با عوامل مادری و محیط پس از تولد تعامل دارند. مطالعات طولی کوهورت انسانی با نمونهگیری گامتها و پیگیری رشد عصبی و رفتاری فرزندان، همراه با کار مکانیکی در آزمایشگاه روی نمونههای انسانی و مدلهای حیوانی، برای ترجمه این نتایج حیوانی به توصیههای بالینی ضروریاند. بررسی عناصر زیر بهویژه مهم است:
- تکرار نتایج در نمونههای مستقل موشی و استفاده از طرحهای تجربی متفاوت برای آزمایش علیت.
- تحقیق روی نمونههای انسانی شامل اندازهگیری RNA اسپرم، الگوهای متیلاسیون DNA و وضعیت هیستونها در مردان مبتلا به سارس-کوو-۲ با جزئیات درباره شدت بیماری و زمان نسبی نسبت به لقاح.
- مطالعات مکانیکی مانند تزریق RNA اسپرم به تخمکهای سالم یا استفاده از مدلهای نقصروند برای تعیین نقش عملکردی گونههای RNA مشخص.
- تحلیل اثرات متقابل با عوامل مادری، شامل وضعیت ایمنی، سلامت متابولیک و عوامل رفتاری اجتماعی که میتوانند بر نمو عصبی تاثیر بگذارند.
- گنجاندن متغیرهای بالینی-اپیدمیولوژیک مانند واکسیناسیون، داروهای مورد استفاده در دوره بیماری، و شرایط استرسزای محیطی که ممکن است بر نتایج میاننسلی تأثیر بگذارند.
علاوه بر این، رویکردهای فناورانه مانند توالییابی RNA با تفکیک بالا، آنالیز اپیژنتیک جامع و مطالعات عملکردی در سطح تکسلولی میتوانند کمک کنند تا فرایندهای مولکولی دقیقتر شناسایی شوند. این اطلاعات برای تعیین اینکه آیا میتوان مداخلات پیشگیرانه یا راهبردهای درمانی برای کاهش خطرات بالقوه میاننسلی پیشنهاد داد، حیاتی است.
نتیجهگیری
این مطالعه در ملبورن شواهد تجربی در موشها ارائه میدهد که عفونت پدری با سارس‑کوو‑۲ میتواند محتوای مولکولی اسپرم را تغییر داده و همزمان با تغییرات مرتبط با اضطراب در عملکرد و رفتار مغز فرزندان باشد. نتایج، سوالات مهمی درباره اثرات میاننسلی بیماریهای عفونی مطرح میکنند اما اعتباربخشی و تعمیم این یافتهها به انسان نیازمند پیگیریهای دقیق، مطالعات طولی و کار بینارشتهای است. تا زمانی که شواهد انسانی بیشتری فراهم شود، بهترین رویکرد ترکیبی از مطالعات پایه، اپیدمیولوژی دقیق و احتیاط علمی است تا پیامدهای بالقوه برای سلامت نسلهای آینده به طور مناسبی ارزیابی و مدیریت شود.
منبع: sciencealert

ارسال نظر