9 دقیقه
پس از بیش از ده سال پژوهش آزمایشگاهی، گروهی از محققان پیشرفتی چشمگیر گزارش دادهاند که میتواند به تولید کلیههایی منجر شود که گیرندگان با هر گروه خونی قادر به پذیرش آنها باشند. یک تیم چندملیتی کلیههای اهداشده را به شکلی بدون آنتیژن تبدیل کرده است که—حداقل بهطور موقت—در مدل انسانی مانند عضو خون نوع O رفتار کرد؛ گامی که میتواند فهرست انتظار طولانی پیوند را کوتاهتر کند و جان بیماران را نجات دهد.

کلیهای که در آزمایشگاه آماده میشود
برداشتن مانع گروه خونی بهعنوان یک مسئله فنی
سازگاری گروه خونی یکی از بزرگترین موانع عملی در پیوند کلیه است. سیستم گروه خونی ABO محدودیت روشنی برای مشخص میکند چه کسی میتواند عضو چه اهداکنندهای را دریافت کند: گیرندگان با گروه خونی O معمولاً باید برای یک دهنده O منتظر بمانند، و کلیههای نوع O بهخصوص تقاضای بالایی دارند زیرا میتوانند در گیرندگان گروههای خونی دیگر نیز کار کنند. این محدودیت ساختار سیستم پیوند و زمانبندی جراحیها را پیچیده میکند.
برای دور زدن این مانع، دانشمندان از آنزیمهایی استفاده کردند که بهطور انتخابی مولکولهای قندی—که آنتیژن نامیده میشوند—را از سطح سلولهای خونی و بافتهای اهداشده جدا میکنند؛ مولکولهایی که به دستگاه ایمنی علامت میدهند «این جسم خارجی است». تیم پژوهشی از این آنزیمها برای پاکسازی نشانگرهای گروه خونی A از یک کلیه اهداشده بهره برد تا آن را عملاً به یک عضو تبدیلشدهٔ آنزیمی نوع O (Enzyme‑Converted Type‑O یا ECO) تبدیل کنند.
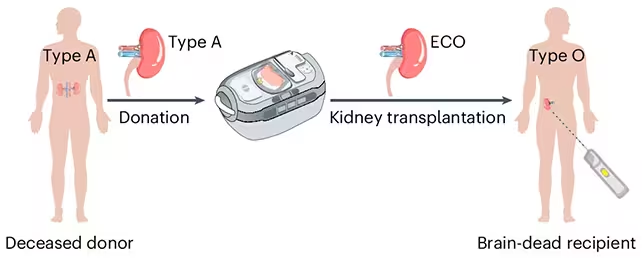
پژوهشگران یک کلیهٔ تبدیلشدهٔ آنزیمی نوع O (ECO) آمادهٔ پیوند تولید کردند. (Zeng et al., Nat. Biomed. Eng., 2025)
بیوشیمیست استفن ویترز از دانشگاه بریتیش کلمبیا که در گزارش اصلی نقلقول شده است، این آنزیمها را شبیه یک جفت قیچی مولکولی توصیف میکند: آنها قندهای آنتیژنی تعریفکنندهٔ نوع A را قطع میکنند و سطحی با شیمی خنثی نمایان میشود که معادل سطح نوع O است. «وقتی این کار انجام شود، سیستم ایمنی دیگر عضو را بهعنوان جسم خارجی نمیبیند،» او میگوید و اشاره میکند که این نخستین مرتبهای است که این روش در یک مدل انسانی آزمایش شده است.
جزئیات فنی شامل انتخاب آنزیمهای خاص گلیکوزیداز، شرایط pH و دما برای عملکرد بهینه، و شیوهٔ اعمال آنزیم به بافت کلیه در شرایط اکسویوو (خارج از بدن) بود. تیم تحقیقاتی همچنین روشهایی برای شستوشوی باقیماندهٔ آنزیم و ارزیابی اثربخشی حذف آنتیژن با استفاده از فنآوریهای ایمونوهیستوشیمی و سنجشهای سرمی توسعه دادند تا مطمئن شوند رویه، سطح آنتیژن را تا حد قابل توجهی کاهش میدهد.
آنچه پیوند آزمایشی نشان داد — و آنچه نشان نداد
کلیهٔ تبدیلشده در یک گیرندهٔ مرگ مغزی که خانوادهٔ او رضایت برای استفادهٔ پژوهشی داده بودند، پیوند شد؛ این عضو برای چند روز در آن گیرنده عملکرد داشت. آن دورهٔ عملکرد اطلاعات مهم و عملی دربارهٔ نحوهٔ واکنش سیستم ایمنی هنگامی که نشانگرهای ABO یک عضو بهصورت شیمیایی حذف شدهاند، به دانشمندان ارائه داد. دادههای عملی از یک مدل انسانی ارزشمند است زیرا مدلهای حیوانی همیشه تمام جنبههای پاسخ ایمنی انسان را بازتاب نمیدهند.
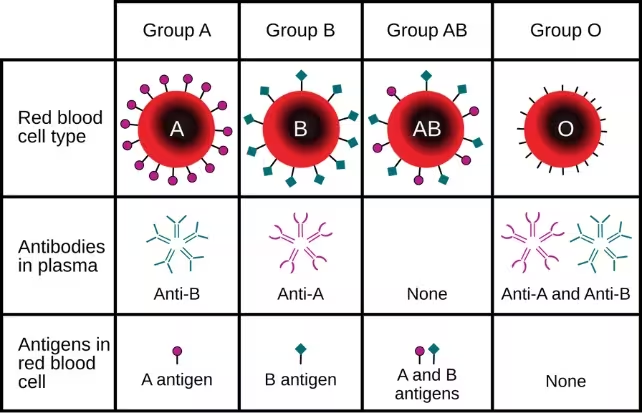
با این حال، تبدیل دائمی نبود. تا روز سوم پس از پیوند، نشانگرهای نوع A دوباره در بافت کلیه ظاهر شدند و واکنش ایمنی را برانگیختند. با این وجود، شدت واکنش کمتر از آن چیزی بود که معمولاً برای یک پیوند ناسازگار انتظار میرود و نشانههایی دیده شد که زیستشناسی میزبان به سوی تحمل ایمنی حرکت کرده است تا طرد کامل. بازبیان یا بازظهور آنتیژن یک چالش محوری را برجسته میکند: چگونه حذف آنتیژن را بهاندازهٔ کافی پایدار کنیم تا برای استفادهٔ روتین در گیرندگان زنده مناسب باشد.
تحلیل نمونهها نشان داد که منشاء بازظهور ممکن است از بازیابی مسیرهای بیوسنتزی قندی در سلولهای اندوتلیال کلیه یا از سلولهای ایمنی یا سلولهای اپیتلیالی باقیمانده باشد که آنزیمها بهطور کامل نتوانستهاند به آنها دسترسی پیدا کنند. بنابراین مسئلهٔ فنی بعدی شامل بهینهسازی نفوذ آنزیم و مدتزمان تماس، یا ایجاد روشهای ترکیبی است که به همراه حذف آنتیژن، سازوکارهایی برای تثبیت آن سطح خنثی نیز فراهم کند.
زمینه: چرا این میتواند منطق تأمین پیوند کلیه را دگرگون کند
کمبود کلیهها یک بحران جهانی است. تنها در ایالات متحده، بهطور متوسط هر روز حدود 11 نفر در انتظار پیوند کلیه جان خود را از دست میدهند و بسیاری از این مرگها مربوط به افرادی است که نیازمند اعضای نوع O هستند. استراتژیهای بالینی فعلی برای غلبه بر ناسازگاری گروه خونی—که بهعنوان پروتکلهای حساسزدایی شناخته میشوند—میتوانند موثر باشند اما زمانبر، پرخطر و پرهزینهاند. این پروتکلها معمولاً نیاز دارند که گیرنده از قبل شناخته شده باشد که کارایی استفاده از اهداکنندگان فوتشده را محدود میکند.
یک روش قابلاعتماد برای تبدیل کلیههای دهنده به فرم جهانی میتواند بهطور چشمگیری مجموعهٔ اعضای قابلاستفاده را افزایش دهد، زمان انتظار را کاهش دهد و مرگومیر در فهرستهای پیوند را کم کند. همچنین میتواند لجستیک را ساده کند: بهجای انطباق نوع ABO یا اجرای دورههای طولانی حساسزدایی، ممکن است پزشکان بتوانند یک عضو را خارج از بدن درمان کنند و سریعتر به فرایند پیوند ادامه دهند. این تغییر میتواند ظرفیت بانکهای اعضا را بهبود دهد و نیاز به پیدا کردن تطبیق دقیق فرستنده-گیرنده را کاهش دهد.
از منظر زنجیرهٔ تأمین عضو، تبدیل آنزیمی میتواند هزینههای بارز نگهداری طولانی و آزمایشهای تطبیق را کاهش دهد و موجب بهرهوری بالاتر در استفاده از کلیههای اهدایی شود. همینطور، احتمالاً پذیرش گستردهتر پیوند با کاهش زمان انتظار و صرفهجویی در منابع درمانی حاصل خواهد شد.
موانع علمی و گامهای بعدی
پیش از آنکه این رویکرد برای بیماران زنده عرضه شود، مسائل فنی و بالینی متعددی باید حل شوند. سوالات کلیدی شامل چگونگی جلوگیری از بازظهور آنتیژنها، چگونگی مقیاسدهی درمانهای آنزیمی برای تعداد زیادی از اعضا، و تضمین این امر است که تبدیل، آسیبپذیریهای دیگری—مانند افزایش حساسیت به عفونت یا فعالسازی مضر سیستم ایمنی—ایجاد نکند. همچنین باید ارزیابیهای طولانیمدت دربارهٔ عملکرد کلیهٔ تبدیلشده و پیامدهای پیوند انجام شود.
محققان در حال بررسی راهبردهای مکمل هستند: ترکیب حذف آنتیژن با تعدیل ایمونولوژیک هدفمند، افزایش قدرت و ماندگاری آنزیمها از طریق مهندسی پروتئین، یا ترکیب تبدیل آنزیمی با نوآوریهای دیگر مانند آنتیبادیهای مهندسیشده یا زنوپلانتها (مثلاً کلیهٔ خوک). مطالعات طولی در مدلهای حیوانی و کارهای اضافی در مدلهای انسانی برای نقشهبرداری از ایمنی و دوام لازم خواهد بود. برای حرکت به سمت کارآزماییهای بالینی، مطالعات سمشناسی آنزیم، ارزیابی ایمونولوژیک جامع و طراحی پروتکلهای استاندارد شده برای عملیات اکسویوو ضروری خواهند بود.
از منظر مقررات، نهادهای نظارتی نیاز دارند که دادههای واضحی دربارهٔ ایمنی کوتاهمدت و بلندمدت، نحوهٔ کنترل و حذف آنزیمها از بافت، و معیارهای پذیرش یک عضو تبدیلشده دریافت کنند. همچنین مسائل اخلاقی همچون رضایت آگاهانهٔ دهندگان ارگان و خانوادههای آنان، و اولویتبندی دریافتکنندگان در فهرست انتظار باید با شفافیت مورد بحث قرار گیرد.
در سطح فنی، کار بر روی ارتقای خواص آنزیم شامل افزایش اختصاصیت برای ساختارهای قندی هدف، کاهش ایمنیزایی آنزیمها، و طراحی سیستمهای تحویل که آنزیم را به صورت یکنواخت در سراسر بافت توزیع کنند، از اولویتهاست. فناوریهای پوشش نانوذرهای یا حاملهای مبتنی بر پلیمر ممکن است به ثابتسازی آنزیمها و بهبود نفوذ آنها کمک کنند.
دیدگاه کارشناسان
«این پیشرفتی اندازهدار اما هیجانانگیز است،» میگوید دکتر مایا پاتل، متخصص ایمونولوژی پیوند که در این مطالعه شرکت نداشت. «نشان دادن عملکرد کوتاهمدت در یک مدل انسانی یک نقطهٔ عطف مهم است. کار بعدی مهندسی ماندگاری است—اطمینان از اینکه نمایهٔ آنتیژنی روزها یا هفتهها بعد دوباره بازنمیگردد. اگر دانشمندان بتوانند تبدیل را قفل کنند یا آن را با تنظیم ایمنی انتخابی ترکیب کنند، تأثیر بر فهرستهای انتظار میتواند بسیار بزرگ باشد.»
کارشناسان همچنین مسیرهای موازی را دنبال میکنند: الگوریتمهای بهبودیافتهٔ تطبیق، استفادهٔ گستردهتر از اهداکنندگان زنده، و اعضای حیوانی جهشیافتهٔ ژنتیکیشده. مجموع این تلاشها نمایانگر یک رخنهٔ چندجانبه به مسئلهٔ جهانی کمبود اعضا است.
نکتهٔ مهم این است که این پیشرفت تنها یک فناوری نیست بلکه نقطهٔ تلاقی زیستشناسی مولکولی، ایمونولوژی پیوند، مهندسی پروتئین و عملیات بالینی است. ترکیب این حوزهها برای ارائهٔ راهحل بالینی نیازمند تیمهای میانرشتهای، سرمایهگذاری در زیرساختهای آزمایشگاهی و همکاری بینالمللی است.
پیامدها برای بیماران و نظام سلامت
برای بیماران، یک کلیهٔ جهانی ایمن و قابلاطمینان به معنای ماهها یا سالهای کمتر تحت دیالیز بودن و کاهش مرگومیر در حین انتظار است. از منظر نظام سلامت، میتواند هزینههای شدید مرتبط با دیالیز طولانیمدت و پروتکلهای پیچیدهٔ حساسزدایی را کاهش دهد و منابع را به سمت مراقبت پس از پیوند و بهبود کیفیت زندگی هدایت کند.
برای پژوهشگران، این مسئله یک چالش مهندسی و ایمونولوژیک روشن فراهم میآورد: چگونه یک اصلاح مولکولی را طوری طراحی کنند که بهاندازهٔ کافی پایدار بماند تا شیوهٔ بالینی را تغییر دهد؟ پاسخ به این سوال مستلزم ترکیب آزمایشهای پایه، مطالعات پیشکلینیکی و کارآزماییهای بالینی مرحلهای خواهد بود.
مطالعه در نشریهٔ Nature Biomedical Engineering منتشر شده و نمونهای ملموس از ترجمهٔ بیوشیمی پایه به سمت مراقبت از بیمار را نشان میدهد. همانطور که ویترز دربارهٔ پیشرفت تیم اشاره کرد، دیدن نزدیکتر شدن بینشهای آزمایشگاهی به واقعیت بالینی دقیقاً همان انگیزهای است که پژوهش بلندمدت را تغذیه میکند.
منبع: sciencealert

ارسال نظر