8 دقیقه
دانشمندان یک واریانت ژنی واحد را شناسایی کردهاند که موجب نوعی بسیار نادر از دیابت در نوزادان میشود — کشفی که نور تازهای بر چگونگی شکلگیری و نارسایی سلولهای بتا تولیدکنندهٔ انسولین میتاباند. این موتاسیون عملکرد سلولهای بتا را مختل کرده و میتواند به مرگ این سلولها بیانجامد و بدین ترتیب مثلث نگرانکنندهای از علایم را در نوزادان مبتلا توضیح میدهد.
یک ژن و سندروم مهلک دوران کودکی
یک تیم تحقیقاتی بینالمللی دیابت نوزادی را در شش نوزاد به موتاسیونهایی در ژن TMEM167A ردیابی کردند. این نوزادان همچنین مبتلا به میکروسفالی (کوچکی غیرطبیعی سر) بودند و در پنج مورد از شش مورد، تشنج یا اپیلپسی مشاهده شد — ترکیبی از ویژگیها که قبلاً بهعنوان MEDS (سندروم میکروسفالی، اپیلپسی و دیابت) شناخته شده است. تا پیش از این دو ژن IER3IP1 و YIPF5 بهطور قاطع با MEDS مرتبط شناخته شده بودند؛ یافتههای تازه TMEM167A را بهعنوان عامل ژنتیکی سوم معرفی میکنند و دامنهٔ ژنتیکی این سندروم را گستردهتر میسازند.
این کشف پیامدهای مهمی برای ژنتیک بالینی، مشاورهٔ خانوادهها و ثبت موارد نادر دارد. با شناسایی دقیق ژنهای دخیل در MEDS، امکان انجام مشاورهٔ پیش از تولد، بررسیهای ژنتیکی هدفمند و مدیریت حمایتی بهموقع برای نوزادان و خانوادههایشان تسهیل میشود. همچنین افزودن TMEM167A به فهرست ژنهای مرتبط با MEDS به توان تشخیصی آزمایشهای ژنتیکی کلینیکی میافزاید و کارآزماییهای آینده را در جمعیتهای بزرگتر ممکن میسازد.
چگونه TMEM167A تولید انسولین را تضعیف میکند
ژن TMEM167A در هر دو عضو پانکراس و مغز در انسان و موش فعال است — توزیعی که توضیح میدهد چرا موتاسیونها بر هردو عضو تاثیر میگذارند. برای مطالعهٔ اثرات این موتاسیون، پژوهشگران سلولهای بنیادی پرتوان انسانی را ویرایش ژنتیکی کردند و ژن طبیعی TMEM167A را با واریانت یافت شده در یک بیمار MEDS جایگزین نمودند. سپس آن سلولهای بنیادی هدایت شدند تا تبدیل به سلولهای بتای پانکراسی شوند؛ سلولهایی تخصصیافته که انسولین تولید و ترشح میکنند.
این مدل سلولی بنیادی انسانی ویرایششده یک ابزار قدرتمند در زیستشناسی مولکولی و پزشکی بازساختی است. با استفاده از چنین مدلهایی میتوان علاوه بر درک مکانیسمهای مولکولی بیماریهای نادر، راهکارهای درمانی نوظهور مانند داروهای کاهشدهندهٔ استرس آندوپلاسمی یا رویکردهای جایگزینی سلول بتا را پیش از ورود به آزمایشهای حیوانی و بالینی ارزیابی نمود. این رویکرد، پل مستقیمی بین کشف ژن و توسعهٔ درمانهای هدفمند فراهم میآورد.
تکوین ظاهری طبیعی — عملکرد ناقص
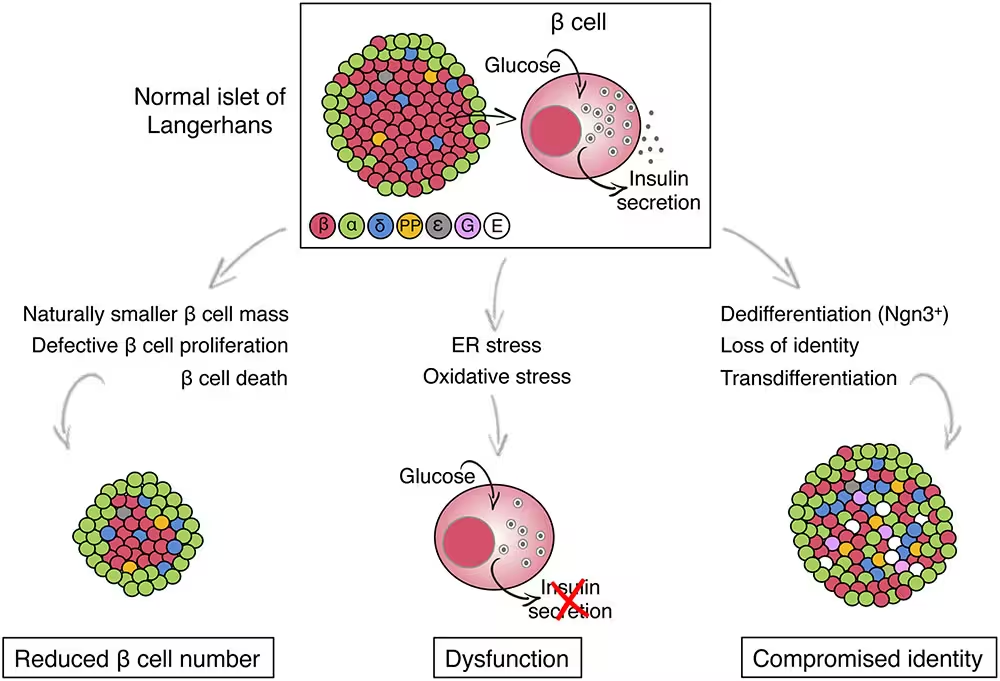
بهطرز شگفتآوری، سلولهای بتای حامل واریانت TMEM167A از نظر شمار و ساختار اولیه شکل گرفتند، اما در عملکرد دچار نقص بودند. هنگامی که این سلولها در معرض گلوکز قرار گرفتند، برخلاف سلولهای بتای سالم، ترشح انسولین را انجام ندادند. این نارسایی عملکردی به استرس در شبکهٔ آندوپلاسمی (ER) سلول بازمیگشت — شبکهای مسئول تاختن، تاخوراندن و حمل پروتئینها. استرس مزمن ER مسیرهای سلولی مرگ برنامهریزیشده را فعال کرد که نهایتاً منجر به از دست رفتن سلولهای بتا شد.
مکانیزمهای مولکولی مرتبط با استرس آندوپلاسمی شامل مجموعهای از واکنشهای تنظیم هموستاز پروتئینی است که تحت عنوان UPR (پاسخ پروتئینهای تاخورده) شناخته میشود. فعالسازی طولانیمدت UPR باعث میشود مسیرهای مرگ سلولی مانند آپوپتوز یا اتوفاژی تغییریافته راهاندازی شوند. در مدل سلولی حاوی واریانت TMEM167A، شواهدی از افزایش نشانگرهای استرس ER و فعال شدن پروتئینهای مرتبط با مسیرهای مرگ سلولی مشاهده شد که توضیحدهندهٔ کاهش توان تولید و ترشح انسولین است.
«توانایی تولید سلولهای تولیدکننده انسولین از سلولهای بنیادی به ما امکان داد تا بهطور مستقیم آنچه در سلولهای بتا در انواع نادر و همچنین اشکال شایعتر دیابت نادرست است را بررسی کنیم»، مریم نوپ (Miriam Cnop)، دیابتولوژیست در دانشگاه آزاد بروکسل گفت. «این یک مدل استثنایی برای مطالعهٔ مکانیسمهای بیماری و آزمون درمانها است.»
در کنار مطالعات سلولی، پژوهشگران میتوانند از مدلهای جانوری جهشیافته و ارگانوئیدهای پانکراس نیز برای بررسی تعاملات سلولی-بافتی و تاثیرات سیگنالینگ بین سلولهای بتا و میکرومحیط آنان بهره ببرند. ترکیب دادههای مولکولی، سلولی و بافتی تصویر جامعتری از نقش TMEM167A در هموستاز متابولیک و سلامت نورولوژیک ارائه میدهد.
اهمیت این یافته فراتر از بیماریهای نادر
اگرچه MEDS بسیار نادر است (حدود 11 مورد پیش از این مطالعه ثبت شده بود)، مشکلات سلولی کشفشده — استرس ER، شکست در ترشح انسولین و از دست رفتن سلول بتا — منعکسکنندهٔ فرایندهایی است که در انواع شایعتر دیابت، از جمله دیابت نوع 2، دیده میشود. این همپوشانی نشان میدهد که بین شیوههای مولکولی در بیماریهای نادر و شایع ارتباط وجود دارد و بررسی ژن TMEM167A میتواند دیدگاههای جدیدی برای تحقیقات گستردهتر روی دیابت ارائه کند.
برای مثال، مکانیسمهایی که به از دست رفتن سلول بتا در MEDS منجر میشوند ممکن است مسیرهای مشترکی با تخریب سلول بتا در دیابت نوع 1 یا نارسایی عملکردی در دیابت نوع 2 داشته باشند. به این ترتیب، شناسایی اهداف مولکولی که میتوانند استرس ER را کاهش داده یا توان ترشح انسولین را بازگردانند، برای توسعهٔ درمانهای جدید در طیف وسیعی از اختلالات متابولیک اهمیت پیدا میکند.
«یافتن تغییرات DNA که موجب دیابت در نوزادان میشوند، راهی یگانه برای شناسایی ژنهایی فراهم میآورد که نقشهای کلیدی در تولید و ترشح انسولین دارند»، الیسا دی فرانکو (Elisa de Franco)، ژنتیکمولکولی در دانشگاه اگزتر، گفت. «کار ما روشن میکند که ژنی کمتر شناختهشده مانند TMEM167A چقدر برای ترشح انسولین اهمیت دارد.»
تحقیقات بعدی میتواند به تعیین اینکه آیا و چگونه TMEM167A با مسیرهای شناختهشدهٔ تنظیم متابولیسم و پاسخ التهابی تداخل دارد بپردازد. این شواهد میتواند در آینده منجر به تعیین بیومارکرهای پیشبینیکنندهٔ ریسک یا پاسخدرمانی شود که کاربرد در تشخیص زودهنگام یا طبقهبندی زیرگروههای دیابت دارد.
نگاهی به آینده: تشخیص و درمانهای بالقوه
از منظر بالینی، شناخت موتاسیونهای TMEM167A امکان تشخیص ژنتیکی قطعی موارد MEDS را فراهم میکند که میتواند راهنمای مشاورهٔ خانوادهها و مدیریت نوزادان مبتلا باشد. تشخیص زودهنگام از طریق تستهای ژنتیکی هدفمند یا توالییابی کامل اگزون میتواند به برنامهٔ درمانی سریعتر، کنترل بهتر گلوکز و پیشگیری از عوارض ثانویه کمک کند.
در جبههٔ تحقیق، مدل سلولی بر پایهٔ سلولهای بنیادی بستری برای آزمون ترکیباتی است که ممکن است استرس ER را کاهش دهند یا ترشح انسولین را تقویت کنند. این ترکیبات میتوانند شامل مولکولهای کوچک تنظیمکنندهٔ UPR، داروهای تثبیتکنندهٔ پروتئین یا عوامل تسهیلکنندهٔ بستهبندی و ترشح وزیکولی انسولین باشند. افزون بر داروها، رویکردهای ژندرمانی یا ویرایش ژنومی هدفمند روی TMEM167A نیز در افق پژوهشهای پیشبالینی قرار دارند، هرچند کاربرد بالینی آنها نیازمند سالها ارزیابی ایمنی و اثربخشی است.
همچنین جای بررسی دارد که آیا تکنیکهای بازسازی سلول بتا بر پایهٔ سلولهای بنیادی انسانی میتوانند سلولهایی بدون جهش TMEM167A تولید کنند که برای پیوند به بیماران مناسب باشند، یا اینکه مداخلهٔ مولکولی قبل از پیوند لازم است تا از بروز استرس ER و از دست رفتن سلولها جلوگیری شود. رویکردهای ترکیبیِ دارویی-سلولی احتمالاً در بلندمدت بیشترین پتانسیل را برای بازگرداندن عملکرد انسولین در بیماران نشان خواهند داد.
در نهایت، اگرچه تبدیل این کشف به درمانهای بالینی ممکن است سالها زمان ببرد، مسیر مستقیم از کشف ژن به فهم مکانیکی و در ادامه به مداخلهٔ هدفمند، امیدهای روشنی برای توسعهٔ درمانهای نوآورانه فراهم میآورد. همزمان، ثبت و گزارش موارد جدید MEDS و تکمیل پایگاههای دادهٔ جهانی ژنتیکی برای انواع نادر دیابت حیاتی است تا توزیع انواع موتاسیونها، همدرآمد با فنوتیپ و پاسخ به مداخلات مشخص شود.
جمعبندی تحقیقات، پیشبینی مسیرهای پژوهشی آینده و همافزایی بین ژنتیک بالینی، زیستشناسی سلولی و داروشناسی، میتواند زمینهٔ توسعهٔ راهحلهای تشخیصی و درمانی را در حوزهٔ دیابت و بیماریهای متابولیک گسترش دهد. این مطالعه نمونهای از این است که چگونه بررسی دقیق موارد نادر میتواند به بینشهایی با دامنهٔ وسیعتر در سلامت عمومی و پزشکی تبدیل شود.
منبع: sciencealert

ارسال نظر