13 دقیقه
محققان ژاپنی مولکولهای نسل بعدی ویتامین K را طراحی و سنتز کردهاند که بهطور قابلتوجهی توانایی مغز در تولید نورونهای جدید را افزایش میدهد. با اتصال شیمیایی ویتامین K به اسید رتینوئیک، پژوهشگران مجموعهای از ترکیبات هیبریدی ساختند که القای تمایز نورونی را بسیار مؤثرتر از ویتامین K طبیعی انجام میدهند — نتیجهای که میتواند پیامدهایی مهم برای درمان آلزایمر و سایر بیماریهای نورودژنراتیو داشته باشد.
چرا بازسازی نورونی در حال حاضر اهمیت دارد
بیماریهای نورودژنراتیو مانند آلزایمر، پارکینسون و هانتینگتون بهتدریج نورونها — سلولهای پردازش اطلاعات در مغز — را از بین میبرند یا عملکرد آنها را مختل میکنند. با مرگ یا نارسایی نورونها، بیماران دچار اختلال حافظه، مشکلات حرکتی و کاهش سریع عملکرد شناختی میشوند. داروهای موجود عمدتاً علائم را تسکین میدهند و بهندرت میتوانند از دست رفتن نورونها را معکوس کنند. همین شکاف انگیزهای قوی برای جستجوی راهبردهای بازسازی ایجاد کرده است: اگر بتوان با تحریک پرژنیتورهای عصبی (سلولهای پیشساز) مغز را به تولید نورونهای جدید سوق داد، ممکن است مدارهای آسیبدیده تعمیر یا تثبیت شوند و روند پیشرفت بیماری کند شود.
ویتامین K، یک ماده مغذی محلول در چربی که عمدتاً بهخاطر نقش در انعقاد خون و متابولیسم استخوان شناخته شده است، در سالهای اخیر بهعنوان عاملی غیرمنتظره در عملکرد مغز مطرح شده است. مطالعات آزمایشگاهی برخی از اشکال ویتامین K را با بقای نورونها و ترویج تمایز نورونی مرتبط کردهاند. با این حال، انواع طبیعی مانند مناکینون-4 (MK-4) از نظر توانایی درمانی محدودیتهایی نشان دادهاند — همین موضوع محققان شیمی و علوم اعصاب را به پرسش کشاند که آیا بازطراحی مولکولی میتواند اثرات نورواکتیو ویتامین K را تقویت کند یا خیر.
طراحی ویتامین K توانمندتر
تیم پژوهشی مؤسسه فناوری شیبائورا در ژاپن دقیقاً بر همین هدف متمرکز شد. به سرپرستی دانشیار یوشیهیسا هیروتا و استاد یوشیتومو سوهارا، گروه مجموعهای از آنالوگهای هیبریدی ویتامین K را با اتصال شیمیایی چارچوبهای ویتامین K به اسید رتینوئیک — متابولیت فعال ویتامین A که بهخوبی برای ترویج تمایز نورونی شناخته شده است — سنتز کردند. این رویکرد بین رشتهای از شیمی دارویی، زیستشناسی سلولی و زیستفناوری اعصاب بهره برد تا ویژگیهای هر دو مولکول والد حفظ شود و در عین حال عملکرد جدیدی حاصل شود.
در مجموع، این گروه پانلی شامل 12 همولوگ هیبریدی را ایجاد کرد که ویتامین K را با واحد اسید رتینوئیک، گروه کربوکسیلیک یا یک زنجیره استر متیل ترکیب میکردند. هدف علمی دوگانه بود: نگه داشتن نشانههای بیولوژیک هر دو مولکول والد (ویتامین K و اسید رتینوئیک) و آزمایش این فرض که ساختار متصلشده ممکن است القای سرنوشت نورونی در سلولهای پیشساز عصبی را قدرتمندتر کند. طراحی ساختارها با توجه به پایداری شیمیایی، قابلیت ورود به سلول و احتمال تبدیل متابولیکی به شکل فعال در نظر گرفته شد تا نشانههای اولیه قابلاتکا برای توسعه بعدی فراهم شود.
با استفاده از فرهنگهای سلولی پیشسازهای عصبی موشی، تیم فعالسازی رونویسی دو گیرنده هستهای را ارزیابی کرد: گیرنده استروئید و زنو بایوتیک (SXR) که تحت تأثیر ویتامین K قرار میگیرد و گیرنده اسید رتینوئیک (RAR) که توسط اسید رتینوئیک فعال میشود. نکته مهم این بود که مولکولهای هیبریدی در هر دو گیرنده فعالیت خود را حفظ کردند، که نشان میداد واحد عملکردی هر مولکول پس از الحاق بیولوژیکی باقی مانده و قادر به تحریک مسیرهای ژنتیکی مرتبط با تمایز نورونی است. این نتیجه یک پایه مولکولی برای اثرات مشاهدهشده فراهم کرد و نشان داد که طراحی مولکولی میتواند فعالیتهای ترکیبی را در سلول هدف هماهنگ کند.
Novel VK: یک نامزد برجسته
در میان ترکیبات سنتزشده، یک هیبرید — که در مطالعه بهعنوان آنالوگ جدید ویتامین K (Novel VK) توصیف شد — توانمندی استثنایی نشان داد. این مولکول ترکیب واحد اسید رتینوئیک با یک زنجیره استر متیل بود و تمایز نورونی را تقریباً سهبرابر در مقایسه با ویتامین K طبیعی افزایش داد. پژوهشگران تبدیل سلولی به نورون را با ردیابی پروتئین مرتبط با میکروتوبول-2 (Map2) اندازهگیری کردند، نشانگری که بهخوبی برای نورونهای بالغ شناخته شده است. علاوه بر اندازهگیریهای مولکولی، ارزیابیهای مورفولوژیک و تغییرات در بیان ژنهای مرتبط با نورون بالغ، شواهد تضمیمنی ارائه دادند که تغییر سرنوشت سلولی واقعی رخ داده است.
این افزایش فعالیت بیش از یک کنجکاوی آزمایشگاهی است. مولکولی که بتواند بهطور قابلاعتمادی سلولهای پیشساز عصبی را به سرنوشت نورونی هدایت کند، میتواند بهعنوان یک عامل بازسازیکننده توسعه یابد تا سلولهای از دسترفته در پی نورودژنراسیون را جایگزین کند یا به ترمیم مدارهای آسیبدیده کمک نماید. از منظر داروشناسی و پزشکی بازساختی، چنین مولکولی میتواند نقطه آغازی برای کلاس جدیدی از درمانها با منشاء تغذیهای و با فعالیت مولکولی هدفمند باشد.
نگاهی به مکانیزم: mGluR1 و نشانههای اپیژنتیک
درک اینکه چگونه ویتامین K و آنالوگهای آن تمایز نورونی را تحریک میکنند، بخش مرکزی کار تیم بود. مقایسه الگوهای بیان ژن بین سلولهای تیمارشده با MK-4 و سلولهایی که در معرض مهارکنندهها قرار داشتند، یک شریک مولکولی غیرمنتظره را نشان داد: گیرندههای گلوتامات متابوتروپیک (mGluRs). بهویژه، mGluR1 بهعنوان میانجی کلیدی اثرات تنظیمی ژنی و اپیژنتیکی مرتبط با تصمیمگیری سرنوشت نورونی پدیدار شد. این ارتباط نشان میدهد که سیگنالدهی سطح سلولی از طریق گیرندههای سطحی میتواند به تغییرات پایدار در برنامههای رونویسی هستهای و الگوهای کروماتینی منجر شود.
mGluR1 یک گیرنده سطح سلولی است که برای تعدیل سیگنالینگ سیناپسی و آبشارهای داخلسلولی شناخته شده است. مطالعات حیوانی قبلی نشان دادهاند که حذف یا نقص عملکرد mGluR1 موجب اختلال در کنترل حرکتی و ارتباط بین نورونها میشود — فنوتایپهایی که برای بیماریهای نورودژنراتیو مرتبط هستند. گروه شیبائورا از مدلسازی ساختاری محاسباتی و داکینگ مولکولی استفاده کرد تا بررسی کند آیا آنالوگهای جدید ویتامین K میتوانند مستقیماً با mGluR1 تعامل داشته باشند یا خیر. شبیهسازیهای آنها از یک رابطه اتصال قوی بین Novel VK و mGluR1 حمایت کرد که با اثرات زیستی برجسته مشاهدهشده در آزمایشهای سلولی همخوانی داشت. این یافته مکانیزمی را پیشنهاد میدهد که در آن تعامل مولکول کوچک با گیرنده سطحی میتواند مسیرهای سیگنالینگ را فعال کند و در نهایت به اصلاح وضعیت اپیژنتیک و ارتقای تمایز منجر شود.
ورود سلولی و تبدیل به MK-4 فعال
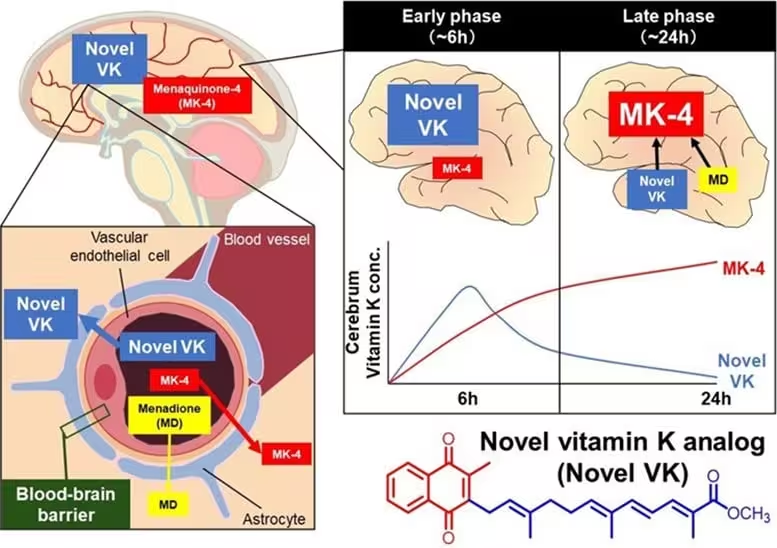
یافته مهم دیگری کارآمدی ورود Novel VK به درون سلولها و تبدیل آن به MK-4، شکل فعال داخلسلولی، بود. در فرهنگهای سلولی و در موشها، سطوح داخلسلولی MK-4 با افزایش مواجهه با Novel VK افزایش یافت. در مقایسه با ویتامین K استاندارد، این هیبرید با کارایی بیشتری به MK-4 تبدیل شد و غلظتهای بالاتری در مغز ایجاد کرد. بهطور بحرانی، مطالعات حیوانی نشان دادند که Novel VK از سد خونی-مغزی عبور میکند و نمایه فارماکوکینتیک مطلوبی نشان میدهد — ویژگیهایی اساسی برای هر نامزد دارویی که هدف آن سیستم عصبی مرکزی است.
محققان تأیید کردند که Novel VK سطحهای بالاتری از MK-4 فعال را در مغز نسبت به فرمولاسیونهای رایج ویتامین K تولید میکند و این یافته قوت بیشتری به این ادعا میدهد که بازطراحی شیمیایی نهتنها توانایی زیستی را افزایش میدهد بلکه دسترسی زیستی و ترکیببندی دارویی را بهبود میبخشد. این نکته برای توسعه دارویی اهمیت دارد زیرا به ترکیبی میانجامد که هم اثرگذار و هم در دسترس بافت هدف است.
پیامدهای ترجمهای: بهسوی درمانهای مبتنی بر ویتامین K
این نتایج مسیر مشخصی از زیستشناسی تغذیهای به داروهای احتمالی را روشن میکنند. با نگاشت گیرندهها و مسیرهای مولکولی درگیر، مطالعه هم یک ترکیب راهنما (Novel VK) و هم یک توضیح مکانیکی برای توسعه بیشتر فراهم میآورد. اگر کارهای پیشبالینی و بالینی بعدی ایمنی و کارایی را تایید کنند، داروهای مشتق از ویتامین K میتوانند به یک کلاس جدید از درمانهای بازساختی تبدیل شوند که هدف آنها کند کردن یا معکوس کردن از دست رفتن نورونها در آلزایمر و دیگر بیماریهای نورودژنراتیو است.
موانع عملی هنوز وجود دارد. هر نامزد درمانی باید تحت آزمایشهای سمیشناسی دقیق، بهینهسازی دوز و اثبات منافع بلندمدت در مدلهای حیوانی که پاتولوژی بیماری انسانی را بازتولید میکنند، قرار گیرد. طراحی کارآزماییها همچنین باید زمانبندی را در نظر بگیرد: استراتژیهای بازسازی احتمالاً در مراحل اولیه یا میانی بیماری موثرترند، زمانی که پیشسازهای عصبی و مدارهای باقیمانده هنوز توان پاسخدهی به سیگنالهای تمایز را دارند. علاوه بر این، تأثیرات داروها بر ایمنی سیستم عصبی، اختلالات ناشی از تحریک بیشازحد تمایز و پیامدهای طولانیمدت سلولهای تازهتولیدشده باید بهدقت مورد ارزیابی قرار گیرند.
دکتر یوشیهیسا هیروتا و همکاران بر ارزش وسیعتر این رویکرد تأکید میکنند: «آنالوگهای ما نشان میدهند که تغییرات شیمیایی نسبتاً کوچک میتوانند پتانسیل نوروژنتیک ویتامین K را بهطور چشمگیری افزایش دهند. این موضوع راههای جدیدی برای درمانهایی باز میکند که ایمنی ویتامینها را با فعالیت مولکولی هدفمند ترکیب میکنند.» تیم پژوهشی به لزوم مطالعات بیشتر در زمینه سمیت، متابولیسم، انتخابپذیری گیرنده و ارائه دارو اشاره کردهاند تا شانس موفقیت در مسیر ترجمه بالینی افزایش یابد.
محققان مؤسسه فناوری شیبائورا آنالوگهای جدید ویتامین K متصل به اسید رتینوئیک را طراحی و سنتز کردهاند که فعالیتهای قوی در القای تمایز نورونی نشان میدهند. یافتههای آنها مکانیزمهای منحصر بهفرد زیربنایی اثرات نورحفاظتی ویتامین K و آنالوگهای آن را برجسته میسازند و مسیر را برای توسعه درمانهای مؤثر علیه بیماریهای نورودژنراتیو هموار میکنند. اعتبار: دانشیار یوشیهیسا هیروتا، مؤسسه فناوری شیبائورا، ژاپن
این یافتهها برای بیماران و چرخه پژوهشی چه معنایی دارد
برای بیماران و مراقبانی که با آلزایمر و اختلالات مرتبط مواجهاند، این پژوهش بیشتر نمایانگر امید است تا درمان فوری. تأثیر نزدیکمدت مهمتر احتمالاً بر پژوهشهای پیشبالینی خواهد بود: در دسترس بودن یک آنالوگ ویتامین K قوی و قادر به نفوذ به مغز به آزمایشگاهها ابزاری جدید میدهد تا بازسازی نورونی، ترمیم سیناپسی و مدلهای بیماریمحور را عمیقتر بررسی کنند. این ابزار میتواند سرعت و دقت مطالعات مکانیکی و درمانی را افزایش دهد و به توسعه بیومارکرهای مرتبط با نورونزایی و بهبود معیارهای سنجش اثرات درمانی کمک کند.
در سطح جمعیتی، یک درمان بازسازیکننده مؤثر میتواند در درازمدت نیازهای مراقبت طولانیمدت و هزینههای بهداشتی مرتبط با زوال عقل پیشرونده را کاهش دهد. با این حال، ترجمه موفقیت آزمایشگاهی به درمانهای انسانی ایمن و مؤثر معمولاً سالها و مراحل پیوسته ارزیابی را میطلبد. از جمله چالشها میتوان به ریسکهای بالینی، پیچیدگی انجام کارآزماییها در جمعیتهای سالمندی و نیاز به نشانگرهای زیستی معتبر برای نشان دادن نئوروژنز عملکردی اشاره کرد.

تصویر روی جلد مربوط به مطالعه درباره آنالوگهای جدید ویتامین K متصل به اسید رتینوئیک است که اثرات نورمحافظتی نشان میدهند. اعتبار: ACS Chemical Neuroscience
دیدگاه کارشناسی
«این مطالعه بهشیوهای زیبا پل میان شیمی مولکولی کوچک و زیستشناسی عصبی را میسازد»، میگوید دکتر النور پارک، نوروفارماکولوژیست و ارتباطدهنده علمی (شخصیت فرضی). «دو جنبه برجستهاند: طراحی منطقی برای ترکیب موتیفهای ویتامین K و اسید رتینوئیک، و ارتباط مکانیکی با mGluR1. این دو با هم داستانی منسجم از مولکول تا مکانیزم خلق میکنند. گامهای بحرانی بعدی شامل اثبات منافع بلندمدت در مدلهای حیوانی مرتبط با بیماری و تضمین ایمنی در دوزهای درمانی است.»
دکتر پارک اضافه میکند، «بهندرت پیش میآید که ترکیبات مشتق از مواد مغذی هم از سد خونی-مغزی عبور کنند و هم مسیرهای تمایز را بهاینگونه قوی تغییر دهند. اگر این خصوصیات در مطالعات مستقل نیز تأیید شوند، نتیجه میتواند روش ما در مواجهه با نئوروژنز بازساختی را تغییر دهد.»
نگاهی به جلو: اولویتهای پژوهشی و چشمانداز آینده
- گسترش آزمونهای پیشبالینی در مدلهای حیوانی آلزایمر و پارکینسون برای ارزیابی نتایج شناختی و حرکتی پس از درمان با Novel VK و سایر آنالوگها.
- بررسی ایمنی بلندمدت، اثرات بالقوه خارجهدف و فارماکودینامیک در گروههای سنی و مراحل بیماری مختلف.
- اصلاح شیمی ترکیبات برای بهینهسازی رسانش به مغز، پایداری متابولیکی و انتخابپذیری گیرنده.
- طراحی کارآزماییهای فاز اولیه بالینی متمرکز بر ایمنی، نشانگرهای زیستی بازسازی نورونی و پیامدهای عملکردی در جمعیتهای بیمار با انتخاب دقیق.
بهاختصار، مطالعه مؤسسه فناوری شیبائورا یک اثبات مفهوم قانعکننده ارائه میدهد: آنالوگهای شیمیاییشده ویتامین K میتوانند محرکهای قدرتمندی برای تمایز نورونی باشند، با گیرندههای عصبی معناداری مانند mGluR1 تعامل کنند، از سد خونی-مغزی عبور نمایند و مقدار MK-4 فعال را در مغز افزایش دهند. اینها مؤلفههای ضروری برای یک نامزد درمانی امیدوارکنندهاند، هرچند که نیاز به سالها آزمون دقیق قبل از ورود به بازار و کاربرد بالینی دارند.
منبع: scitechdaily


ارسال نظر