10 دقیقه
پژوهشگران از انجام اولین پیوند سلولهای بنیادی در انسان گزارش دادهاند که به نظر میرسد بتواند در برخی بزرگسالان مسن مبتلا به تباهی لکه زالویی وابسته به سن از نوع خشک (AMD خشک) بینایی مرکزی را تا حدی بازگرداند. دادههای فازهای اولیه کارآزمایی بالینی نشان میدهد این روش در مرحله کنونی ایمن است و در شرکتکنندگان با بیشترین کاهش بینایی، بهبودیهای معنیداری در دید ایجاد کرده است؛ نتایجی که محققان را به آزمایشهای بیشتر با دوزهای بالاتر تشویق کرده است. این گزارش شامل جزئیات ایمنی، نتایج اولیه کارآیی و مسیر پیشروی پژوهش برای توسعه بالینی این رویکرد درمانی بازسازیکننده شبکیه است.
چرا بینایی مرکزی در AMD خشک تحلیل میرود — و اهمیت آن
تباهی لکه زالویی وابسته به سن یا AMD یکی از علل اصلی از دست دادن غیرقابل بازگشت بینایی مرکزی در جمعیت سالمندان است. «ماکولا» بخش کوچک و مرکزی شبکیه است که مسئول دید دقیق و وظایفی است که به تمرکز تیز نیاز دارند؛ خواندن، تشخیص چهرهها، رانندگی و انجام کارهای ظریف روزمره. در شکل خشک AMD، که حدود 80٪ موارد را تشکیل میدهد، رسوبات ریز چربی و پروتئین که به آنها دروزن (drusen) گفته میشود، در زیر اپیتلیوم رنگدانهای شبکیه (RPE) تجمع مییابد. این تجمع تدریجی باعث آسیب به سلولهای RPE میشود — بافت حمایتی که نورونهای حساس به نور یا فتورسپتورها را تغذیه و حفظ میکند — و با از دست رفتن پیشرونده این سلولها، میدان دید مرکزی به تدریج محو و تار میشود.
اهمیت این پروسه از آنجا ناشی میشود که بخش عمدهٔ کیفیت زندگی روزمره وابسته به عملکرد ماکولا است. کاهش دید مرکزی نه تنها توانایی خواندن و تشخیص چهرهها را مختل میکند، بلکه استقلال فردی را هم کاهش میدهد و نیاز به کمکهای بینایی کمّی (low-vision aids) و تغییر در سبک زندگی را افزایش میدهد. از سوی دیگر، فقدان گزینههای درمانی موثر برای AMD خشک، افزایش توجه به درمانهای بازسازیکننده شبکیه مانند پیوند سلولهای RPE را موجب شده است.
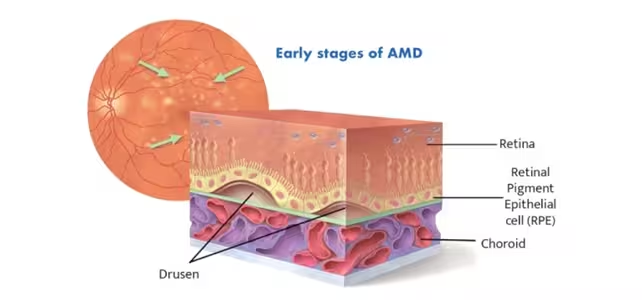
نموداری که مراحل اولیهٔ تباهی لکه زالویی خشک را نشان میدهد؛ این وضعیت ناشی از تجمع رسوبات چربی و پروتئینی موسوم به دروزن در زیر اپیتلیوم رنگدانهای شبکیه (RPE) است.
چه چیزی در کارآزمایی جدید آزموده شد و روش چگونه عمل میکند
مطالعهٔ منتشرشدهٔ فاز 1/2a، پیوند سلولهای RPE مشتق از سلولهای بنیادی بالغ را ارزیابی کرده است؛ این سلولها از طریق یک بانک چشم تهیه شدهاند. هدف از این مرحله بررسی ایمنی و اثربخشی اولیه بود و نه مقایسهٔ مستقیم با درمانهای موجود. پژوهشگران 18 داوطلب بالقوه را غربالگری کردند و در نهایت شش داوطلب 71 تا 86 ساله را که در یک چشم مبتلا به AMD خشک پیشرفته بودند، ثبتنام کردند. معیارهای ورود، نبود بیماریهای فعال التهابی سیستمیک و شرایط پزشکی ناتوانکنندهٔ دیگر، و وجود کاهش بینایی مشخص در یک چشم بود تا بتوان اثرات موضعی پیوند را ارزیابی کرد.
نحوه تزریق و تعیین دوز
هر شرکتکننده یک دوز منفرد و نسبتاً پایین شامل 50,000 سلول RPE مشتق از سلولهای بنیادی دریافت کرد که تحت شبکیه و در ناحیهٔ ماکولا، بخش فوقانی-تمپورال (superior temporal macula) چشمی که دید بدتری داشت، تزریق شد. هدف از انتقال این سلولها جایگزینی بافت آسیبدیدهٔ RPE و بازسازی میکرومحیط لازم برای حفظ عملکرد فتورسپتورها است. تکنیک جراحی معمولاً شامل ویترکتومی پاراسنتز و ایجاد یک فضای کوچک زیرشبکیه از طریق ریتینوتومی است تا سلولها بتوانند به محل صحیح پیوند یابند. انتخاب دوز اولیه پایین با هدف ارزیابی ایمنی و پذیرش بافتی آغاز شد؛ در ادامه برنامه مطالعاتی دوزهای بالاتر نیز برای بررسی رابطه دوز-پاسخ در دست مطالعهاند.
مطالعات آزمایشگاهی اولیه و کنترلهای ایمنی
مطالعات پیشبالینی نشان داده بود که سلولهای پیوندی هویت شبکیهای خود را حفظ میکنند و خصوصیات اپیتلیال رنگدانهای را بروز میدهند، و در شرایط آزمایشگاهی تومورزا یا سمی بودن سیستمیک از خود نشان ندادند؛ این نتایج مسیر را برای آغاز آزمایش روی انسان هموار ساخت. در فاز بالینی، تیم پژوهشی شرکتکنندگان را از نظر واکنشهای ایمنی موضعی و سیستمیک، تشکیل تومور یا ضایعات غیرمعمول و عوارض شناختهشدهٔ جراحی شبکیه به دقت تحت پایش قرار دادند. پایشهای طولانیمدت شامل تصویربرداریهای OCT، فلورسانس آنژیوگرافی، معاینات بیناییسنجی و آزمایشات خون برای نشانگرهای التهابی بود تا هم ایمنی و هم بقا و انسجام پیوندی اندازهگیری شود.
نتایج کلیدی: اول ایمنی، و بهطور غیرمنتظره بهبود بینایی
کارآزمایی معیارهای اصلی ایمنی را برآورده کرد. هیچ رویداد نامطلوب مستقیمی که به سلولهای بنیادی پیوندی نسبت داده شود مشاهده نشد — گزارشی از تشکیل تومور یا شواهد رد ایمنی مرتبط با خود محصول سلولی وجود نداشت. برخی شرکتکنندگان دچار عوارض جراحی متداول مانند التهاب موضعی یا نیاز به نگرشهای درمانی مکمل شدند، اما این موارد قابل کنترل بودند و به محصول سلولی مرتبط تشخیص داده نشدند. این دادههای اولیه، سیگنال مهمی دربارهٔ ایمنی مقدماتی پیوند ارائه میدهند، بهویژه هنگامی که قرار است دوزها افزایش یابد.
در زمینه اثربخشی، یافتهای که محققان را شگفتزده کرد، بهبود بینایی بود که محدود به چشم درمانشده بود. سه شرکتکنندهای که در آغاز مطالعه کمترین تیزبینی را داشتند (در حدود بینایی 20/200 تا 20/800) بهطور میانگین به اندازهٔ 21 حرف در جدول سنجش دید (eye chart) طی یک سال پس از تزریق پیشرفت کردند؛ این بهبود از نظر بالینی معنادار تلقی میشود. سه شرکتکنندهٔ دیگر که بینایی بهتری در ابتدا داشتند (تقریباً بین 20/70 تا 20/200) بهبودهای کمتری نشان دادند. این الگوی بهبودی یکطرفه — تنها در چشمی که سلول دریافت کرده بود — قوت بخشید به این فرض که خود پیوند نقش مهمی در بازیابی عملکرد بینایی ایفا کرده است، زیرا اگر اثرات ناشی از فاکتور سیستمی یا رویکردهای حمایتی عمومی بود، انتظار میرفت هر دو چشم مشابه عمل کنند.
راجش رائو، پزشک-پژوهشگر و چشمپزشک در Michigan Medicine، در اینباره گفت: «اگرچه از دادههای ایمنی رضایت داشتیم، بخش هیجانانگیز ماجرا این بود که بینایی این بیماران نیز در حال بهبود بود. شدت بهبودی بینایی در بیماران شدیداً مبتلا که پیوند RPE مشتق از سلول بنیادی بالغ دریافت کردند، برای ما تعجبآور بود. این سطح از بهبود در این گروه از بیماران با AMD خشک پیشرفته تا کنون دیده نشده بود.» این نظرات بازتابدهندهٔ اهمیت ترکیب دادههای ایمنی و سیگنالهای اولیهٔ اثربخشی است که مسیر مطالعات بعدی را شکل میدهد.
این نتایج برای بیماران چه مفهومی دارد و گامهای بعدی پژوهش
این یافتهها امیدوارکننده اما مقدماتی هستند. اندازهٔ نمونهٔ کوچک (شش شرکتکننده با دوز پایین) ضرورتاً به این معنی است که برای تأیید فواید مشاهدهشده، اندازهگیری ماندگاری اثر و مقایسه با درمانهای فعلی یا در حال ظهور، نیاز به کارآزماییهای تصادفی و بزرگتر است. مطالعه همچنان در حال پیگیری گروههایی است که دوزهای بالاتر — 150,000 و 250,000 سلول — را دریافت میکنند تا مشخص شود آیا افزایش دوز همچنان ایمن است و آیا میتواند اثربخشی را بهبود دهد یا خیر. ارزیابی رابطهٔ دوز-پاسخ، بقای سلولهای پیوندی و یکپارچگی طولانیمدت آنها در ساختار پیچیدهٔ شبکیه از اولویتهای پژوهشی بعدی خواهد بود.
اگر دوزهای بالاتر نیز ایمن باشند و به همان اندازه یا بیشتر موجب بازیابی بینایی شوند، تیم پژوهشی طراحی کارآزمایی فاز 3 را برای مقایسهٔ درمان با استاندارد مراقبت فعلی آغاز خواهد کرد. حتی در آن مرحله نیز فرایندهای نظارتی، افزایش تولید در مقیاس صنعتی، تدارکات بانک سلولی، و دسترسی بیماران به درمان زمانبر خواهد بود و ممکن است چندین سال طول بکشد تا این روش به عنوان درمانی در دسترس قرار گیرد. علاوه بر این، مسائل مربوط به هزینه، پوشش بیمهای و آموزش جراحان و مراکز برای اجرای پروتکلها از چالشهای عملیاتی مهم در مسیر ترجمه از مطالعه به درمان کلینیکی هستند.
فناوریهای مرتبط و زمینهٔ بالینی
پیوندهای RPE مشتق از سلولهای بنیادی بخشی از مجموعهای رو به رشد از رویکردهای بازسازیکننده در بیماریهای شبکیه هستند؛ این طیف از درمانها شامل ژندرمانی برای اصلاح نقصهای مولکولی، ایمپلنتهای ورقهای سلولی (cell-sheet implants)، استراتژیهای دارورسانی موضعی برای کند کردن فرایند تحلیل، و حتی پروتزهای شبکیه میشود. هدف کلی این رویکردها یا حفظ دید باقیمانده و یا بازگرداندن عملکرد پس از از بین رفتن سلولها است. ترکیب تکنولوژیها — برای مثال ترکیب ژندرمانی با پیوند سلولی یا استفاده از داروهای حمایتکنندهٔ سلولی پس از پیوند — ممکن است راهکارهای جامعتری برای مدیریت AMD خشک ارائه دهد.
برای بیماران مبتلا به AMD خشک که در حال حاضر گزینههای محدودی فراتر از تغییرات سبک زندگی، کمکهای بینایی کمّی و مراقبت حمایتی در دسترس دارند، وجود یک پیوند RPE ایمن و مؤثر میتواند رویکرد درمانی را از کاهش زیان به سمت بازسازی جزئی عملکرد تغییر دهد. با این حال، ارزیابی طولانیمدت بقا، عملکرد فیزیولوژیک سلولهای پیوندی و پیامدهای کیفی زندگی بیماران برای ارزیابی نهایی اهمیت دارد.
دیدگاه یک کارشناس
«یک پیوند هدفمند RPE نقطهٔ مشخصی از شکست در AMD خشک را هدف میگیرد: از دست رفتن سلولهای اپیتلیال رنگدانهای حمایتی،» دکتر النا مورالس، جراح شبکیه و دانشمند ترجمهای، میگوید. «اگر بتوانیم این سلولها را بهطور قابل اعتماد و بدون ایجاد مشکلات ایمنی یا خطرات تومورزا جایگزین کنیم، سودِ رودررویی برای فتورسپتورها میتواند قابلتوجه باشد. موانع بعدی تکرارپذیری نتایج و یکپارچگی بلندمدت سلولهای پیوندی در معماری پیچیدهٔ شبکیه است.»
بهعقیدهٔ کارشناسان، ترکیب معیارهای دقیق آزمایشگاهی و بالینی، طراحی کارآزماییهایی با توان آماری کافی، و شفافیت در گزارش دادهها — از ایمنی تا نتایج عملکردی و کیفیت زندگی — کلید پیشروی ایمن و مؤثر به سوی یک درمان بازسازیکننده برای AMD خشک خواهد بود. همچنین توجه به استانداردهای تولید سلول، ردپای زیستی و رگولاتوری، و تدوین پروتکلهای آموزشی برای جراحان از اهمیت عملیاتی برخوردار است.
منبع: sciencealert
نظرات
دانیکس
اگر این واقعا تکرارپذیر باشه، زندگی خیلیا بهبود پیدا میکنه. زود قضاوت نکنیم، ولی هیجانانگیزه.
مکس_ای
احساس میکنم کمی بیش از حد موج سواری شده، اما برای بیماران شدید خبر خوبیِ، آمار بزرگتر لازمه
آرمین
خیلی متوازن نوشته شده؛ هم امید هست هم احتیاط. منتظر دادههای دوزهای بالاتر میمونم.
بیونیکس
تو آزمایشگاه دیدم سلولها گاهی رفتار متفاوتی نشون میدن، خوشحالم که تو انسان هم سیگنال دیده شده...
توربو
این گزارش قابل توجهه ولی واقعا نمونهٔ ۶ نفر قابل قیاس هست؟ کنترل تصادفی کجاست؟
کوینپ
به نظر منطقیه، ولی هزینه و دسترسی رو خیلی باید در نظر گرفت. هنوز زوده
رودکس
وااای، این واقعاً نوآورانهست! اما میترسم عوارض بلندمدت چطور میشه... اگر واقعا دوام بیاره زندگی خیلیا عوض میشه

ارسال نظر