8 دقیقه
پژوهش تازه نشان میدهد زیرمجموعهای از سلولهای ایمنی ساکن مغز قادرند به یک حالت محافظتی تبدیل شوند که در مدلهای موشی پیشرفت الگوهای شناختهشده بیماری آلزایمر را کند میکند. شناخت این «تغییر وضعیت» یا سوئیچ میتواند مسیرهای ایمونوتراپی را برای وادار کردن مدافعان طبیعی مغز به مقابله با بیماری باز کند.
وقتی مدافعان به محافظ تبدیل میشوند: نقش شگفتآور میکروگلیا
میکروگلیاها سلولهای ایمنی ساکن سیستم عصبی مرکزی هستند: آنها ضایعات را پاک میکنند، سیناپسها را ترمیم و شاخهبندی میکنند و به آسیب و تهدیدات پاسخ میدهند. در بیماری آلزایمر عملکرد میکروگلیاها گاهی متناقض بهنظر میرسد — در برخی شرایط پروتئینهای سمی را پاکسازی میکنند و در شرایط دیگر با تشدید التهاب نورونی به آسیب کمک میکنند. یک تیم بینالمللی به سرپرستی نوروساینتیست پینار آیاتا از Icahn School of Medicine تلاش کردهاند تا چگونگی تغییر وضعیت میکروگلیاها بین این حالتهای متضاد را در مدلهای موشی آلزایمر نقشهبرداری کنند.
با استفاده از پروفایلینگ مولکولی دقیقِ تکسلولی، تصویربرداری با وضوح بالا و ترکیب دادههای ریزبیانشناسی، پژوهشگران دریافتند میکروگلیاهایی که به سمت خوشههای پروتئین آمیلوئید-بتا مهاجرت میکنند — که از شاخصههای بیماری آلزایمر محسوب میشود — میتوانند وارد یک حالت اختصاصی نورحفاظتی شوند. در این وضعیتِ مولکولی، این سلولها هم سرعت تجمع آمیلوئید را کند میکنند و هم تجمع تائو (tau) را محدود میسازند؛ دو فرآیند پروتئینیِ سمی که بیشترین ارتباط را با افت شناختی دارند.
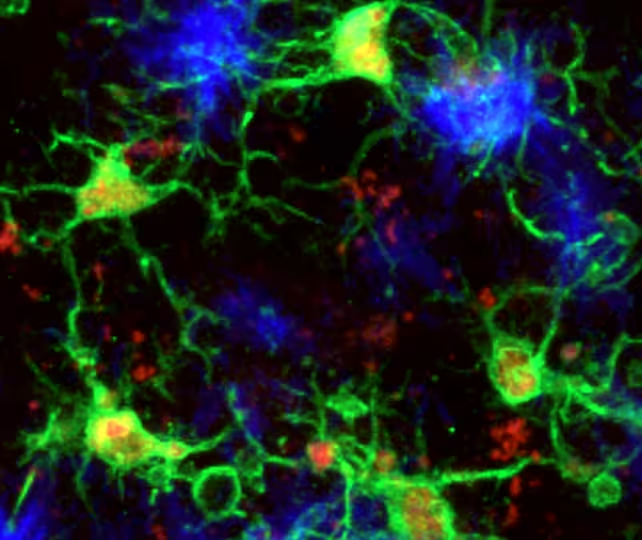
میکروگلیا (سبز) در پاسخ به پلاکهای آمیلوئید-بتا (آبی) در مغز موش.
نتایج این مطالعه با تحلیلهای تصویربرداری زنده (in vivo imaging) و تعیین حالتهای بیان ژنی پشتیبانی شد؛ بهطوری که تصویرسازی نشان داد جمعیتهای خاصی از میکروگلیاها بهصورت پایدار به اطراف پلاکها تجمع مییابند و الگوی بیان ژنی آنها با میکروگلیاهای «التهابی» تفاوت معناداری دارد. این دادهها به درک بهتر نقش میکروگلیا در مسیرهای مولکولی آمیلوئید و تائو کمک میکند و برای توسعه درمانهای هدفمند و ایمن ضروری است.
PU.1 و CD28: نشانگر مولکولی حفاظت
میکروگلیاهای محافظ دو ویژگی مولکولی کلیدی مشترک دارند: کاهش سطح فاکتور رونویسی PU.1 و افزایش بیان CD28، گیرندهای که اغلب با سلولهای T محیطی مرتبط است. وقتی میکروگلیاها این ترکیب بیان ژنی را نشان میدهند، در مدلهای موشی توانایی بهتری برای محدود کردن رشد پلاکهای آمیلوئید-بتا و سرکوب تجمع تائو از خود نشان میدهند.
برای بررسی رابطه علت و معلولی، تیم پژوهشی تولید CD28 را در موشها بهصورت ژنتیکی مهار کرد. نتیجه بازگشت به سوی فنوتیپهای التهابیتر میکروگلیا، افزایش پلاکهای آمیلوئید و از دست رفتن واضح حالت محافظتی بود. این مداخلات ژنتیکی استدلال را تقویت میکنند که سطوح CD28 و PU.1 میتوانند تعیینکننده باشند که آیا میکروگلیاها بهعنوان نگهبان عمل میکنند یا به تقویت آسیب التهابی کمک مینمایند.
شواهد ژنتیکی انسانی نیز این زیستشناسی را پشتیبانی میکند: افرادی که واریانتهای طبیعیای دارند که به کاهش بیان PU.1 در نوعهای سلولی خاص مغز منجر میشود، تمایل دارند آلزایمر را دیرتر از میانگین مبتلا شوند. این همبستگی یک ارتباط مکانیکی محتمل بین توالیهای ژنی و زمانبندی بروز بیماری ارائه میدهد و میتواند راهنمایی برای تعیین اهداف درمانی ژنتیکی یا اپیژنتیکی باشد.
در چارچوب زیستپزشکی، PU.1 یک فاکتور رونویسی مهم در توسعه و عملکرد سلولهای ایمنی است و تغییر سطح آن میتواند شبکههای تنظیمی گستردهای را در میکروگلیا دستخوش تحول کند. CD28 نیز بهعنوان یک مولکول همآمیزی (co-stimulatory) شناخته میشود؛ مشاهده نقش آن در میکروگلیا نشان میدهد که عناصر اختصاصی ایمنی محیطی ممکن است در تنظیم هویت ایمنی مرکزی هم نقش داشته باشند.
این یافتهها چه معنایی برای درمانها و پژوهشهای آتی دارند
تبدیل میکروگلیا به محافظان طولانیمدت ایدهای جذاب برای درمانهای نوین آلزایمر است، اما ملاحظاتی نیز به همراه دارد. آلزایمر یک بیماری چندعاملی است — ژنتیک، محیط، سلامت عروقی و پیری همه در آن نقش دارند. هر درمان موفق احتمالا باید همزمان چند هدف را مورد توجه قرار دهد و با رویکردهای ترکیبی (مثل داروهای هدفمند، آنتیبادیها و تغییر سبک زندگی) همراه شود.
- ایمونومدولاسیون: طراحی داروها یا بیولوژیکهایی که سیگنالینگ CD28 را در میکروگلیا افزایش دهند یا PU.1 را بهصورت موضعی تنظیم کنند میتواند سلولها را به سمت حالت محافظتی سوق دهد؛ این شامل داروهای کوچک مولکول، RNA درمانی یا محرکهای اپیژنتیک است.
- ایمنی و اختصاصیت: درمانها باید از تحریک گسترده سیستم ایمنی جلوگیری کنند چون افزایش غیرمنتظره فعالیت ایمنی میتواند التهاب عصبی را تشدید و وضعیت بالینی را بدتر کند؛ بنابراین هدفگیری سلولی دقیق و استفاده از حاملها یا روشهای تحویل محلی اهمیت دارد.
- ترجمهپذیری: میکروگلیاهای موش و انسان شباهتهایی دارند اما یکسان نیستند — اثبات وجود همان برنامه محافظتی در انسانها گام حیاتی بعدی است و نیازمند مطالعات بافتشناسی انسانی، دادههای یکسلولی انسانی و مدلهای پیشبالینی پیچیدهتر است.
در کنار این موارد، پژوهشگران به ضرورت تعیین بیومارکرهای قابل اندازهگیری تاکید میکنند که نشاندهنده فعال شدن حالت محافظتی میکروگلیا در انسان باشد؛ این بیومارکرها میتوانند شامل پروتئینهای سیرولوژیک، فاکتورهای التهابی اختصاصی، یا نشانههای تصویربرداری PET برای CD28 یا تغییرات اپیژنتیک باشند.
متخصصانی که در این مطالعه نقل قول شدهاند، هم وعده درمانی و هم احتیاط را برجسته میکنند. آن شافر از Icahn School of Medicine اشاره میکند که میکروگلیاها «فقط پاسخدهندگان مخرب در بیماری آلزایمر نیستند — آنها میتوانند به محافظان مغز تبدیل شوند»، و ژنتیکدان الیسون گوت میگوید که این کار به توضیح این موضوع کمک میکند که چرا سطوح پایینتر PU.1 با خطر کمتر آلزایمر مرتبط است. اپیژنتیست الکساندر تاراخوفسکی از دانشگاه راکفلر نیز این یافته را به تنظیم ایمنی وسیعتر ربط میدهد و پیشنهاد میکند میکروگلیاهای محافظ مغز مشابه سلولهای تنظیمی T (regulatory T cells) در سایر بافتها عمل میکنند.
دیدگاه تخصصی
«این مطالعه قطعه مهمی به پازل آلزایمر اضافه میکند با نشان دادن اینکه هویت ایمنی در مغز میتواند مفید باشد نه صرفاً مضر»، دکتر مایا الفنباین، نورواِمونولوژیست و مروّج علمی، میگوید. «چالش اکنون دوگانه است: اول اثبات اینکه همان مکانیسم در انسانها عمل میکند و دوم توسعه روشهای دقیق برای تبدیل میکروگلیاها به آن حالت محافظتی بدون تحریک التهاب مضر.»
بهسمت جلو، پژوهش در مسیر ارائه راهبردهای ایمونوتراپوتیک قرار دارد که آلزایمر را نه تنها با پاکسازی پروتئینها بلکه با بازبرنامهریزی سلولهای ایمنی مغز درمان کنند. این مسیر میتواند مکمل روشهایی مانند درمانهای آنتیبادی، مولکولهای کوچک هدفگیرنده تائو و مداخلات سبکزندگی موثر بر ریسک شود. بهعلاوه، ترکیب استراتژیهای ایمنی با درمانهای بازترمیمی نورونی (neurorestorative) احتمالاً نتایج بهتری خواهد داشت.
با اینکه این دفاع میکروگلیالی یک سد طبیعی امیدوارکننده است، نویسندگان تاکید میکنند که بهتنهایی برای متوقفسازی پیشرفت بیماری کافی نیست. اما تبدیل میکروگلیا به محافظانی که بتوانند عملکرد طولانیمدت و هدفمند داشته باشند — اگر در انسانها قابل دستیابی باشد — ابزار قدرتمندی به جعبهابزار پژوهش و درمان آلزایمر اضافه خواهد کرد.
در ادامه پژوهشها لازم است مطالعات طولی بالینی و پیشبالینی انجام شود تا پایداری حالت محافظتی، اثرات بلندمدت تغییر PU.1 و CD28 و تعامل این مسیرها با سایر عوامل خطر مانند دیابت، بیماریهای عروقی و شیوه زندگی بررسی گردد. همچنین توسعه آزمونهای تشخیصی حساس برای شناسایی بیماران مناسب برای درمانهای مبتنی بر میکروگلیا و نظارت بر پاسخ درمانی ضروری است.
در سطح فنیتر، استفاده از فناوریهای امروزی مانند تکسلولی RNA-seq، ATAC-seq برای بررسی دسترسی کروماتینی، پروتئومیکس و تصویربرداری مولکولی چندرنگ، توانایی شناسایی امضاهای مولکولی دقیق میکروگلیاهای محافظ را فراهم میآورد. این اطلاعات میتواند مبنای طراحی داروهای نوین، ویرایش ژن هدفمند یا رویکردهای سلولی مبتنی بر انتقال سلول (cell therapy) شود.
از منظر بالینی و مقرراتی، هر راهبردی که به تغییر وضعیت ایمنی مغز میانجامد باید با دقت از لحاظ عوارض سیستمیک، خطر خودایمنی و پیامدهای احتمالی روی حافظه و شناخت ارزیابی شود. حفظ تعادل بین فعالیت محافظتی و جلوگیری از التهاب مضر کلید توسعه درمانهای موفق و ایمن است.
منبع: sciencealert
نظرات
پمپزون
دیدگاه متعادلیه؛ ترکیب ایمنی با بازترمیمی منطقیه. ولی بیومارکرهای قابلاعتماد سخت بهدست میان...
ماکس_ای
جالب، اما احساس میکنم کمی پرهیاهو بیان شده، نیاز به دادهٔ انسانی بیشتره، خطر التهاب هم جدیه.
دیتاپالس
معقول بنظر میاد، اما باید با درمانهای دیگه ترکیب بشه، نه یه راهکار تنها. سرعت ترجمه مهمه
آرشام
واقعاً تو انسان هم همین برنامه محافظتی هست؟ شواهد موش قویان ولی ترجمهپذیری هنوز یه سؤال بزرگه.
بیوانیکس
وای، نمیدونستم میکروگلیا میتونن محافظ باشن! اگه این رویم ثابت بشه تحولی بزرگه، ولی نگران عوارض التهابی هم هستم...

ارسال نظر