7 دقیقه
یک تحلیل ژنتیکی تازه نشان میدهد که افزایشهای سریع قند خون در دو ساعت بعد از خوردن غذا — که معمولاً «قند خون پساوعده» یا «افزایش گلوکز دو ساعته» نامیده میشود — ممکن است با افزایش قابلتوجه خطر ابتلا به بیماری آلزایمر مرتبط باشد. این یافته جزئیات جدیدی به تصویری پیچیده میافزاید که دیابت، عملکرد انسولین و زوال عقل را به هم پیوند میدهد و کنترل قند خون بعد از صرف غذا را بهعنوان یک هدف احتمالی پیشگیری مطرح میکند.
What the study did and found
پژوهشگران در بریتانیا دادههای ژنتیکی 357,883 نفر را بررسی کردند تا ببینند آیا ژنهایی که افراد را مستعد افزایش بالاتر گلوکز دو ساعته پس از بارگذاری گلوکز (2hPG) میکنند، احتمال ابتلا به آلزایمر را در آینده نیز افزایش میدهند یا خیر. تیم تحقیقاتی بهجای اندازهگیری مستقیم قند خون در زمان مصرف، از روش «مندلیال رندومیزیشن» (Mendelian randomization) استفاده کرد؛ روشی که از واریانتهای ژنتیکی ارثی بهعنوان نمایندهٔ مواجههٔ مادامالعمر با یک صفت بهره میبرد — در این مطالعه، تمایل به تجربهٔ جهشهای گذرا در سطح گلوکز بعد از وعدههای غذایی.
مندیلیال رندومیزیشن بهدلیل اینکه تنوع ژنتیکی از زمان لقاح تخصیص یافته و تحت تأثیر سبک زندگی یا بیماریهای بعدی قرار نمیگیرد، میتواند استدلالهای علی را تقویت کند و سوگیریهای ناشی از علیت معکوس یا سبک زندگی را کاهش دهد. این رویکرد بهویژه هنگامی که میخواهیم رابطهٔ سببی بالقوه بین نشانگرهای متابولیک (مثل قند پساوعده یا مقاومت به انسولین) و بیماریهای مزمن عصبی مانند آلزایمر را ارزیابی کنیم، مفید است.
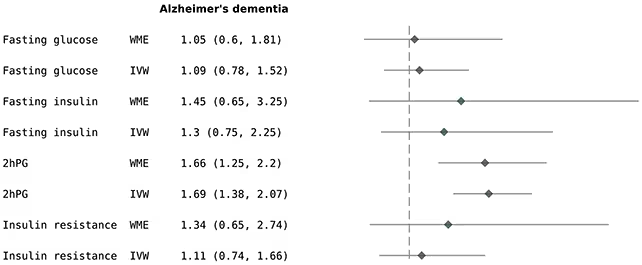
تحلیل نشان داد که گرایش ژنتیکی به قند خون بالاتر در دو ساعت پس از بارگذاری گلوکز با حدود 69٪ افزایش خطر آلزایمر همراه بوده است. نکتهٔ قابلتوجه اینکه مطالعه ارتباط مشابهی بین قند خون ناشتا، سطوح پایهٔ انسولین یا معیارهای عمومیتر مقاومت به انسولین با آلزایمر یا زوال عقل بهطور کلی نیافت. این الگو اشاره میکند که ممکن است جهشهای گذرای گلوکز بعد از غذا — نه سطح قند ثابت یا صرفاً مقاومت به انسولین — در دادههای این مجموعه بیشترین ارتباط را با خطر آلزایمر داشته باشند.
Methods, brain imaging, and unanswered questions
در بخشی از این کار، زیرمجموعهای از شرکتکنندگان اسکنهای مغزی (MRI) در اختیار محققان بود. آن دادههای تصویربرداری ارتباط آشکاری بین نشانگرهای گلوکز یا انسولین و تغییرات ساختاری واضح مانند کاهش حجم هیپوکامپ یا افزایش آسیب مادهٔ سفید نشان ندادند. این امر پیشنهاد میدهد که پیوند بین گلوکز پساوعده و آلزایمر ممکن است از طریق مسیرهای متابولیک یا التهابی ظریفتر عمل کند و نه از طریق از بین رفتن بافت گستردهای که بهراحتی در MRI استاندارد دیده شود.
نویسندگان مطالعه نیاز به درک مکانیزمها را برجسته کردهاند: مغز بهعنوان یک بافت بسیار پرمصرف انرژی، به گلوکز متکی است و فشار متابولیک مکرر پس از وعدهٔ غذایی، التهاب مزمن یا آسیب اکسیداتیو به نورونها میتواند بهتدریج در طول سالها تجمع یابد و عملکرد سیناپسی و سلامت سلولی را مختل کند. با این حال، آبشار مولکولی دقیقی که نشان دهد جهشهای کوتاهمدت قند خون چگونه ممکن است به پلاکها، تنگلها یا اختلالات سیناپسی مشخصهٔ آلزایمر تبدیل شوند، هنوز بهخوبی تعریف نشده و نیاز به بررسیهای بیومولکولی و سلولی دارد.
از منظر تصویربرداری عصبی، نبود ارتباط با معیارهای ساختاری کلی نشان میدهد که آسیبهای اولیه ممکن است در سطح عملکردی، بیوشیمیایی یا هماهنگی شبکههای عصبی رخ دهد و تنها در مراحل پیشرفتهتر یا در نمونههای طولی قابل مشاهدهٔ ساختاری باشد. بهعبارت دیگر، تغییرات متابولیک و التهابی میتواند قبل از هر گونه تحلیل حجمی یا نمایان شدن ضایعات مادهٔ سفید رخ دهد و بنابراین مطالعات طولی با نشانگرهای زیستی (biomarkers) و تصویربرداری پیشرفتهتر (مثل PET برای آمیلوئید/تاو یا MRI عملکردی) لازم است.
Why Mendelian randomization matters
- Mendelian randomization سوگیریهای ناشی از شیوهٔ زندگی یا علیت معکوس را با استفاده از واریانتهای ژنتیکی بهعنوان آزمایشهای طبیعی کاهش میدهد.
- اگر زمینهٔ ژنتیکی برای قند خون بالاتر دو ساعته ریسک بیماری را افزایش دهد، این امر از نقش احتمالی علّی افزایش قند پساوعده حمایت میکند.
- با این حال، یافتههای ژنتیکی نیاز به تکرار در گروههای متنوع و آزمایشهای مکمل تجربی برای نقشهبرداری از مکانیزمها دارد.
اپیدمیولوژیست ارشد، اندرو میسون (دانشگاه لیورپول)، پیامدهای عملی را چنین بیان میکند: کنترل قند خون ممکن است نیازمند دقتی فراتر از سنجشهای ناشتا باشد — هدفگذاری بر روی جهشهای پس از غذا میتواند برای سلامت بلندمدت مغز اهمیت داشته باشد. ویکی گارفیلد، اپیدمیولوژیست ژنتیکی نیز در لیورپول هشدار میدهد که تکرار نتایج ضروری است، بهخصوص در جمعیتهایی که از نظر نژادی و اجتماعی-اقتصادی متنوعتر از مجموعهدادهٔ اولیه هستند.
Limitations and public-health perspective
مجموعهدادهٔ اصلی که از UK Biobank استخراج شده، تمایل به شرکتکنندگانی دارد که وضعیت سلامتی نسبی بهتر و سطح اجتماعی-اقتصادی بالاتر دارند و تنها شامل افراد با پیشینهٔ سفید بریتانیایی بود. تیم نتوانست این یافته را در یک مجموعهٔ ژنتیکی قدیمیتر و کوچکتر شامل 111,326 نفر بازتولید کند؛ تفاوتها در انتخاب شرکتکنندهها یا طراحی مطالعه ممکن است اختلاف را توضیح دهند. این بدان معناست که پیوند جالب اما موقتی و نیازمند اعتبارسنجیهای بیشتر است.
برای پزشکان و عموم مردم، مطالعه توصیههای تثبیتشده را تقویت میکند: کاهش نوسانات شدید قند خون پس از وعدهها میتواند به سلامت قلبی-عروقی و متابولیک کمک کند و شاید اکنون برای کاهش ریسک زوال عقل هم اهمیت داشته باشد. اقدامات عملی شامل مصرف وعدههای غذایی متوازن با فیبر بالا و پروتئین یا چربیهای سالم برای کاهش جهش قند، فعالیت بدنی برنامهریزیشده بعد از غذا برای کمک به جذب گلوکز، و مدیریت دارویی در صورت نیاز میشود. مطالعات مداخلهای هدفمند لازم است تا مشخص شود آیا کاهش قند پساوعده واقعاً میتواند وقوع آلزایمر را کاهش دهد یا خیر.
از منظر سلامت عمومی، اگر رابطهٔ سببی بین قند خون پساوعده و آلزایمر تأیید شود، پیامدهای گستردهای خواهد داشت: سیاستهای تغذیهای، توصیههای بالینی برای سنجش قند پساوعده (مثل تست تحمل گلوکز یا اندازهگیری گلوکز دو ساعته)، و برنامههای پیشگیری جامعهمحور که تمرکزشان بر الگوهای غذایی و فعالیت بعد از غذا است، ممکن است مورد بازنگری قرار گیرند. این امر همچنین میتواند روی توسعهٔ مداخلات دارویی یا تغییر سبک زندگی که مستقیماً بر کاهش نوسانات گلوکز پس از صرف غذا تمرکز دارند، تأثیر بگذارد.
چالشهای بعدی در تحقیق شامل تکرار این سیگنالهای ژنتیکی در افراد با خاستگاههای ژنتیکی مختلف، دنبالکردن مکانیزمهای سلولی در مدلهای حیوانی و سلولی، و انجام کارآزماییهای تصادفیشدهٔ بالینی است که بهصورت هدفمند جهشهای پساوعدهٔ گلوکز را کاهش دهند تا ببینیم آیا این اقدام ریسک زوال عقل یا آلزایمر را تغییر میدهد یا خیر. علاوه بر این، ترکیب اطلاعات ژنتیکی با زیستنشانگرهای مایع (مثل نشانگرهای التهابی یا نورونال در سرم و مایع مغزی-نخاعی) و تصویربرداری مولکولی میتواند حلقهٔ علت و معلول را شفافتر کند.
منبع: sciencealert
نظرات
حامد
69% خیلی چشمگیره اما نمونه محدود و گروه تکنژادیه، و نبود سیگنال واضح در MRI یعنی هنوز تا قطعیت راهه، عجله نکنیم
بیونیکس
تو مطب دیدهام بیمارهایی که جهش قند بعد غذا داشتن حافظهشون ضعیف شد، ولی ژن و علیّت؟ باید longitudinal و بیومارکر بذاریم، کار زیاد هست
توربوآر
نکته عملی به نظرم سادهس: کم کردن نوسان قند با فیبر و حرکت بعد غذا. شواهد هنوز ناقص اما مسیر منطقیه.
کوینباز
این واقعاً اثبات شده ست؟ داده ها از UK Biobank و فقط افراد سفید؛ ممکنه سوگیری وجود داشته باشه، کی بازتولیدش میکنه؟
دیتاپالس
واقعا شوکه شدم... اینکه جهش کوتاه قند بعد غذا ممکنه ریسک آلزایمر رو زیاد کنه، هم ترسناک هم یهجورایی منطقیه، باید بیشتر ببینیم


ارسال نظر